
北京化工大学2012—2013学年第一学期 国际班《基础化学》期中考试试卷 课程代码CHM10700T 班级: 姓名: 学号: 分数: 题号 三 必 总分 得分 所有题目全部答在试卷上 一、选择题(在下列各题中,选择出符合题意的答案,并将其代码填入括号内) (本大题共10小题,每小题2分,共20分) 题号1 2 3 4 56 78910 1,下列各组分子中,化学键均有极性,但分子偶极矩均为零的是( (A)SO2、BCl、PCl (B)NO2、PCl、CH4: (C)N2、CS2、NH3: (D)CCl4、BF3、CO2: 2.298K时,下列物质的标准摩尔生成自由焓不为零的是()。 (A)Cl(I) (B)Zn(s) (C)P(伯磷,s) (D)Brz(l) 3.下列分子或离子中键角最小的是( e (A)PH3 (B)NH3 (C)CH4 (D)SO2 4.用量子数描述的下列原子轨道中,可以容纳电子数最多的是( (A)=4,0(B)=5,=2 (C)P4,=3(D)P3,1 5.在298K,真空容器中放入BaCl2H,O,发生反应BaCl2H,0(s)→BaCl2(s+H2O(g)。反应 的平衡压强为330Pa。则该反应的△rG品为:()。 (A)-4.3kJ-mol! (B)-14.2kJ-mol (C)139kJ-morl (D)14.2kJ-mor 6.关于熵,下列叙述中正确的是()。 (A)298K时,纯物质的熵S=0; (B)在一定的温度条件下,一切单质的嫡S=0 (C)对孤立体系而言,4S>0的反应总是自发进行的 (D)在一个反应过程中,随着生成物的增加,嫡变增大。 7.已知298K时反应2HCI(g)=H(g+C1(g)的△rH品=184.6Jmo,则HCI(g)的标准摩尔生成 焓等于()。 (A)-184.6kJ-mol- (B)-92.3kJ-mol (C)184.6kJ-mol- (D)92.3kJ-mol 8.下面有关准确度与精密度的关系表述正确的是( 第1页
北京化工大学 2012——2013 学年第一学期 国际班《基础化学》期中考试试卷 课程代码 C H M 1 0 7 0 0 T 班级: 姓名: 学号: 分数: 题号 一 二 三 四 五 总分 得分 所有题目全部答在试卷上 一、选择题(在下列各题中,选择出符合题意的答案,并将其代码填入括号内) (本大题共 10 小题,每小题 2 分,共 20 分) 题号 1 2 3 4 5 6 7 8 9 10 答案 D A A C D C B C B B 1.下列各组分子中,化学键均有极性,但分子偶极矩均为零的是( )。 ( A) SO2、BCl3、PCl3 (B) NO2、PCl3、CH4; (C) N2、CS2、NH3; (D) CCl4、BF3、CO2; 2.298K 时,下列物质的标准摩尔生成自由焓不为零的是( )。 (A) Cl2(l) (B) Zn(s) (C) P4 (白磷, s) (D) Br2(l) 3. 下列分子或离子中键角最小的是( )。 (A) PH3 (B) NH3 (C) CH4 (D) SO4 2- 4.用量子数描述的下列原子轨道中,可以容纳电子数最多的是( )。 (A) n=4,l=0 (B) n=5,l=2 (C) n=4,l=3 (D) n=3,l=1 5.在 298K,真空容器中放入BaCl2·H2O,发生反应 BaCl2·H2O (s)→BaCl2(s)+ H2O(g)。反应 的平衡压强为 330Pa。则该反应的ΔrG 为:( )。 (A) -4.3kJ·mol-1 (B) -14.2kJ·mol-1 (C) 139kJ·mol-1 (D) 14.2kJ·mol-1 6.关于熵,下列叙述中正确的是( )。 (A) 298K 时,纯物质的熵S= 0 ; (B) 在一定的温度条件下,一切单质的熵S= 0 (C) 对孤立体系而言,⊿S > 0 的反应总是自发进行的 ; (D) 在一个反应过程中,随着生成物的增加,熵变增大。 7.已知 298K时反应 2HCl(g) = H2(g)+Cl2(g)的△rH =184.6kJ·mol-1,则HCl(g)的标准摩尔生成 焓等于( )。 (A)-184.6kJ·mol-1 (B) -92.3kJ·mol-1 (C) 184.6kJ·mol-1 (D)92.3kJ·mol-1 8.下面有关准确度与精密度的关系表述正确的是( ) 第 1 页

(A)精密度高则准确度高 (B)准确度高不要求精密度要高 (C)准确度高则要求精密度一定要高 (D)准确度是保证精密度的前提 9.在密闭容器中,2S0(g+0(g)一2S0(g)的反应速率可以表示为( dc(02) -dc(S02) -2dc(S03) -dc(SO3)) (A) dt (B) 2dt (C) dt (D) 2dt 10.在某温度条件下,反应NH,CI(S)一NH,(g)+HC1(g)的标准平衡常数K°=0.150,在 此温度时,将足够量的NH,C1(S)放入一真空容器中,则平衡后混合气体总压是()。 (A)38.7kPa(B)77.5kPa(C)0.775kPa (D)0.15 kPa 二、是非题(判断下列叙述是否正确,正确的在括号中画V,错误的画×) (本大题共12小题,每小题1分,共12分) (√)1.基态时具有s'最外层电子结构的原子不一定都是碱金属。 (×)2.乙烯分子中,C-C双键的健能是C-C单键键能的二倍。 (×)3.若某一系统属于封闭系统,则说明该系统与环境既有能量交换也有物质交换。 ×)4.当化学反应的平衡常数很大时,化学反应速率系数也很大,因此该反应能很快进 行 (×)5.在恒温恒压下,下列两个生成液态水的化学方程式所表达的反应放出的热量相同。 (√)6.在单电子原子中,原子轨道的能量只与主量子数n有关,n越大,能级越高。 (√)7.pH=12.06的有效数字位数是两位 (×)8.催化剂能加快反应速率,使化学平衡发生移动。 (×)9.所有气体单质的标准摩尔生成焓都为零。 (×)10.诱导力存在于所有的分子之间,而色散力只存在于极性分子与非极性分子之间。 H(g+1/202(gFH0: 2H(g+02(g)F2H,00) (×)11.称量用的砝码腐蚀会引起偶然误差。 (×)12.SO2分子和H20分子的空间构型均为V型,它们的中心原子采取相同方式的杂化 轨道成键。 三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值) (本大题分10小题,每空1分,共20分) 1.3.286×0.753+0.0021-0.0475×0.00814=2.48 2.在恒压下,某系统吸收了2.8×10J的热量,同时环境对系统做了4.6×10J的功,则系统的 △H-2.8×10L ,△U-7.4x10L 3.己知反应2NO(g)一NgHO(g,△H2<0,那么温度降低时,K°将增大,平衡将向 向右移动:生成物浓度增加时,则K将不变一,平衡将向向左移动。 4.某反应的活化能E=114kJmo。在600K时,反应速率系数k=0.75moLs,则700K时 的反应速率系数k=20mLs之 5.在25℃和相同的初始压力下,将5.00LN(g)和15.0LO(g)充入容积为10.0L的真空 容器中,混合气体的总压力为152kPa,则分压力pN2)=38kPa,pO2)=_114kPa: 第2页
(A) 精密度高则准确度高 (B) 准确度高不要求精密度要高 (C) 准确度高则要求精密度一定要高 (D)准确度是保证精密度的前提 9.在密闭容器中,2SO2(g)+O2(g) 2SO3(g)的反应速率可以表示为 ( )。 (A) dt dc )O( 2 (B) dt dc 2 )SO( − 2 (C) dt − dc 3 )SO(2 (D) dt dc 2 )SO( − 3 10.在某温度条件下, 反应NH4Cl (s) NH3 (g) + HCl (g) 的标准平衡常数K = 0.150, 在 此温度时,将足够量的NH4Cl (s)放入一真空容器中,则平衡后混合气体总压是( )。 (A) 38.7 kPa (B) 77.5 kPa (C) 0.775kPa (D) 0.15 kPa 二、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (本大题共 12 小题,每小题 1 分,共 12 分) ( √ )1.基态时具有ns 1 最外层电子结构的原子不一定都是碱金属。 ( × )2.乙烯分子中,C-C 双键的键能是 C-C 单键键能的二倍。 ( × )3.若某一系统属于封闭系统,则说明该系统与环境既有能量交换也有物质交换。 ( × )4.当化学反应的平衡常数很大时,化学反应速率系数也很大,因此该反应能很快进 行。 ( × )5.在恒温恒压下,下列两个生成液态水的化学方程式所表达的反应放出的热量相同。 ( √ )6.在单电子原子中,原子轨道的能量只与主量子数 n 有关,n 越大,能级越高。 ( √ )7.pH =12.06 的有效数字位数是两位。 ( × )8.催化剂能加快反应速率,使化学平衡发生移动。 ( × )9.所有气体单质的标准摩尔生成焓都为零。 ( × )10.诱导力存在于所有的分子之间,而色散力只存在于极性分子与非极性分子之间。 H2(g)+1/2O2(g)=H2O(l); 2H2(g)+O2(g)=2H2O(l)。 ( × )11.称量用的砝码腐蚀会引起偶然误差。 ( × )12.SO2分子和H2O分子的空间构型均为V型,它们的中心原子采取相同方式的杂化 轨道成键。 三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值) (本大题分 10 小题,每空 1 分,共 20 分) 1.3.286×0.753 + 0.0021 − 0.0475×0.00814 = 2.48 。 2.在恒压下,某系统吸收了 2.8×102 J的热量,同时环境对系统做了 4.6×102 J的功,则系统的 △H=____2.8×102 J ________,△U= ___7.4×102 J ________。 3.已知反应 2NO(g) N2(g)+O2(g),ΔrH <0,那么温度降低时,K 将__增大____,平衡将向 ___向右___移动;生成物浓度增加时,则K 将__不变______,平衡将向___向左___移动。 4.某反应的活化能Ea=114kJ·mol-1 。在 600K时,反应速率系数k = 0.75 mol-1·L·s-1,则 700K时 的反应速率系数k = 20 mol-1·L·s-1 。 5.在 25℃和相同的初始压力下, 将 5.00 L N2(g)和 15.0 L O2(g)充入容积为 10.0 L的真空 容器中,混合气体的总压力为 152 kPa,则分压力p (N2 ) = _38__kPa,p(O2 ) = _114__kPa。 第 2 页
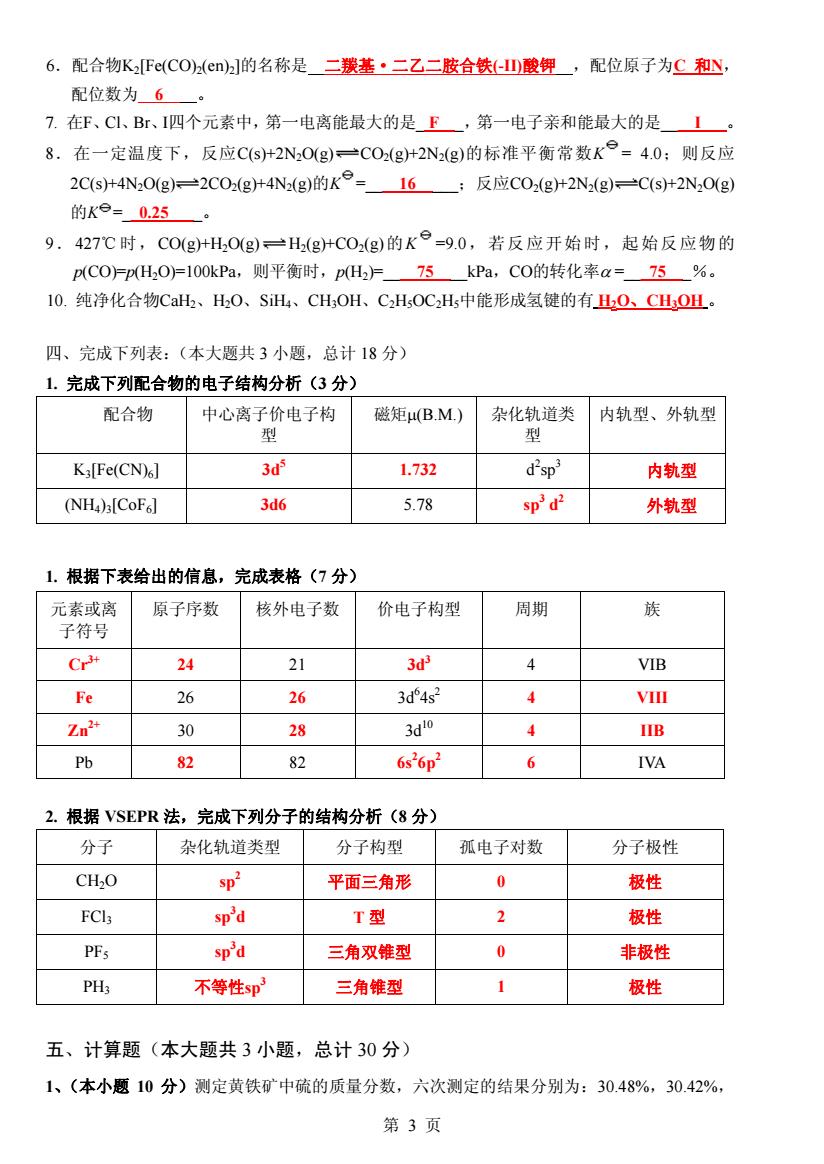
6.配合物KFc(COa(en]的名称是二羰基·二乙二胺合铁山酸钾,配位原子为C和y 配位数为6 7.在F、C1、Br、I四个元素中,第一电离能最大的是F,第一电子亲和能最大的是1 8.在一定温度下,反应C(S+2N,O(g)一COg+2N2(g)的标准平衡常数K°=4.0:则反应 2C(s+4N2Og)=2C0(g+4N(g)的K°-=16;反应C02(g+2N2(g)一C(S+2N,0(g) 的Ke=0.25 9.427℃时,C0(g+H,0g)H(g+C0(g)的K=9.0,若反应开始时,起始反应物的 p(CO)=P(H,OF100kPa,则平衡时,pH2F75_kPa,CO的转化率a=75_%。 10.纯净化合物CaH、H,O、SiHL、CH,OH、CH,OC2H5中能形成氢键的有O、CHOL.。 四、完成下列表:(本大题共3小题,总计18分) 1.完成下列配合物的电子结构分析(3分) 配合物 中心离子价电子构 磁矩μ(B.M) 杂化轨道类 内轨型、外轨型 型 型 Ka[Fe(CN)6] 3 1.732 d'sp 内轨型 (NH)[CoFal 3d6 5.78 sp'd2 外轨型 1.根据下表给出的信息,完成表格(7分) 元素或离 原子序数 核外电子数 价电子构型 周期 族 子符号 Cr 24 21 3 4 VIB Fe 26 26 3d4s2 4 VIll Zn 30 28 3d0 4 IIB Pb 82 82 6s26p2 6 IVA 2.根据VSEPR法,完成下列分子的结构分析(8分) 分子 杂化轨道类型 分子构型 孤电子对数 分子极性 CH2O sp2 平面三角形 0 极性 FCl3 sp'd T型 2 极性 PFs sp'd 三角双锥型 0 非极性 PH3 不等性sp 三角维型 1 极性 五、计算题(本大题共3小题,总计30分) 1、(本小题10分)测定黄铁矿中硫的质量分数,六次测定的结果分别为:30.48%,30.42% 第3页
6.配合物K2[Fe(CO)2(en)2]的名称是 二羰基·二乙二胺合铁(-II)酸钾 ,配位原子为C 和N, 配位数为 6 。 7. 在F、Cl、Br、I四个元素中,第一电离能最大的是_ F _,第一电子亲和能最大的是____I___。 8.在一定温度下,反应C(s)+2N2O(g) CO2(g)+2N2(g)的标准平衡常数K = 4.0;则反应 2C(s)+4N2O(g) 2CO2(g)+4N2(g)的K =____16_____;反应CO2(g)+2N2(g) C(s)+2N2O(g) 的K =__0.25____。 9.427℃时,CO(g)+H2O(g) H2(g)+CO2(g)的K =9.0,若反应开始时,起始反应物的 p(CO)=p(H2O)=100kPa,则平衡时,p(H2)=____75____kPa,CO的转化率α =___75___%。 10. 纯净化合物CaH2、H2O、SiH4、CH3OH、C2H5OC2H5中能形成氢键的有 H2O、CH3OH 。 四、完成下列表:(本大题共 3 小题,总计 18 分) 1. 完成下列配合物的电子结构分析(3 分) 配合物 中心离子价电子构 型 磁矩μ(B.M.) 杂化轨道类 型 内轨型、外轨型 K3[Fe(CN)6] 3d5 1.732 d2 sp 3 内轨型 (NH4)3[CoF6] 3d6 5.78 sp3 d2 外轨型 1. 根据下表给出的信息,完成表格(7 分) 元素或离 子符号 原子序数 核外电子数 价电子构型 周期 族 Cr3+ 24 21 3d3 4 VIB Fe 26 26 3d6 4s2 4 VIII Zn2+ 30 28 3d10 4 IIB Pb 82 82 6s2 6p2 6 IVA 2. 根据 VSEPR 法,完成下列分子的结构分析(8 分) 分子 杂化轨道类型 分子构型 孤电子对数 分子极性 CH2O sp 2 平面三角形 0 极性 FCl3 sp3 d T 型 2 极性 PF5 sp3 d 三角双锥型 0 非极性 PH3 不等性sp3 三角锥型 1 极性 五、计算题(本大题共 3 小题,总计 30 分) 1、(本小题 10 分)测定黄铁矿中硫的质量分数,六次测定的结果分别为:30.48%,30.42%, 第 3 页

30.59%,30.51%,30.56%,30.49%,计算置信水平为95%时平均值的置信区间。 附表1:Q值表 测定次数 3 4 5 6 7 0.94 0.760.64 0.560.51 0.970.840.73 064 0.59 附表2:t分布表 置信度90% 置信度95% 2.13 2.776 2.015 2.571 1.943 2.447 1.895 2.365 解:可疑值30.42%检验 0t-0.35<0-0.64 应保留 (4分) x=30.51% (1分) 5=0.06% (2分) 4=30.51%士0.06% (3分) 2、(本题10分)设反应CuBr(S)一CuBr(S)+1/2Br(g)在不同温度下达到平衡时,Br(g) 的压强分别为:T1=450K,p1=0.6798kPa:T=550K,p2-67.98kPa。计算该反应在298K下的 △,G品,△,H品,△5及标准平衡常数K°。 解:反应CuBrz(s)CuBr(s)+1/2Br,lg T=450K,pP1-0.6798kPa,K,9=(pp)5-0.08240 (1分) 1-550K,pm-67.98kPh,k2°-pp9)0.3240 (1分) 由n=△(-之可得 K 0.824011 4,H月8=R1n3M1-=831400s2404503501000=4738kmol (2分) 由nK。-4+△S可得 RT A.S R(nk) RT =8.314×0n0.08240)+8.314×450 47380.6 =84.54J/(mol.K) (2分) 由△,G(298)=△H-298△.S=47.38-298×84.54/1000-22.19k/mol (2分) 第4页
30.59%,30.51%,30.56%,30.49%, 计算置信水平为 95%时平均值的置信区间。 附表 1:Q 值表 测定次数 3 4 5 6 7 Q0.90 0.94 0.76 0.64 0.56 0.51 Q0.95 0.97 0.84 0.73 0.64 0.59 附表 2:t 分布表 f=n-1 置信度 90% 置信度 95% 4 2.132 2.776 5 2.015 2.571 6 1.943 2.447 7 1.895 2.365 解:可疑值 30.42%检验 Q计=0.35< Q表=0.64 应保留 (4 分) x = 30.51% (1 分) s=0.06% (2 分) μ=30.51%±0.06% (3 分) 2、(本题 10 分)设反应CuBr2(s) CuBr(s) + 1/2Br2(g) 在不同温度下达到平衡时,Br2(g) 的压强分别为:T1= 450K,p1=0.6798kPa;T2=550K,p2=67.98kPa。计算该反应在 298K下的 及标准平衡常数K 。 解:反应 CuBr2(s) CuBr(s) + 1/2Br2(g) T1= 450K,p1=0.6798kPa, K1 =(p1/p )0.5=0.08240 (1 分) T2=550K,p2=67.98kPa, K2 =(p2/p )0.5=0.8240 (1 分) 由 ) 11 ln ( 21 θ mr θ 1 θ 2 TTR H K K − Δ = 可得 1000/) 550 1 450 1 /( 08240.0 8240.0 ln314.8) 11 /(ln 21 θ 1 θ θ 2 mr =Δ =− − K TT K RH =47.38 kJ/mol (2 分) 由 R S RT H K θ mr 1 θ θ mr 1 ln Δ + Δ −= 可得 ) 450314.8 6.47380 )08240.0(ln(314.8 (ln ) 1 θ θ mr 1 θ mr × ×= + Δ +=Δ RT H KRS =84.54 J/(mol·K) (2 分) 由 )298( 298 1000/54.8429838.47 =22.19 kJ/mol (2 分) θ mr θ mr θ Δ Gmr H S ×−=Δ−Δ= 第 4 页

InK°(298)=-△,G8(298=-22.19×1000 -8.956 RT 8.314×298 k9(298)=1.29×10 (2分) 3、(本小题10分)己知373K时反应CO(g)+C2(g尸COC12(g)在恒温恒容条件下进行,反应的 k=1.5x10°。反应开始时c(C0)=0.035molL,co(C2)=0.027moL,ca(C0Cl2)=0,试计 算373K反应达到平衡时各物种的分压及CO的平衡转化率。 解:设平衡体系中C2的分压为xKpa。 CO(g) Cl (g)= COCI(g) 开始cB/(molL-1) 0.0350 0.0270 0 开始pB/kPa 108.5 83.7 0 平衡pB/kPa 108.5-83.7-x)1 (83.7-x) =24.8+x (2分) K9= Pcoc,/p (83.7-x)/100 ,p12X高 =1.5×108 x=2.3×10-6 (4分) 平衡时: p(CO)=24.8kPa (1分) p(C)=2.3×106kPa (1分) p(COClz)=83.7kPa (1分) Pco-Pcol×100%=77.1% (1分) a(co) Po(co) 第5页
298314.8 )298( 100019.22 )298(ln θ θ mr × × −= Δ −= RT G K =-8.956 K (298)=1.29×10-4 (2 分) 3、(本小题 10 分)已知 373K时反应CO(g)+Cl2 (g)= COCl2(g) 在恒温恒容条件下进行,反应的 K =1.5×108 。反应开始时c0(CO)=0.035 mol·L-1, c0(Cl2)=0.027 mol·L-1, c0(COCl2)=0,试计 算 373K反应达到平衡时各物种的分压及CO的平衡转化率。 解:设平衡体系中 Cl2 的分压为 x Kpa。 CO(g) + Cl2 (g) = COCl2(g) 开始 cB/(mol·L-1) 0.0350 0.0270 0 开始 pB/kPa 108.5 83.7 0 平衡 pB/kPa 108.5-[(83.7-x) ] x (83.7-x) =24.8+x (2 分) ( ) (4 分) 平衡时: p(CO)=24.8kPa (1 分) 2 分) ) 100 )( 100 8.24 ( 100/7.83 ]/][/[ / θ Cl θ CO θ θ COCl 2 2 xx x pppp pp K + − = = 8 ×= 105.1 −6 x ×= 103.2 p(Cl )=2.3 ×10-6 kPa (1 p(COCl2)=83.7kPa (1 分) ( ) ( ) (1 分) ( ) ( ) %100 O CO × 0 C 0 CO eq CO − α = %1.77 p = pp 第 5 页