
硫酸铜的提纯及产品质量和性能的分析 工.硫酸铜的提纯 一、实验目的 1.掌握化学实验的基本操作:溶解、搅拌、加热、过滤、蒸发、结晶、抽滤等: 2.掌握可溶性物质的重结晶提纯方法。 二、 实验原理 利用不同物质在同一种溶剂中的溶解度不同的性质,可将含有不溶性杂质和可溶性杂质 的物质提纯。粗硫酸铜(胆矾CuSO:·5H0)中含有不溶性杂质和可溶性杂质,其中可溶性 杂质中以Fe2+,Fe3计(如FeSO4,Fez(SO等)对硫酸铜的品质影响较大,并且含量也较高。 提纯操作中,先将粗CuSO4·5H,0溶于热水中,用氧化剂H,02将Fe2*氧化为Fe后, 调节溶液的pH值至4,使Fe+水解为Fe(OH沉淀,趁热过滤,以除去不溶性杂质。然后, 蒸发浓缩所得的滤液,使CuSO4·5H0结晶出来。其它微量可溶性杂质在硫酸铜结晶时,因 为量比较少,尚处于未饱和状态,故仍留在母液中,当将其抽滤时,就可以得到较纯的硫酸 铜晶体。 上述物质的提纯方法叫重结晶法,此法适合提纯在某一溶剂中不同温度下溶解度变化较 大的物质。欲得更纯的晶体可以多次重结晶。 本实验采用沉淀分离法和重结晶法结合,将硫酸铜提纯。有关分离部分的反应式为: 2FeSO,+H2O2+H2SO4 Fe2(SO4)3+2H2O Fe3++3H0→Fe(OH3+3H 由于溶液中的Fe+,Fe*,Cu水解时均可生成氢氧化物沉淀,但这些氢氧化物(Fe(O2,Fe (OH3,Cu(OH)2)的沉淀条件是不同的.根据沉淀理论,它们产生沉淀和完全沉淀所需要的OH 浓度(即pH值)是不同的。当pH=4时,Fe2,Cu2均不发生沉淀,而Fe2己完全沉淀。为了使 Fe2+也被除去,可以将其氧化成Fe3+. 三、仪器与试剂 1.仪器 研体:台称:漏斗和漏斗架;布氏漏斗:吸滤瓶和抽滤泵:蒸发皿:100ml烧杯(2个):滴管: 铁三角架:石棉网:牛角匙:玻棒:试管:剪刀。 2.药品 2mol/LHCL2mol/LH2sOg,1mol/LNaOH:6mol/LNH·H2O,1mol/L KCNS,3%H2O2;称量纸: 滤纸:pH试纸
硫酸铜的提纯及产品质量和性能的分析 I. 硫酸铜的提纯 一、 实验目的 1. 掌握化学实验的基本操作:溶解、搅拌、加热、过滤、蒸发、结晶、抽滤等; 2. 掌握可溶性物质的重结晶提纯方法。 二、 实验原理 利用不同物质在同一种溶剂中的溶解度不同的性质,可将含有不溶性杂质和可溶性杂质 的物质提纯。粗硫酸铜(胆矾 CuSO4·5H2O)中含有不溶性杂质和可溶性杂质,其中可溶性 杂质中以 Fe2+,Fe3+(如 FeSO4, Fe2(SO4)3 等)对硫酸铜的品质影响较大,并且含量也较高。 提纯操作中,先将粗 CuSO4·5H2O 溶于热水中,用氧化剂 H2O2 将 Fe2+氧化为 Fe3+后, 调节溶液的 pH 值至 4,使 Fe3+水解为 Fe(OH)3 沉淀,趁热过滤,以除去不溶性杂质。然后, 蒸发浓缩所得的滤液,使 CuSO4·5H2O 结晶出来。其它微量可溶性杂质在硫酸铜结晶时,因 为量比较少,尚处于未饱和状态,故仍留在母液中,当将其抽滤时,就可以得到较纯的硫酸 铜晶体。 上述物质的提纯方法叫重结晶法,此法适合提纯在某一溶剂中不同温度下溶解度变化较 大的物质。欲得更纯的晶体可以多次重结晶。 本实验采用沉淀分离法和重结晶法结合,将硫酸铜提纯。有关分离部分的反应式为: 2FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + 2H2O Fe3+ + 3H2O → Fe (OH)3 + 3H+ 由于溶液中的 Fe3+,Fe2+,Cu2+水解时均可生成氢氧化物沉淀,但这些氢氧化物(Fe (OH)2 , Fe (OH)3 ,Cu (OH)2)的沉淀条件是不同的。根据沉淀理论,它们产生沉淀和完全沉淀所需要的 OH- 浓度(即 pH 值)是不同的。当 pH=4 时,Fe2+,Cu2+均不发生沉淀,而 Fe2+已完全沉淀。为了使 Fe2+也被除去,可以将其氧化成 Fe3+。 三、 仪器与试剂 1. 仪器 研钵;台称;漏斗和漏斗架;布氏漏斗;吸滤瓶和抽滤泵;蒸发皿;100ml 烧杯(2 个);滴管; 铁三角架;石棉网;牛角匙;玻棒;试管;剪刀。 2. 药品 2mol/LHCl; 2mol/LH2SO4; 1mol/LNaOH;6mol/L NH3·H2O;1mol/L KCNS; 3%H2O2; 称量纸; 滤纸;pH 试纸

四、 实验步骤 1.疏酸铜的提纯 (1)称量和溶解 将粗硫酸铜用研体研细,用台称称取4g己研细的粗硫酸铜,放入己洗涤清洁的100ml烧 杯中。用量简量取10ml去离子水,将水加入上述烧杯中,然后把烧杯放在石棉网上小火加热 并用玻棒搅拌。当硫酸铜完全溶解时,立即停止加热。 (2)沉淀 往溶液中加入几滴稀H2S04酸化,再加入2ml左右3%H202溶液,微微加热,使其充分反 应。然后逐滴加入1mol/LNaOH溶液,开始时可以快加,快到pH值等于4时,应边加边检 验pH值,直到pH=4。(用pH试纸检验。在用pH试纸检验溶液的酸碱性时,应将小块试纸 放在干燥的清洁表面皿上,用玻璃棒蘸取检验溶液,滴在试纸上,切不可将试纸投入溶液中 检验)。 (3)过滤 可用常压和减压两种方法之一进行过滤。 ①常压过滤将折好的滤纸放入漏斗中,用滴管滴加少量的去离子水润湿滤纸,使之紧贴在 漏斗壁上。将漏斗放在漏斗架上,将步骤(2)中调好pH值的硫酸铜溶液加热并趁热过滤。滤 液承接在清洁的蒸发皿中,用滴管以少量的去离子水淋洗烧杯和玻璃棒,洗涤水也必须全部 滤入蒸发皿中。 ②减压过滤将布氏漏斗和抽滤瓶都用水洗净,并用去离子水淋洗23遍剪好滤纸放入布氏漏 斗中,用少量去离子水润湿滤纸,抽气使滤纸紧贴布氏漏斗,加热步骤(2)中调好pH值的硫酸铜 溶液并趁热过滤,滤完后以少量水洗涤沉淀将滤液移至蒸发皿中备用。 (4)蒸发和结晶 在滤液中加12滴稀HS04使溶液酸化,然后在石棉网上加热,蒸发、浓缩(勿加热过猛, 以免液体飞溅损失)至溶液表面刚出现薄层结晶时,立即停止加热(注意不可蒸干!为什么?): 待蒸发皿冷却至室温或稍冷却片刻后将蒸发皿放在盛有冷水的烧杯上冷却,使Cu$045H,0 晶体大量析出。 (⑤)抽滤分离 将蒸发皿内CuSO45H2O晶体和母液全部转移到布氏漏斗中,抽气过滤,尽量抽干,并用 干净的玻璃棒轻压布氏漏斗内的晶体,以尽可能除去晶体间夹带的母液,停止抽气过滤,取 出晶体,把它摊在两张滤纸之间,轻压滤纸吸干产品,将产品包好,留待质量检验用
四、 实验步骤 1. 硫酸铜的提纯 (1) 称量和溶解 将粗硫酸铜用研钵研细,用台称称取 4g 已研细的粗硫酸铜,放入已洗涤清洁的 100ml 烧 杯中。用量筒量取 10ml 去离子水,将水加入上述烧杯中,然后把烧杯放在石棉网上小火加热, 并用玻棒搅拌。当硫酸铜完全溶解时,立即停止加热。 (2) 沉淀 往溶液中加入几滴稀 H2SO4 酸化,再加入 2ml 左右 3%H2O2 溶液,微微加热,使其充分反 应。然后逐滴加入 1mol/LNaOH 溶液,开始时可以快加,快到 pH 值等于 4 时,应边加边检 验 pH 值,直到 pH=4。(用 pH 试纸检验。在用 pH 试纸检验溶液的酸碱性时,应将小块试纸 放在干燥的清洁表面皿上,用玻璃棒蘸取检验溶液,滴在试纸上,切不可将试纸投入溶液中 检验)。 (3) 过滤 可用常压和减压两种方法之一进行过滤。 {常压过滤 将折好的滤纸放入漏斗中,用滴管滴加少量的去离子水润湿滤纸,使之紧贴在 漏斗壁上。将漏斗放在漏斗架上,将步骤(2)中调好 pH 值的硫酸铜溶液加热并趁热过滤。滤 液承接在清洁的蒸发皿中,用滴管以少量的去离子水淋洗烧杯和玻璃棒,洗涤水也必须全部 滤入蒸发皿中。 |减压过滤 将布氏漏斗和抽滤瓶都用水洗净,并用去离子水淋洗 2-3 遍,剪好滤纸放入布氏漏 斗中,用少量去离子水润湿滤纸,抽气使滤纸紧贴布氏漏斗,加热步骤(2)中调好 pH 值的硫酸铜 溶液并趁热过滤,滤完后以少量水洗涤沉淀,将滤液移至蒸发皿中备用。 (4) 蒸发和结晶 在滤液中加 1~2 滴稀 H2SO4 使溶液酸化,然后在石棉网上加热,蒸发、浓缩(勿加热过猛, 以免液体飞溅损失)至溶液表面刚出现薄层结晶时,立即停止加热(注意不可蒸干!为什么?); 待蒸发皿冷却至室温或稍冷却片刻后将蒸发皿放在盛有冷水的烧杯上冷却,使 CuSO4·5H2O 晶体大量析出。 (5) 抽滤分离 将蒸发皿内 CuSO4·5H2O 晶体和母液全部转移到布氏漏斗中,抽气过滤,尽量抽干,并用 干净的玻璃棒轻压布氏漏斗内的晶体,以尽可能除去晶体间夹带的母液,停止抽气过滤,取 出晶体,把它摊在两张滤纸之间,轻压滤纸吸干产品,将产品包好,留待质量检验用

母液倒入公用台上CuSO,母液回收瓶。用台秤称量产品,计算产率。 五、思考题 1.在除去Fe3*杂质时,为什么要控制pH=4? 2.能否加热时调节pH值?为什么? 3,蒸发浓缩时,过早或过晚停火各有什么不利? 4.如果产率过高,可能原因是什么? 5.抽气(减压)过滤操作应注意什么? 6.整个操作过程中哪些因素将导致产品质量下降?应如何避免? II.硫酸铜的质量分析 一、实验目的 1、掌握NaS2O3标准溶液的配制方法: 2、了解用K,Cr,O,标定NaS,O3溶液的原理和方法: 3、掌握碘量法测铜的基本原理和操作条件: 4、了解碘量法的误差来源。 二、实验原理 硫酸铜中铜含量的测定一般采用碘量法 间接碘量法使用的滴定剂是NazS2O3标准溶液,而NazS2O3固体试剂都含有少量杂质, 而且NSzO5H20易风化、潮解,因此不能直接配制其标准溶液,只能先配制成接近需要的 浓度的标准溶液,然后再进一步标定出其准确浓度。 标定NaS2O3标准溶液的基准物有K,Cr2O、KIO,和KBO3等,这些基准物在酸性溶液 中均能与KI作用析出碘,如K2Cr,O,与KI的反应: Cr20,2+61+14H=2Cr++32+7H20 析出的1,可用NaS2O3标准溶液滴定: 12+2S2032=21+S4062 标定时应注意控制的条件是: 1、开始滴定的酸度以0.8~1.0 nol/LHC1为宜,酸度高可提高反应速度,但太高1离子易 被空气氧化,造成较大的标定误差 2、由于KzCr2O,与KI的反应速度较慢,故应在暗处放置一定时间,再用Na2S,03标准
母液倒入公用台上 CuSO4 母液回收瓶。用台秤称量产品,计算产率。 五、 思考题 1. 在除去 Fe3+杂质时,为什么要控制 pH=4? 2. 能否加热时调节 pH 值?为什么? 3. 蒸发浓缩时,过早或过晚停火各有什么不利? 4. 如果产率过高,可能原因是什么? 5. 抽气(减压)过滤操作应注意什么? 6. 整个操作过程中哪些因素将导致产品质量下降?应如何避免? II.硫酸铜的质量分析 一、实验目的 1、掌握 Na2S2O3 标准溶液的配制方法; 2、了解用 K2Cr2O7 标定 Na2S2O3 溶液的原理和方法; 3、掌握碘量法测铜的基本原理和操作条件; 4、了解碘量法的误差来源。 二、实验原理 硫酸铜中铜含量的测定一般采用碘量法。 间接碘量法使用的滴定剂是 Na2S2O3 标准溶液,而 Na2S2O3 固体试剂都含有少量杂质, 而且 Na2S2O3⋅5H2O 易风化、潮解,因此不能直接配制其标准溶液,只能先配制成接近需要的 浓度的标准溶液,然后再进一步标定出其准确浓度。 标定 Na2S2O3 标准溶液的基准物有 K2Cr2O7、KIO3 和 KBrO3 等,这些基准物在酸性溶液 中均能与 KI 作用析出碘,如 K2Cr2O7 与 KI 的反应: Cr2O7 2- + 6I - +14H+ == 2Cr3+ + 3I2 + 7H2O 析出的 I2可用 Na2S2O3 标准溶液滴定: I2 + 2 S2O3 2- == 2I - + S4O6 2- 标定时应注意控制的条件是: 1、开始滴定的酸度以 0.8~1.0mol/LHCl 为宜,酸度高可提高反应速度,但太高 I - 离子易 被空气氧化,造成较大的标定误差。 2、由于 K2Cr2O7 与 KI 的反应速度较慢,故应在暗处放置一定时间,再用 Na2S2O3标准

溶液滴定。若以KIO3为基准物标定NaS2O,溶液则不必。 3、标定时以淀粉溶液作指示剂,但加入不宜过早,应先用NS03溶液滴定至溶液呈淡 黄色时,在加入淀粉溶液,用N2S,O3溶液继续滴定到蓝色恰好消失,即为终点。 淀粉指示剂加入过早,大量的1.与淀粉结合成蓝色物质,这部分碘不易与NSO3反应。 硫酸钥中铜含量的测定是在弱酸性溶液中,铜与过量KI作用,释出等量的碘,用N2S2O 标准溶液测定释出的碘,即可求出铜的含量。反应式为: 2Cu2++41=2Cul↓+2 12+2S20,2=2+S4062 加入过量KI,Cu的还原趋于完全。由于Cu沉淀强烈地吸附2,使测定结果偏低,故 在滴定近终点时,加入适量KSCN,使Cul(Ksp=1.1xI02)转化为溶解度更小的CuSCN (Ksp=4.8×I05),释放出被吸附的2,反应生成的1又可利用,可以使用较少的KI而使反 应进行得更完全。 Cul+SCN=CuSCN↓+I SCN只能在近终点时加入,否则有可能直接还原二价铜离子,使结果偏低: 6Cu+7SCN 4H0 =6CuSCN+S0,+HCN 7H 也可避免有少量的I,被SCN还原。 溶液的H值应控制在3.3-4.0范围内,若pH高于4,二价铜离子发生水解,使反应不 完全,结果偏低,而且反应速度慢,终点拖长:酸度过高,则「被空气中的氧氧化为12(C 催化此反应),使结果偏高。 若溶液中含有Fe2能氧化析出I2,可用NHF2掩蔽,生成FeF。,NHF2又是缓冲剂, 使溶液pH值保持在3.3-4.0。 三、仪器与试剂 1、仪器 分析天平:称量瓶:碘量瓶:容量瓶:移液管:滴定管: 2、试剂 K2Cr2O,固体(细粉末状)基准物或一、二级品:6mol/LHC1:Na2S2035H,0(固体): 20%KI溶液:0.5%淀粉溶液:NaC0,(固体):1:1氨水:;20%NHH2溶液:1:1HAc:10%KSCN 溶液。 四、实验步骤 1、0.1mol/LNa2SO3标准溶液的配制 称取10gNa2S,035H20溶于400mL新煮沸而冷却的去离子水中,待溶解后,加入
溶液滴定。若以 KIO3 为基准物标定 Na2S2O3 溶液则不必。 3、标定时以淀粉溶液作指示剂,但加入不宜过早,应先用 Na2S2O3 溶液滴定至溶液呈淡 黄色时,在加入淀粉溶液,用 Na2S2O3 溶液继续滴定到蓝色恰好消失,即为终点。 淀粉指示剂加入过早,大量的 I2与淀粉结合成蓝色物质,这部分碘不易与 Na2S2O3 反应。 硫酸铜中铜含量的测定是在弱酸性溶液中,铜与过量 KI 作用,释出等量的碘,用 Na2S2O3 标准溶液测定释出的碘,即可求出铜的含量。反应式为: 2Cu2+ + 4I - == 2CuI↓ + I2 I2 + 2 S2O3 2- == 2I - + S4O6 2- 加入过量 KI,Cu2+的还原趋于完全。由于 CuI 沉淀强烈地吸附 I2,使测定结果偏低,故 在滴定近终点时,加入适量 KSCN,使 CuI(Ksp=1.1×10-12)转化为溶解度更小的 CuSCN (Ksp=4.8×10-15),释放出被吸附的 I2,反应生成的 I - 又可利用,可以使用较少的 KI 而使反 应进行得更完全。 CuI + SCN - == CuSCN ↓ + I - SCN - 只能在近终点时加入,否则有可能直接还原二价铜离子,使结果偏低: 6Cu2+ + 7SCN- + 4H2O == 6CuSCN ↓ + SO4 2- + HCN + 7H+ 也可避免有少量的 I2被 SCN- 还原。 溶液的 pH 值应控制在 3.3-4.0 范围内,若 pH 高于 4,二价铜离子发生水解,使反应不 完全,结果偏低,而且反应速度慢,终点拖长;酸度过高,则 I- 被空气中的氧氧化为 I2(Cu2+ 催化此反应),使结果偏高。 若溶液中含有 Fe3+能氧化 I- 析出 I2,可用 NH4HF2掩蔽,生成 FeF6 3- ,NH4HF2又是缓冲剂, 使溶液 pH 值保持在 3.3-4.0。 三、仪器与试剂 1、仪器 分析天平;称量瓶;碘量瓶;容量瓶;移液管;滴定管; 2、试剂 K2Cr2O7 固体(细粉末状)基准物或一、二级品;6mol/LHCl;Na2S2O3⋅5H2O(固体); 20%KI 溶液;0.5%淀粉溶液;Na2CO3(固体);1:1 氨水;;20%NH4HF2溶液;1:1HAc;10%KSCN 溶液。 四、实验步骤 1、0. 1mol/L Na2S2O3 标准溶液的配制 称取 10g Na2S2O3⋅5H2O 溶于 400mL 新煮沸而冷却的去离子水中,待溶解后,加入

0.1gNa2CO3,搅匀,存于棕色有塞瓶中,放置8一14天后,标定其浓度, 2、NaS2O3标准溶液的标定 准确称取已烘干的K2C2O,固体 g与250mL碘量瓶中,用约20mL水溶解, 加入20%KI溶液10mL,6mol/MHS045mL,混匀后,盖好磨口玻塞并向瓶塞周围吹入少量 去离子水以密封,放于暗处5min,然后用50mL水稀释,用0.1 mol/LNa2S2O3标准溶液滴定, 当溶液由棕色转变为黄绿色时,加入0.5%淀粉溶液3L,继续滴定至溶液蓝紫色退去呈Cr 的绿色为止。 3、硫酸铜中铜含量的测定 4、 准确称取0.4g左右试样三份置于250mL锥形瓶中,加入5mLLS04,5mlNH,HF2溶液, 10m20%KI(三份不要同时加入),用0.1mol/LNa2Sz03标准溶液滴定至浅黄色,再加入3ml.0.5% 淀粉溶液,继续滴定至浅蓝色,然后加入I0 mLKSCN溶液,摇匀后溶液蓝色转深,继续慢慢滴 定至蓝色恰好消失即为终点。 五、思考题 1、KCr2O,与K1反应为什么要在暗处放置5min?放置时间过长或过短有什么不好? 2、为什么必须滴定至溶液呈淡黄色才能加入淀粉指示剂?开始滴定就加入有何不好? 3、为什么开始滴定的速度要适当快些,而不要剧烈摇动? 4、碘量法测铜含量往事也中加入KI为什么过量?KI在反应中起什么作用? 5、滴定到近终点时加入KSCN溶液的作用是什么?若加入KSCN溶液过早有什么不好? 6、测铜时为什么要控制溶液的酸度?溶液的酸度过低或过高有什么害处? .分光光度法测定CuS0,·5H20中铁的含量 实验目的: 1初步学会722型分光光度计的使用 2学会用工作曲线法进行试样中铁杂质含量测定的方法: 3进一步练习容量瓶和移液管的正确使用方法, 4测定CuS04·5H,0中杂质的含量。 二实验原理: 在稀酸性溶液中,Fe3+与CNS生成红色配合物溶液: Fe++nCNS=Fe(CNS)nn(血红色)
0.1gNa2CO3,搅匀,存于棕色有塞瓶中,放置 8—14 天后,标定其浓度。 2、Na2S2O3 标准溶液的标定 准确称取已烘干的 K2Cr2O7 固体 g 与 250mL 碘量瓶中,用约 20mL 水溶解, 加入 20%KI 溶液 10mL,6mol/LH2SO4 5mL,混匀后,盖好磨口玻塞并向瓶塞周围吹入少量 去离子水以密封,放于暗处 5min,然后用 50mL 水稀释,用 0.1mol/L Na2S2O3 标准溶液滴定, 当溶液由棕色转变为黄绿色时,加入 0.5%淀粉溶液 3mL,继续滴定至溶液蓝紫色退去呈 Cr3+ 的绿色为止。 3、硫酸铜中铜含量的测定 4、 准确称取 0.4g 左右试样三份置于 250mL 锥形瓶中,加入 5mLH2SO4,5mLNH4HF2 溶液, 10mL20%KI(三份不要同时加入),用 0.1mol/L Na2S2O3标准溶液滴定至浅黄色,再加入 3mL0.5% 淀粉溶液,继续滴定至浅蓝色,然后加入 10mLKSCN 溶液,摇匀后溶液蓝色转深,继续慢慢滴 定至蓝色恰好消失即为终点。 五、思考题 1、K2Cr2O7 与 KI 反应为什么要在暗处放置 5min?放置时间过长或过短有什么不好? 2、为什么必须滴定至溶液呈淡黄色才能加入淀粉指示剂?开始滴定就加入有何不好? 3、为什么开始滴定的速度要适当快些,而不要剧烈摇动? 4、碘量法测铜含量往事也中加入 KI 为什么过量?KI 在反应中起什么作用? 5、滴定到近终点时加入 KSCN 溶液的作用是什么?若加入 KSCN 溶液过早有什么不好? 6、测铜时为什么要控制溶液的酸度?溶液的酸度过低或过高有什么害处? III. 分光光度法测定 CuSO4·5H2O 中铁的含量 一 .实验目的: 1 初步学会 722 型分光光度计的使用 2 学会用工作曲线法进行试样中铁杂质含量测定的方法; 3 进一步练习容量瓶和移液管的正确使用方法; 4 测定 CuSO4·5H2O 中杂质的含量。 二. 实验原理: 在稀酸性溶液中, Fe3+与 CNS- 生成红色配合物溶液: Fe3+ + nCNS - == [Fe(CNS)n 3-n] (血红色)

Fe越多,红色愈深 当一束波长一定的单色光通过有色溶液时,被吸收的分光和溶液的浓度,溶液的厚度及入射 光的强度等因素有关。 设c为溶液的浓度:b为溶液的厚度;l为入射光的强度;I为透过溶液后光的强度, 根据实验证明:有色溶液对光的吸收程度与溶液中有色物质的浓度和液层厚度的乘积成对 比这就是朗伯比尔定律,其数学表达式为: lglo/=εbc(I) 式中g(表示光线通过溶液时被吸收的程度,称为吸光度”,也叫”光密度”,或”消光度”,€ 是一个常量,称为吸光系数如将1g用A表示,则(1)式可以写成 A=Ebc (2) 选定单一波长 入射光 本实验 一波长试守吸光度A 稳定光源 A=480nm 读数 光度1 经光电转 含种被长 稳压器 比色器 检流计 单色器 图1分光光度法测定试样过程示意图 因此,当b一定时,吸光度A和溶液浓度c成直线关系。 根据这种关系,用分光光度计来定量测定CuSO,·5H,0中杂质Fe3的量 分光光度计是一种用于测量试样(有色物质)对单一波长入射光的吸收度的仪器,上图为本 实验用分光光度计测定试样的过程示意图(见图1) 从稳定光源产生含有不同波长λ的混合光,它具有稳定的光强度,经过单色器选定一种单色 光,其强度为6的入射光照射到盛有试样的比色皿,比色皿的厚度为b(即光程),试样对光产 生吸收,透射出的光强度为I①<),透过的光经光电转换后,在检流计上指示出光的吸收度。 测定试样中某成份含量的方法: 配制系列标准溶液,其浓度分别为:C1:C2:C3:C4Cs:C6 则测得的相应的系列吸光度为:A1,A2A;A4A5;A6, 以溶液浓度c为横坐标,吸光度A为纵坐标,绘制工作曲线(图2所示) 若测得试样的吸光度为A,就可通过工作曲线在横坐标上找到对应的©值(即待测样品中的浓 度c). 般配制的标准溶液1毫升中含1mg或0.1mg的待测物质,因而浓度c可用标准溶液的体
Fe3+越多,红色愈深. 当一束波长一定的单色光通过有色溶液时,被吸收的分光和溶液的浓度,溶液的厚度及入射 光的强度等因素有关。 设 c 为溶液的浓度; b 为溶液的厚度; I0 为入射光的强度; I 为透过溶液后光的强度。 根据实验证明:有色溶液对光的吸收程度与溶液中有色物质的浓度和液层厚度的乘积成对 比.这就是朗伯-比尔定律,其数学表达式为: lg(I0/I) = ε·b·c (1) 式中:lg(I0/I)表示光线通过溶液时被吸收的程度,称为”吸光度”,也叫”光密度”,或”消光度”, ε 是一个常量,称为吸光系数.如将 lg(I0/I)用 A 表示,则(1)式可以写成 A = ε·b·c (2) 图 1 分光光度法测定试样过程示意图 因此,当 b 一定时, 吸光度 A 和溶液浓度 c 成直线关系。 根据这种关系, 用分光光度计来定量测定 CuSO4·5H2O 中杂质 Fe3+的量。 分光光度计是一种用于测量试样(有色物质)对单一波长入射光的吸收度的仪器,上图为本 实验用分光光度计测定试样的过程示意图(见图 1) 从稳定光源产生含有不同波长λ的混合光,它具有稳定的光强度,经过单色器选定一种单色 光,其强度为 I0 的入射光照射到盛有试样的比色皿, 比色皿的厚度为 b (即光程), 试样对光产 生吸收, 透射出的光强度为 I (I<I0), 透过的光经光电转换后,在检流计上指示出光的吸收度。 测定试样中某成份含量的方法: 配制系列标准溶液,其浓度分别为: C1;C2;C3;C4;C5;C6; 则测得的相应的系列吸光度为: A1;A2;A3;A4;A5;A6; 以溶液浓度 c 为横坐标, 吸光度 A 为纵坐标, 绘制工作曲线(图 2 所示) 若测得试样的吸光度为 Ax, 就可通过工作曲线在横坐标上找到对应的 c 值(即待测样品中的浓 度 cx). 一般配制的标准溶液 1 毫升中含 1mg 或 0.1mg 的待测物质, 因而浓度 c 可用标准溶液的体 比色器 含各种波长 入射光 光强度 I0 经光电转换 单一波长 透过光强度 I 稳定光源 吸光度 A 读数 稳压器 单色器 检流计 试 样 选定单一波长 本实验 λ= 480nm

积毫升数来代表 D 0.8g 0.60日 0.40y 0.20- 0 C1 c2 Cx C3 C4 c5 图2工作曲线 三、仪器和药品: 1、仪器:722型分光光度计,台秤,移液管,吸量管,容量瓶(100m)七个,漏斗,烧杯,滴管两支, 玻棒,滤纸。 2、2、试剂:2mol/L和1:1硝酸,20%KSCN:CuS04·5H2O(学生实验产品2mol/L和6mol/L 氨水,2mol/L硫酸,3%H,02 铁标准溶液: 称取0.8634克NH,Fe(SOh,置于烧杯中加1:1HNO320ml,加少许去离子水,将溶液转移到 1000ml容量瓶中,用去离子水稀释到刻度每毫升此溶液含铁0.1毫克。 四、实验步骤 1铁标准系列溶液的配制: 取100ml容量瓶7个,洗净并编号. 在1严容量瓶中,用吸量管移入2.00ml1:1HNO3,5.00ml20%KCNS,然后用滴管将容量瓶上 口内侧冲洗一下(注意不要流出此容量瓶中的铁标准溶液为0.00ml,用去离子水稀释至刻度, 充分摇匀,放置十分钟,即可使用。 容量瓶号 19 2 3 4“ 5 64 2.00ml 2.00m 2.00ml 2.00ml 2.00ml 2.00ml 20%KCNS 5.00ml 5.00m 5.00ml 5.00ml 5.00ml 5.00ml 铁标准溶液 0.00ml 0.50ml 1.00ml 1.50ml 2.00ml 2.50ml 按同样方法,在26容量瓶内加入1:1NO3和20%KSCN,并按上表加入铁标准溶液
积毫升数来代表。 D 0.80 0.60 0.40 Ax 0.20 0 c1 c2 cx c3 c4 c5 图 2 工作曲线 三、仪器和药品: 1、仪器:722 型分光光度计,台秤, 移液管, 吸量管,容量瓶(100ml)七个,漏斗,烧杯, 滴管两支, 玻棒, 滤纸。 2、2、试剂: 2mol/L 和 1:1 硝酸, 20%KSCN;CuSO4·5H2O(学生实验产品); 2mol/L 和 6mol/L 氨水, 2mol/L 硫酸, 3%H2O2。 铁标准溶液: 称取 0.8634 克 NH4Fe(SO4)2, 置于烧杯中加 1:1HNO3 20ml, 加少许去离子水,将溶液转移到 1000ml 容量瓶中,用去离子水稀释到刻度,每毫升此溶液含铁 0.1 毫克。 四、 实验步骤: 1 .铁标准系列溶液的配制: 取 100ml 容量瓶 7 个,洗净并编号. 在 1# 容量瓶中,用吸量管移入 2.00ml 1:1HNO3,; 5.00ml 20%KCNS, 然后用滴管将容量瓶上 口内侧冲洗一下(注意不要流出),此容量瓶中的铁标准溶液为 0.00ml, 用去离子水稀释至刻度, 充分摇匀, 放置十分钟, 即可使用。 容量瓶号 1# 2# 3# 4# 5# 6# 1:1HNO3 2.00ml 2.00ml 2.00ml 2.00ml 2.00ml 2.00ml 20%KCNS 5.00ml 5.00ml 5.00ml 5.00ml 5.00ml 5.00ml 铁标准溶液 0.00ml 0.50ml 1.00ml 1.50ml 2.00ml 2.50ml 按同样方法,在 2# -6# 容量瓶内加入 1:1HNO3 和 20%KSCN, 并按上表加入铁标准溶液
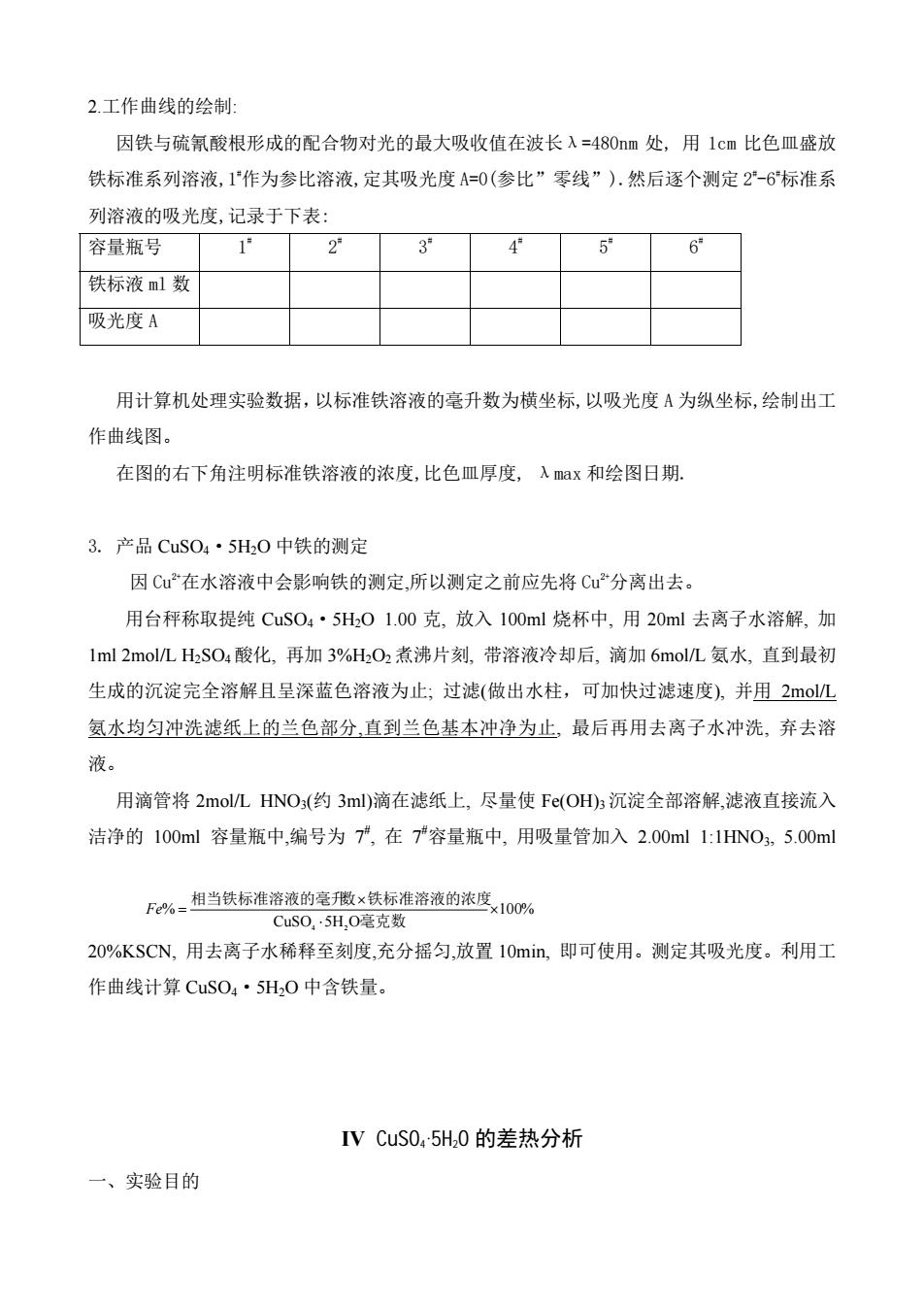
2.工作曲线的绘制 因铁与硫氰酸根形成的配合物对光的最大吸收值在波长入=480m处,用1cm比色皿盛放 铁标准系列溶液,1广作为参比溶液,定其吸光度A=0(参比”零线”)).然后逐个测定2-6标准系 列溶液的吸光度,记录于下表 容量瓶号 1" 2° 3 4 5 6 铁标液ml数 吸光度A 用计算机处理实验数据,以标准铁溶液的毫升数为横坐标,以吸光度A为纵坐标,绘制出工 作曲线图。 在图的右下角注明标准铁溶液的浓度,比色皿厚度,入max和绘图日期 3.产品CuS04·5H0中铁的测定 因Cu在水溶液中会影响铁的测定,所以测定之前应先将C分离出去。 用台秤称取提纯CuS04·5H,01.00克,放入100ml烧杯中,用20ml去离子水溶解,加 1ml2mol/LHS04酸化,再加3%H02煮沸片刻,带溶液冷却后,滴加6mol/L氨水,直到最初 生成的沉淀完全溶解且呈深蓝色溶液为止;过滤(做出水柱,可加快过滤速度),并用2m©L 氨水均匀冲洗滤纸上的兰色部分,直到兰色基本冲净为止,最后再用去离子水冲洗,弃去溶 液。 用滴管将2mol/LHNO3(约3ml)滴在滤纸上,尽量使Fe(OH)3沉淀全部溶解,滤液直接流入 洁净的100ml容量瓶中,编号为7,在7容量瓶中,用吸量管加入2.00ml1:1HNO.5.00ml F%相当铁标准溶液的毫散x铁标准溶液的浓度×10O% CuS0,·5H,0毫克数 20%KSCN,用去离子水稀释至刻度,充分摇匀,放置10min,即可使用。测定其吸光度。利用工 作曲线计算CuSO4·5H,0中含铁量。 IV CuS0.5H0的差热分析 一、实验目的
2.工作曲线的绘制: 因铁与硫氰酸根形成的配合物对光的最大吸收值在波长λ=480nm 处, 用 1cm 比色皿盛放 铁标准系列溶液,1# 作为参比溶液,定其吸光度 A=0(参比”零线”).然后逐个测定 2# -6# 标准系 列溶液的吸光度,记录于下表: 容量瓶号 1# 2# 3# 4# 5# 6# 铁标液 ml 数 吸光度 A 用计算机处理实验数据,以标准铁溶液的毫升数为横坐标,以吸光度 A 为纵坐标,绘制出工 作曲线图。 在图的右下角注明标准铁溶液的浓度,比色皿厚度, λmax 和绘图日期. 3. 产品 CuSO4·5H2O 中铁的测定 因 Cu2+在水溶液中会影响铁的测定,所以测定之前应先将 Cu2+分离出去。 用台秤称取提纯 CuSO4·5H2O 1.00 克, 放入 100ml 烧杯中, 用 20ml 去离子水溶解, 加 1ml 2mol/L H2SO4 酸化, 再加 3%H2O2 煮沸片刻, 带溶液冷却后, 滴加 6mol/L 氨水, 直到最初 生成的沉淀完全溶解且呈深蓝色溶液为止; 过滤(做出水柱,可加快过滤速度), 并用 2mol/L 氨水均匀冲洗滤纸上的兰色部分,直到兰色基本冲净为止, 最后再用去离子水冲洗, 弃去溶 液。 用滴管将 2mol/L HNO3(约 3ml)滴在滤纸上, 尽量使 Fe(OH)3 沉淀全部溶解,滤液直接流入 洁净的 100ml 容量瓶中,编号为 7# , 在 7# 容量瓶中, 用吸量管加入 2.00ml 1:1HNO3, 5.00ml 20%KSCN, 用去离子水稀释至刻度,充分摇匀,放置 10min, 即可使用。测定其吸光度。利用工 作曲线计算 CuSO4·5H2O 中含铁量。 IV CuSO4·5H2O 的差热分析 一、实验目的 100% CuSO 5H O % 4 2 × ⋅ × = 毫克数 相当铁标准溶液的毫升数 铁标准溶液的浓度 Fe

1、用差热分析仪对CuS04·5H20进行差热分析: 2、掌握差热分析原理,学会对差热图谱进行定性、定量处理的基本方法: 3、了解差热分析仪的构造,学会操作技术。 二、实验原理 用差热分析仪对CuSO4·5H0进行差热分析,研究CuSO4·5H0受热脱水的历程。 许多物质在加热或冷却过程中会发生相变化学反应、吸附或脱附、晶型转变等变化,这 些变化都会伴随有热效应,其表现为该物质与环境之间有温度差。选择一种热稳定性良好的 物质作参比物(本实验为AlO),将其与被测物一起置于可按设定速率升温的电炉中,分别 记录参比物的温度以及被测物与参比物间的温度差。温度与温度差对时间作图(两图象合并 在一个坐标系中)或温度差对温度作图,称为差热谱图。概括地说,差热分析就是在程序控 制温度条件下(本实验为线性升温)测定被测物与参比物之间的温度差与温度关系的一种技 术。从差热谱图可以获得有关热力学和热动力学方面的诸多信息。图1是理想的差热谱图。 如果参比物和被测试样的热容大致相同,当试样在某段温度无热效应,则二者的温度基本相 同,此时得到的是一条平滑的直线,如图中b、de、gh等段,称为基线。一旦试样发生变化, 产生热效应,在差热曲线上就会有峰出现如bcd、eg即是。热效应越大,峰的面积也越大。 我们规定(仪器己调整好)峰顶向上为放热峰,试样温度高于参比物:峰顶向下为吸热峰, 试样温度低于参比物。 一个热效应所对应的峰位置和方向反映了物质变化的本质和规律,但其宽度、高度、对 称性、起始温度、峰顶温度等也取决于样品变化过程各种动力学因素,如变温速率、样品量、 粒度大小以及时间坐标(走纸速率)、温度量程与差热量程等。实验表明,峰的外延起始温度 te(见图4)比峰顶温度tp所受外界的影响要小得多,因此国际上决定以te作为反应的起始 温度并可用以表征某一特定物质的本性,te的确定方法亦如图4。 由各图可见实际差热图谱与理想的(图1)并不完全一样。这是由于样品及其中间产物与 参比物的物理性质不尽相同,再加上样品在测定过程中可能发生的体积改变、热容改变等, 往往使基线及峰的形状发生漂移和变化,有时峰前后的基线并不在一直线上。在这种情况下 确定te更需细心。 CuS04·5HO受热脱水过程可分三个步骤四个热效应,其差热图谱见图3。 t (1)CuS04·5H20 ◆CuS04·3H20+2H20(液) t2 (2)H0(液) H20(气)
1、用差热分析仪对 CuSO4·5H2O 进行差热分析; 2、掌握差热分析原理,学会对差热图谱进行定性、定量处理的基本方法; 3、了解差热分析仪的构造,学会操作技术。 二、 实验原理 用差热分析仪对 CuSO4·5H2O 进行差热分析,研究 CuSO4·5H2O 受热脱水的历程。 许多物质在加热或冷却过程中会发生相变化学反应、吸附或脱附、晶型转变等变化,这 些变化都会伴随有热效应,其表现为该物质与环境之间有温度差。选择一种热稳定性良好的 物质作参比物(本实验为 Al2O3),将其与被测物一起置于可按设定速率升温的电炉中,分别 记录参比物的温度以及被测物与参比物间的温度差。温度与温度差对时间作图(两图象合并 在一个坐标系中)或温度差对温度作图,称为差热谱图。概括地说,差热分析就是在程序控 制温度条件下(本实验为线性升温)测定被测物与参比物之间的温度差与温度关系的一种技 术。从差热谱图可以获得有关热力学和热动力学方面的诸多信息。图 1 是理想的差热谱图。 如果参比物和被测试样的热容大致相同,当试样在某段温度无热效应,则二者的温度基本相 同,此时得到的是一条平滑的直线,如图中 ab、de、gh 等段,称为基线。一旦试样发生变化, 产生热效应,在差热曲线上就会有峰出现如 bcd、efg 即是。热效应越大,峰的面积也越大。 我们规定(仪器已调整好)峰顶向上为放热峰,试样温度高于参比物;峰顶向下为吸热峰, 试样温度低于参比物。 一个热效应所对应的峰位置和方向反映了物质变化的本质和规律,但其宽度、高度、对 称性、起始温度、峰顶温度等也取决于样品变化过程各种动力学因素,如变温速率、样品量、 粒度大小以及时间坐标(走纸速率)、温度量程与差热量程等。实验表明,峰的外延起始温度 te(见图 4)比峰顶温度 tp 所受外界的影响要小得多,因此国际上决定以 te 作为反应的起始 温度并可用以表征某一特定物质的本性,te 的确定方法亦如图 4。 由各图可见实际差热图谱与理想的(图 1)并不完全一样。这是由于样品及其中间产物与 参比物的物理性质不尽相同,再加上样品在测定过程中可能发生的体积改变、热容改变等, 往往使基线及峰的形状发生漂移和变化,有时峰前后的基线并不在一直线上。在这种情况下 确定 te 更需细心。 CuSO4·5H2O 受热脱水过程可分三个步骤四个热效应,其差热图谱见图 3。 t1 (1)CuSO4·5H2O CuSO4·3H2O + 2H2O(液) t2 (2)H2O(液) H2O(气)

t3 (3)CuSO4·3H2O →CuS04·H20+2H0(气) (4)CuSO4·H2O ◆CuSO4+H0(气) 在其他条件相同的情况下,不同升温速率对差热曲线是有影响的。通常,低升温速率有 利于改善分辨率。本实验选择升温速率为10℃mi,第2、3两个热效应所出现的峰可能发生 重叠。 本实验的任务是做出CuSO4·5H0脱水差热图并从图中求取t、t2、t、t4 三、仪器与试剂 PCR-1型差热分析仪;3066型水平台式划线记录仪,o-Al2O3(分析纯):KNO3(分析纯): 四、实验步骤 (1)将提纯后的CuSO4·5H2O磨细并装入样品坩埚中。CuSO4·5H20粉末以100至300 目较好,坩埚为陶瓷坩埚,用样品匙将样品装入坩埚,不超过坩埚容积的三分之二,在 清洁的台面上轻墩数次使样品松紧适度。 将样品坩埚和参比物坩埚(实验室已准备)放到各自的热偶板上,坩埚底面与热偶板面 保持平稳接触良好,降下炉子,开始实验。 (2)实验条件:升温速率10℃/分:差热±100uw:温度量程0.25mvcm(温度数值是以室 温为基准量出长度,从温度量程求得mv数,查热电偶t一mv表得温度值):差热量程 0.5mv/cm;走纸速度60cm/h. (3)关于笔距差△r 在一幅差热图上同时画出温度线t与差热线△t,为不使画笔(红、蓝二色)不相干扰, 安排二笔错开一定距离。表现在差热图上,t线与△t线的时间坐标就有一个间隔△τ,t 线在前,△t线在后。△t线上某点相应的温度,在t线上加一个时间间隔△τ(一般是几 个m,在挂图上未画完全,请老师们见谅)。 (4)具体操作和注意事项见卡片。 五、思考题 1、影响差热分析结果的主要因素是什么? 2、测温点在样品内或在其他参考点上,所绘得的升温曲线是否相同?何故?
t3 (3)CuSO4·3H2O CuSO4·H2O + 2H2O(气) t4 (4)CuSO4·H2O CuSO4 + H2O(气) 在其他条件相同的情况下,不同升温速率对差热曲线是有影响的。通常,低升温速率有 利于改善分辨率。本实验选择升温速率为 10℃/min,第 2、3 两个热效应所出现的峰可能发生 重叠。 本实验的任务是做出 CuSO4·5H2O 脱水差热图并从图中求取 t1、t2、t3、t4。 三、仪器与试剂 PCR-1 型差热分析仪;3066 型水平台式划线记录仪,α-Al2O3(分析纯);KNO3(分析纯); 四、实验步骤 (1) 将提纯后的 CuSO4·5H2O 磨细并装入样品坩埚中。CuSO4·5H2O 粉末以 100 至 300 目较好,坩埚为陶瓷坩埚,用样品匙将样品装入坩埚,不超过坩埚容积的三分之二,在 清洁的台面上轻墩数次使样品松紧适度。 将样品坩埚和参比物坩埚(实验室已准备)放到各自的热偶板上,坩埚底面与热偶板面 保持平稳接触良好,降下炉子,开始实验。 (2) 实验条件:升温速率 10℃/分;差热±100µv;温度量程 0.25mv/cm(温度数值是以室 温为基准量出长度,从温度量程求得 mv 数,查热电偶 t—mv 表得温度值);差热量程 0.5mv/cm;走纸速度 60cm/h。 (3) 关于笔距差∆τ 在一幅差热图上同时画出温度线 t 与差热线∆t,为不使画笔(红、蓝二色)不相干扰, 安排二笔错开一定距离。表现在差热图上,t 线与∆t 线的时间坐标就有一个间隔∆τ,t 线在前,∆t 线在后。∆t 线上某点相应的温度,在 t 线上加一个时间间隔∆τ(一般是几 个 mm,在挂图上未画完全,请老师们见谅)。 (4)具体操作和注意事项见卡片。 五、思考题 1、影响差热分析结果的主要因素是什么? 2、测温点在样品内或在其他参考点上,所绘得的升温曲线是否相同?何故?