
第七章氧化还原反应(8h) 7.1氧化还原反应的基本概念 ○7.2原电池和电极电势 ○7.3电极电势的应用 ○7.4元素标准电极电势图及其应用 ○7.5氧化还原滴定法 ○本章作业
第七章 氧化还原反应(8h) 7.1 氧化还原反应的基本概念 7.2 原电池和电极电势 7.3 电极电势的应用 7.4 元素标准电极电势图及其应用 7.5 氧化还原滴定法 本章作业

7.1氧化还原反应的基本概念 7.1.1氧化值(数) Cu2++Zn→Zn2++Cu 电子得失 H2(g)+C12(g)=2HC1(g) 电子偏移 氧化数:是指某元素的一个原子的电荷数,该电荷数是 假定把每一化学键中的电子指定给电负性更大的原子而 求得的
Cu2+ + Zn → Zn2+ + Cu 电子得失 氧化数:是指某元素的一个原子的电荷数,该电荷数是 假定把每一化学键中的电子指定给电负性更大的原子而 求得的 7.1.1 氧化值(数) H (g) Cl (g) 2HCl(g) 2 + 2 = 电子偏移 7.1 氧化还原反应的基本概念

7.1氧化还原反应的基本概念 7.1.1氧化值(数) 确定氧化数的规则: ()离子型化合物中,元素的氧化数等于该离子所带的电荷数 (2)共价型化合物中,共用电子对偏向于电负性大的原子,两原子的形式电荷数即为它 们的氧化数, 3)单质中,元素的氧化数为零, (④)中性分之中,各元素原子的氧化数的代数和为零,复杂离子的电荷等于各元素氧化 数的代数和。 (⑤)氢的氧化数一般为+1,在金属氢化物中为-1,如NaH。 (6)氧的氧化数一般为-2,在过氧化物中为-1,如H,O2·Na,02, 在超氧化物中为-0.5,如K02,在氧的氟化物中为+1或+2,如02£,,0E
确定氧化数的规则: ⑴ 离子型化合物中,元素的氧化数等于该离子所带的电荷数 ⑵ 共价型化合物中,共用电子对偏向于电负性大的原子, 两原子的形式电荷数即为它 们的氧化数; ⑶单质中,元素的氧化数为零; ⑷中性分之中,各元素原子的氧化数的代数和为零,复杂离子的电荷等于各元素氧化 数的代数和。 7.1 氧化还原反应的基本概念 7.1.1 氧化值(数) ⑹ 氧的氧化数一般为-2,在过氧化物中为-1,如 ⑸ 氢的氧化数一般为+1,在金属氢化物中为-1,如 。1 Na H − K O 2 , −0.5 H O Na O2 , 1 ` 2 2 1 2 − − 在超氧化物中为-0.5,如 在氧的氟化物中为+1或+2,如 O F ,O F2 。 2 2 2 +1 +
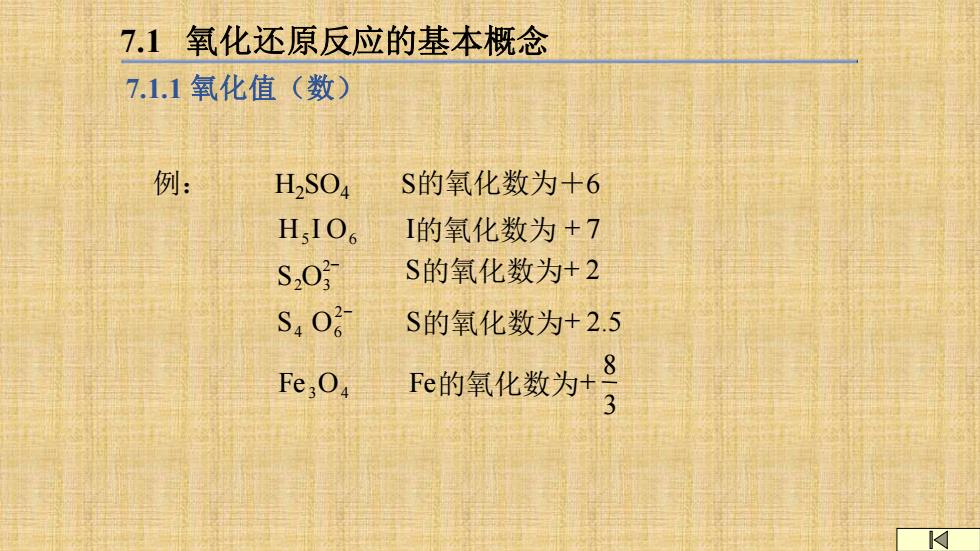
7.1氧化还原反应的基本概念 7.1.1氧化值(数) 例: H2SOa S的氧化数为+6 HsIO6 I的氧化数为+7 S20 S的氧化数为+2 S40 S的氧化数为+2.5 8 Fe,04 Fe的氧化数为+ -3
例: H2SO4 S的氧化数为+6 3 8 Fe的氧化数为+ S的氧化数为+ 2.5 S的氧化数为+ 2 I的氧化数为 + 7 Fe O S O S O H I O 3 4 2 4 6 2 2 3 5 6 − − 7.1 氧化还原反应的基本概念 7.1.1 氧化值(数)

7.1氧化还原反应的基本概念 7.1.2离子一电子法配平氧化还原方程式 配平原则: ()电荷守恒:得失电子数相等。 (2)质量守恒:反应前后各元素原子总数相等。 配平步骤: (1)用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则 写分子式); (2)将反应分解为两个半反应式,并配平两个半反应的原子数及电荷数, (3)根据电荷守恒,以适当系数分别乘以两个半反应式,然后合并、整理, 即得配平的离子方程式;有时根据需要可将其改为分子方程式
7.1.2 离子— 电子法配平氧化还原方程式 配平原则: (1) 电荷守恒:得失电子数相等。 (2) 质量守恒:反应前后各元素原子总数相等。 配平步骤: (1)用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则 写分子式); (2)将反应分解为两个半反应式,并配平两个半反应的原子数及电荷数; (3)根据电荷守恒,以适当系数分别乘以两个半反应式,然后合并、整理, 即得配平的离子方程式;有时根据需要可将其改为分子方程式。 7.1 氧化还原反应的基本概念

71氧化还原反应的基本概念 7.1.2 离子一电子法配平氧化还原方程式 例1:配平反应方程式 KMnO,+K,SO 酸性溶液中MnSO4+K,SO, 解:离子式 MnO,+SO2 酸性溶液中Mn2++SO} 酸性溶液中的两个半反应: ①MnOMn2+ MnO,+8H*+5e-=Mn2*+4H,O ② S0}-→S0 S0+H,0-2e=S0}+2H ①×2+②X5得 2MnO:+5S0}+6H+=2Mn2++5S0}+3H,0 分子方程式:2KMnO,+5K,S0,+3H,S04=2MnS0,+6K,S0,+3H,0
例1:配平反应方程式 4 2 4 酸性溶液中 KMnO4 + K2SO3 ⎯⎯⎯⎯→MnSO + K SO 2 4 2 MnO 8H 5e Mn 4H O − + − + ① + + = + ② ①×2+②×5得 2MnO 5SO 6H 2Mn 5SO 3H2O 2 4 2 2 4 + 3 + = + + − − + + − 解:离子式 2- 4 2- 酸性溶液中 2 3 - MnO4 + SO ⎯⎯ ⎯→Mn + SO + 酸性溶液中的两个半反应: 分子方程式:2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O 2 2 3 2 4 SO H O 2e SO 2H − − − + + − = + 2 4 MnO Mn − + → 2 2 3 4 SO SO − − → 7.1.2 离子— 电子法配平氧化还原方程式 7.1 氧化还原反应的基本概念

7.1氧化还原反应的基本概念 7.1.2离子一电子法配平氧化还原方程式 例2:配平方程式 MnO4+SO?中性质,MnO2+SO 解: 1 MnO;+2H,O+3e=MnO,+40H ②S0}+20H-2e=SO+H20 ①X2+②X3得 2MnO4+3SO}+H,0=2Mn02↓+3S0}+20H 这里的中性实质上是弱碱性,因Na2SO3为弱碱性
例2:配平方程式 ①×2+②×3得 2 2 MnO SO MnO SO 4 3 2 4 − − − + + ⎯⎯⎯⎯→ 中性介质 − − − − 2MnO + 3SO + H O = 2MnO +3SO + 2OH 2 2 2 4 2 4 3 解: - MnO 2H O 3e MnO 4OH 4 2 2 − − ① + + = + ② 这里的中性实质上是弱碱性,因Na2SO3为弱碱性 2- 2- SO 2OH 2e SO H O 3 4 2 − − + − = + 7.1.2 离子— 电子法配平氧化还原方程式 7.1 氧化还原反应的基本概念

7.1氧化还原反应的基本概念 7.1.2离子一电子法配平氧化还原方程式 例3:配平MnO,+SO强碱性介质→MnO?+SO? 解:()MnO:+e-MnO (2)0}+20H-2e=S0}+H20 ①×2+②得 2MnO,+SO2+20H =2MnO+SO+H,O
①×2+②得 2MnO SO 2OH 2MnO SO H2O 2 4 2 4 2 4 + 3 + = + + − − − − − 解: (2) SO 2OH 2e SO H O (1) MnO e MnO 2 2- 4 2- 3 2 4 4 + − = + + = − − − − − 例3:配平 − − − − + ⎯⎯⎯⎯→ + 2 4 2 4 2 强碱性介质 MnO4 SO3 MnO SO 7.1 氧化还原反应的基本概念 7.1.2 离子— 电子法配平氧化还原方程式

7.1氧化还原反应的基本概念 7.1.2离子一电子法配平氧化还原方程式 例4:配平方程式 KMnO,+C.HpO.-HS0.>MnSO,+CO,+K,SO 解: MnO:+C,HO。→Mn2++C02 MnO +8H*+5e Mn2++4H,O ② C.H20。+6H20-24e=6C02+24H ①×24+②×5得 24Mn0:+5CH206+72H-24Mn2++30C02+66H,0 24KMnO4+5C6H1206+36H2S04=24MnSO4+30C02+66H2O+12K2S04
例4:配平方程式 2 2 MnO4 + C6H12O6 → Mn + CO − + ①×24+②×5得 ① ② 4 2 2 4 H SO KMnO4 + C6H12O6 ⎯⎯2 ⎯4→MnSO + CO + K SO 24MnO 5C H O 72H 24Mn 30CO2 66H2O 2 4 + 6 12 6 + = + + − + + − + − + − + + = + + + = + C H O 6H O - 24e 6CO 24H MnO 8H 5e Mn 4H O 6 12 6 2 2 2 2 4 解: 4 6 12 6 2 4 4 2 2 2SO4 24KMnO + 5C H O + 36H SO = 24MnSO + 30CO + 66H O +12K 7.1.2 离子— 电子法配平氧化还原方程式 7.1 氧化还原反应的基本概念

7.1氧化还原反应的基本概念 7.1.2离子一电子法配平氧化还原方程式 小结: 酸性介质:O多加H生成H2O,O少加HO生成H 碱性介质:0多加H20变0什,O少加0H生成H20 中性介质:0多加H,0变OH,O少加H20生成H
酸性介质: O多加H+生成H2O,O少加H2O生成H+ 碱性介质: O多加H2O变OH-, O少加OH-生成H2O 中性介质: O多加H2O变OH-, O少加H2O 生成H+ 小结: 7.1.2 离子— 电子法配平氧化还原方程式 7.1 氧化还原反应的基本概念