
。加热荐 第3章 化学热力学基础(5h) 热力学是研究热与其他形式的能量之间转化规律的一门科学。热力学的基 础是热力学第一定律和热力学第二定律。这两个定律都是人类的大量经验的总 结,有着广泛的、牢固的实验基础。 利用热力学定律、原理和方法研究化学反应以及伴随这些化学反应而发生 的物理变化过程就形成了化学热力学。 化学热力学主要研究和解决的问题有: (1)化学反应及与化学反应密切相关的物理过程中的能量变化; (2)判断化学反应进行的方向和限度
第3章 化学热力学基础(5h) 热力学是研究热与其他形式的能量之间转化规律的一门科学。热力学的基 础是热力学第一定律和热力学第二定律。这两个定律都是人类的大量经验的总 结,有着广泛的、牢固的实验基础。 利用热力学定律、原理和方法研究化学反应以及伴随这些化学反应而发生 的物理变化过程就形成了化学热力学。 化学热力学主要研究和解决的问题有: (1)化学反应及与化学反应密切相关的物理过程中的能量变化; (2)判断化学反应进行的方向和限度

第3章化学热力学基础(5h) ○3.1热力学术语和基本概念 ○3.2热力学第一定律和热化学 ○3.3热力学第二及第三定律 ○3.4吉布斯(Gibbs)自由能 ○本章作业
3.1 热力学术语和基本概念 3.3 热力学第二及第三定律 3.4 吉布斯(Gibbs)自由能 3.2 热力学第一定律和热化学 本章作业 第3章 化学热力学基础(5h)

3.1热力学术语和基本概念 3.1.1系统和环境 3.1.2状态和状态函数 31.3过程,途径和可逆过程 3.1.4热、功 3.1.5热力学能 3.1.6相和相变 3.1.7广度性质和强度性质 3.1.8化学反应计量式和反应进度 ☑
3.1.1 系统和环境 3.1.2 状态和状态函数 3.1.3 过程, 途径和可逆过程 3.1.4 热、功 3.1.5 热力学能 3.1.6 相和相变 3.1.7 广度性质和强度性质 3.1.8 化学反应计量式和反应进度 3.1 热力学术语和基本概念
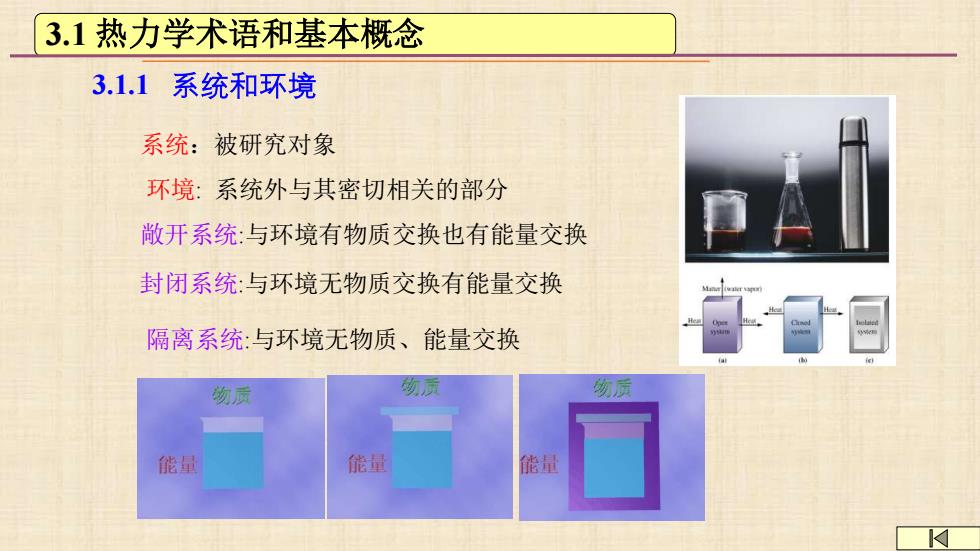
3.1热力学术语和基本概念 3.1.1系统和环境 系统:被研究对象 环境:系统外与其密切相关的部分 敞开系统:与环境有物质交换也有能量交换 封闭系统:与环境无物质交换有能量交换 隔离系统:与环境无物质、能量交换 物员 贡 吻质 能量 能量 能量
3.1.1 系统和环境 系统:被研究对象 环境: 系统外与其密切相关的部分 敞开系统:与环境有物质交换也有能量交换 封闭系统:与环境无物质交换有能量交换 隔离系统:与环境无物质、能量交换 3.1 热力学术语和基本概念

3.1热力学术语和基本概念 3.1.2状态和状态函数 状态:系统宏观性质p,TV,n,U,H,S)的综合表现 状态函数:描述系统性质的物理量,(,T…) 特点:(1)状态一定,状态函数一定 (2)状态变化,状态函数也随之而变,且状态函数的变化值只与始态、终态 有关,而与变化途径无关。 始态 终态 例如: P=100kPa V=2m3 加压 P2=2 00kPa T=298.15K V2=1m3 T2=298.15K 加压 P=1000kPa 减压 =0.2m3 T=298.15K
3.1.2 状态和状态函数 状态:系统宏观性质(p,T,V, n, U,H, S….)的综合表现 状态函数:描述系统性质的物理量,(p,V,T…) 特点: (1)状态一定,状态函数一定 (2) 状态变化,状态函数也随之而变,且状态函数的变化值只与始态、终态 有关,而与变化途径无关。 P1=100kPa V1=2m3 T1=298.15K P2 =200kPa V2 =1m3 T2=298.15K 加压 P=1000kPa V=0.2m3 T=298.15K 始态 终态 加压 减压 例如: 3.1 热力学术语和基本概念

3.1热力学术语和基本概念 3.1.3过程,途径和可逆过程 定温过程:T=T=T △T=0,始态和终态温度同 定压过程:pP2印x △P-0,整个过程不变 定容过程:V=V=Ve △=0,整个过程不变 注意:定压、定容与定温不同 途径:状态变化所经历的具体步骤或过程 可逆过程:系统从终态到始态时,消除了对环境产生的一切影响;可 逆过程是理想化过程,无限接近热力学平衡态
3.1.3 过程, 途径和可逆过程 定温过程: T1=T2=T △T=0,始态和终态温度同 定压过程: p1=p2=pex △P=0, 整个过程不变 定容过程: V1=V2=Vex △V=0,整个过程不变 注意:定压、定容与定温不同 途径: 状态变化所经历的具体步骤或过程 可逆过程:系统从终态到始态时,消除了对环境产生的一切影响; 可 逆过程是理想化过程,无限接近热力学平衡态。 3.1 热力学术语和基本概念

3.1热力学术语和基本概念 3.1.4热和功 1.热(Q) 系统与环境之间由于存在温差而传递的能量一是过程量, 不是状态函数。规定: 系统吸热:Q>0; 系统放热:20 化学上功的种类:体积功一体积变化系统反抗外力所作的功 非体积功一体积功以外的功,如电功等 冈
3.1.4 热和功 系统与环境之间由于存在温差而传递的能量——是过程量, 不是状态函数。规定: 系统吸热: Q >0; 系统放热: Q 0 化学上功的种类:体积功——体积变化系统反抗外力所作的功 非体积功——体积功以外的功,如电功等

3.1热力学术语和基本概念 3.1.4热和功 体积功W)的计算 V2 Pex W=-fFex×l=-Pex'Al=-pex(W2-Vi)=-pex·AV
𝑊 = −𝐹𝑒𝑥 × 𝑙 = −𝑝𝑒𝑥 ⋅ 𝐴 ⋅ 𝑙 = −𝑝𝑒𝑥 𝑉2 − 𝑉1 = −𝑝𝑒𝑥 ⋅ Δ𝑉 pex 𝑙 V2 V1 3.1 热力学术语和基本概念 体积功( W )的计算 3.1.4 热和功

3.1热力学术语和基本概念 3.1.5热力学能 物质之间可以有热和功两种形式的能量传递,这表明 e Translational 物质内部蕴藏着一定的能量。体系中所蕴藏的总能量叫做 热力学能,是体系内部能量的总和。即: Rotational 热力学能():系统内部所有微观粒子的全部能量之和, Vihrational 所以也称内能。 U是状态函数—状态一定,内能具有定值 ntermolecular attractio相s 热力学能变化只与始态、终态有关,而与变 化途径无关。即 U2-U1 AU
物质之间可以有热和功两种形式的能量传递,这表明 物质内部蕴藏着一定的能量。体系中所蕴藏的总能量叫做 热力学能,是体系内部能量的总和。即: 热力学能(U): 系统内部所有微观粒子的全部能量之和, 所以也称内能。 U是状态函数——状态一定,内能具有定值 𝑈2 − 𝑈1 = Δ𝑈 热力学能变化只与始态、终态有关,而与变 化途径无关。即 3.1.5 热力学能 3.1 热力学术语和基本概念

3.1热力学术语和基本概念 3.1.6相和相变 1.相(phase:系统中物理性质和化学性质完全相同的均匀部分 气相:无论含多少种气体 都是一相 液相:均匀的液体为一相 固相:一种固体为一相 单相系统:均相系统 多相系统:非均相系统 界面:相与相之间的交界面 2相变:不同相之间的相互转化,伴随能量变化
1. 相(phase):系统中物理性质和化学性质完全相同的均匀部分 气相:无论含多少种气体 都是一相 液相:均匀的液体为一相 固相:一种固体为一相 单相系统:均相系统 多相系统:非均相系统 界面:相与相之间的交界面 3.1 热力学术语和基本概念 3.1.6 相和相变 2.相变:不同相之间的相互转化,伴随能量变化