
第10章 配位化合物(8h) 10.1配合物的组成与命名 10.2配合物的化学键理论 10.3配位解离平衡 10.4整合物的稳定性 10.5配位化合物的应用 10.6配位滴定 本章作业 本章课外读物
第10章 配位化合物(8h) 10.1 配合物的组成与命名 10.2 配合物的化学键理论 10.3 配位解离平衡 10.4 螯合物的稳定性 10.5 配位化合物的应用 10.6 配位滴定 本章作业 本章课外读物

10.1配位化合物(配合物)的组成 定义:由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(配 体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(中心原子) 按一定的组成和空间构型所形成的化合物 NH是配离子,但一般不把NH,C看作配合物 10.1.1配合物的一般组成 配合物的组成分为两部分: 内界(又称配位个体)和外界 如: KalFe(CN)l [Co(NH3)JCl3 外界内界 内界 外界
10.1 配位化合物(配合物)的组成 10.1.1 配合物的一般组成 配合物的组成分为两部分: 内界(又称配位个体)和外界 如: K4 [Fe(CN)6 ] [Co(NH3 )6 ]Cl3 定义:由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(配 体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(中心原子) 按一定的组成和空间构型所形成的化合物 NH4 +是配离子,但一般不把NH4Cl看作配合物 外界 内界 内界 外界

内界:中心离子(中心形成体)一具有空轨道的离子 (1)一般是过渡金属阳离子,如Fe2+、Co+ (2)少数非过渡金属离子,如:Ca2+、A3+ (3)也可是中性原子,如:Ni(CO)4中的Ni等 (4)少数负氧化态的离子,如:I中的1:H[Co(CO)4]中的Co均为-1价 (⑤)少数高氧化态的非金属元素,如:[SiFP、[PF6、[BF4]中Si、P、B 配位原子一配体中具有孤对电子,直接与中心原子相连的原子,如:N等, 般是IVA、VA、VIA、VIA族电负性较大的元素 配位体(配体)一含有配位原子的分子或离子,如: 单齿配位体一CN和NH等 多齿配位体一HN-CH2-CH2-NH等 两可配位体一SCN(S、N均可)等 π键配位体一没有配位原子,π键电子与中心离子配合 如苯及其衍生物等— 不定域电子
内界:中心离子(中心形成体)——具有空轨道的离子 (1) 一般是过渡金属阳离子,如:Fe2+ 、Co3+ (2) 少数非过渡金属离子,如:Ca2+ 、Al3+ (3) 也可是中性原子,如:Ni(CO)4中的Ni等 (4) 少数负氧化态的离子,如:I3 -中的I; H[Co(CO)4 ]中的Co均为-1价 (5) 少数高氧化态的非金属元素,如:[SiF6 ] 2-、[PF6 ] -、[BF4 ] -中Si、P、B 配位原子——配体中具有孤对电子,直接与中心原子相连的原子,如:N 等, 一般是ⅣA、ⅤA、ⅥA、ⅦA族电负性较大的元素 配位体(配体)——含有配位原子的分子或离子,如: CN-和NH3 等 H2N-CH2 -CH2 -NH2等 SCN-(S、N均可)等 没有配位原子,π键电子与中心离子配合 如苯及其衍生物等———不定域电子 单齿配位体—— 多齿配位体—— 两可配位体—— π键配位体——

配位数一直接与中心原子相连的配位原子个数,不一 定等于配位体的数目 配位数是中心离子的重要特征: 一般中心离子的配位数2、4、6、8等,常见的是 4和6,奇数(1、3、5、7)非常罕见 配位数可以改变,取决于中心原子和配位体的性质 规律:()中心离子的电荷越高,配位数越多。如 [PtCl4]P、[PtCl6]2、[Cu(CN)2J、[Cu(CN)4]P- 一般中心原子电荷:+1 +2 +3 +4 配位数:2 4,(6) (4),6 6,(8) (2)配位体的负电荷增加,配位数减小。原因:配体间斥力大 如:[Zn(NH3)6J2+与[Zn(CN4]2[Co(HO)6]2+与[CoC4]2 N
配位数——直接与中心原子相连的配位原子个数,不一 定等于配位体的数目 配位数是中心离子的重要特征: 一般中心离子的配位数2、4、6、8等,常见的是 4和 6,奇数(1、3、5、7)非常罕见 配位数可以改变,取决于中心原子和配位体的性质 规律:(1) 中心离子的电荷越高,配位数越多。如 [PtCl4 ] 2-、[PtCl6 ] 2- 、[Cu(CN)2 ] -、[Cu(CN)4 ] 2- 一般中心原子电荷:+1 +2 +3 +4 配位数: 2 4,(6) (4),6 6,(8) (2) 配位体的负电荷增加,配位数减小。原因:配体间斥力大 如:[Zn(NH3 )6 ] 2+与[Zn(CN)4 ] 2- [Co(H2O)6 ] 2+与[CoCl4 ] 2-

(3)中心离子半径越大,配位数越大:空间允许 如:[AIF6J3与BF4] 但中心离子半径太大时,配位数会降低:与配体结合力小 (4)配体半径太大时,配位数会减小。如: [AIFJ-与AICI4 (⑤)在形成配合物时,增大配体浓度,或降低反应温度,有利于形成高配 位数配合物 配离子的电荷一配离子的电荷是配位体离子与中心离子电荷的代数和
(3)中心离子半径越大,配位数越大:空间允许 如:[AlF6 ] 3-与[BF4 ] - 但中心离子半径太大时,配位数会降低:与配体结合力小 (4)配体半径太大时,配位数会减小。如: [AlF6 ] 3-与[AlCl4 ] - (5)在形成配合物时,增大配体浓度,或降低反应温度,有利于形成高配 位数配合物 配离子的电荷——配离子的电荷是配位体离子与中心离子电荷的代数和
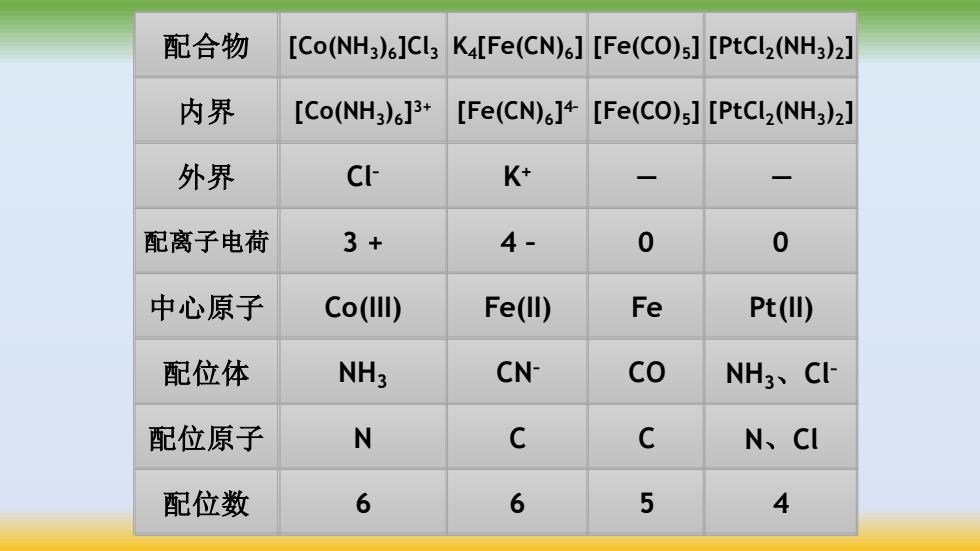
配合物 [Co(NH3)6]Cl3 K[Fe(CN)6][Fe(CO)s][PtCl2(NH3)2] 内界 [Co(NH3)6]3+ [Fe(CN)]+[Fe(CO)s][PtCl2(NH3)2] 外界 C K+ 配离子电荷 3+ 4- 0 0 中心原子 Co(III) Fe(lI) Fe Pt(II) 配位体 NH3 CN- CO NH3、C 配位原子 N C C N、CI 配位数 6 6 5 4
配位数 6 6 5 4 配位原子 N C C N、Cl NH3、Cl NH CN– CO – 配位体 3 中心原子 Co(III) Fe(II) Fe Pt(II) 配离子电荷 3 + 4 – 0 0 外界 Cl– K+ — — [PtCl2 (NH3 )2 [Fe(CO) ] 5 [Fe(CN) ] 6 ] 4– [Co(NH3 )6 ] 内界 3+ [PtCl2 (NH3 )2 [Fe(CO) ] 5 K ] 4 [Fe(CN)6 [Co(NH ] 3 )6 ]Cl 配合物 3
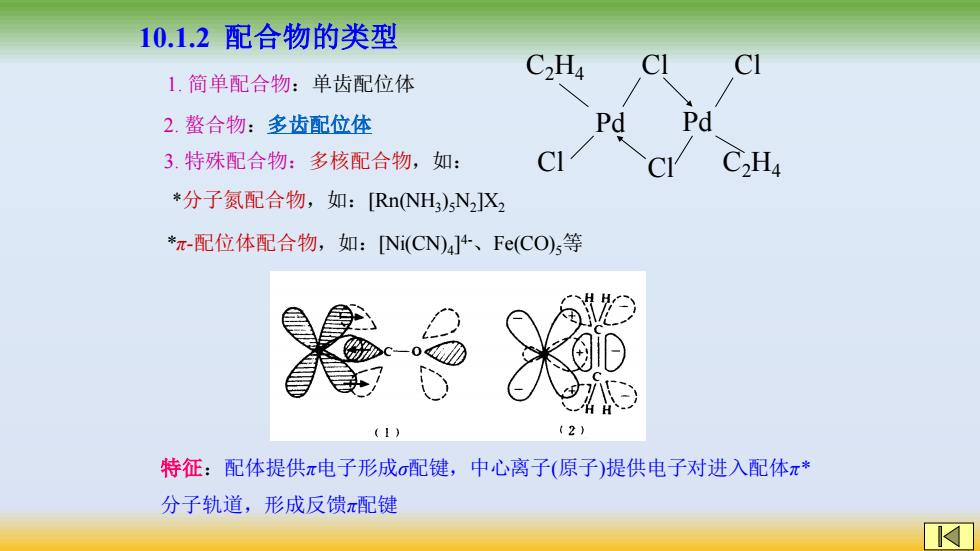
10.1.2配合物的类型 C2H4 CI 1.简单配合物:单齿配位体 2.螯合物:多齿配位体 Pd Pd 3.特殊配合物:多核配合物,如: C2Ha *分子氮配合物,如:[RnNH)sN2JX2 *π-配位体配合物,如:[Ni(CN)4]4、Fe(CO)s等 卷米 特征:配体提供π电子形成σ配键,中心离子(原子)提供电子对进入配体π* 分子轨道,形成反馈π配键
*分子氮配合物,如:[Rn(NH3 )5N2 ]X2 *π-配位体配合物,如:[Ni(CN)4 ] 4-、Fe(CO)5等 特征:配体提供π电子形成σ配键,中心离子(原子)提供电子对进入配体π* 分子轨道,形成反馈π配键 10.1.2 配合物的类型 1. 简单配合物:单齿配位体 2. 螯合物:多齿配位体 3. 特殊配合物:多核配合物,如: C2H4 Cl Pd Cl Cl Pd Cl C2H4

10.1.3配位化合物的命名 主要是内界的命名,举例说明 K2[SiF6] 六氟合硅(V)酸钾 K[PtCls(NH3)] 五氯一氨合铂(V)酸钾 Na[Co(CO)4] 四羰基合钴(-I)酸钠 [Co(ONO)NH)5]SO4硫酸一亚硝酸根·五氨合钴() [Co (NO)(NH)] 三硝基·三氨合钴(山) [Pt(NO2)(NH3)(NH2OH)(Py)]CI 氯化一硝基一氨一羟基一吡啶合铂(Ⅱ) 内界:配位体数一配位体名称(多个配体从左至右依次命名,配体间加“”)一 合一中心离子名称(中心离子氧化数罗马数字) 内界与外界之间:某酸某、某化某 例:写出氯化二氯三氨一水合钴Ⅲ的化学式 [Co(CI2)(NH)(H,O)]CI [CoCI2 (NH)(H2O)JCI
10.1.3 配位化合物的命名 主要是内界的命名,举例说明 K2 [SiF6 ] 六氟合硅(Ⅳ)酸钾 K[PtCl5 (NH3 )] 五氯·一氨合铂(Ⅳ)酸钾 Na[Co(CO)4 ] 四羰基合钴(-Ⅰ)酸钠 [Co(ONO)(NH3 )5 ]SO4 硫酸一亚硝酸根·五氨合钴(Ⅲ) [Co (NO2 )3 (NH3 )3 ] 三硝基·三氨合钴(Ⅲ) [Pt(NO2 )(NH3 )(NH2OH)(Py)]Cl 氯化一硝基·一氨·一羟基·一吡啶合铂(Ⅱ) 内界: 配位体数—配位体名称(多个配体从左至右依次命名,配体间加“·”)— 合—中心离子名称(中心离子氧化数罗马数字) 内界与外界之间:某酸某、某化某 例:写出 氯化二氯·三氨·一水合钴(Ⅲ)的化学式 [Co(Cl2 )(NH3 )3 (H2O)]Cl 或 [CoCl2 (NH3 )3 (H2O)]Cl
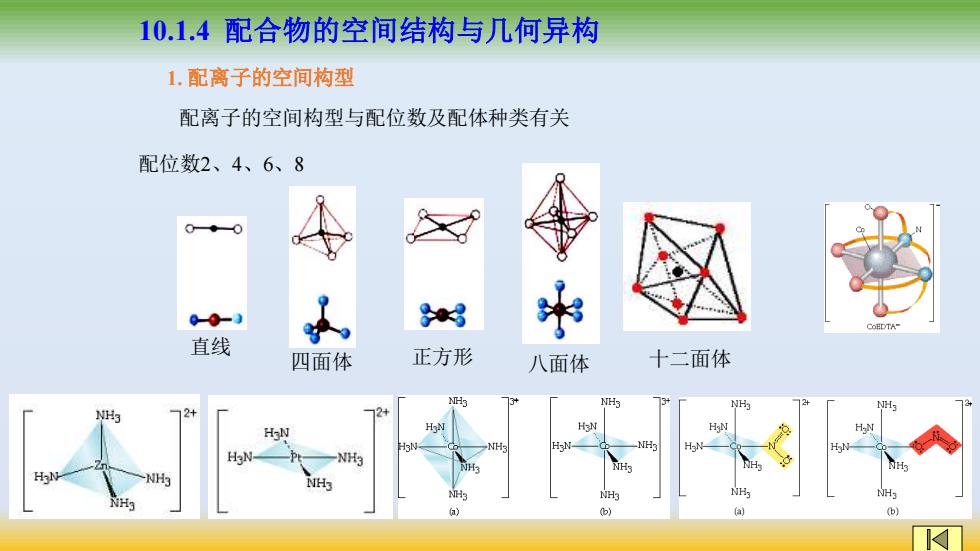
10.1.4配合物的空间结构与几何异构 1.配离子的空间构型 配离子的空间构型与配位数及配体种类有关 配位数2、4、6、8 00-0 3 CoHDTA- 直线 四面体 正方形 八面体 十二面体 NHs 13 H NH3 12+ 72+ HoN HN H-N H3N NH- H H3N- -NH3 NHs -NH3 NHg NH3 NH (b) a
10.1.4 配合物的空间结构与几何异构 1. 配离子的空间构型 配离子的空间构型与配位数及配体种类有关 配位数2、4、6、8 直线 四面体 正方形 八面体 十二面体
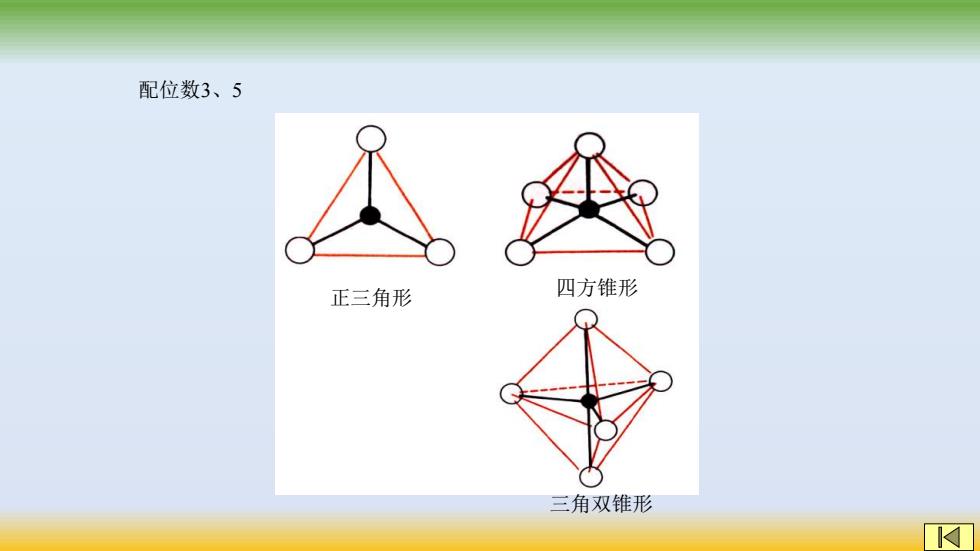
配位数3、5 正三角形 四方锥形 三角双锥形
配位数3、5 正三角形 四方锥形 三角双锥形