
第九章 化学键和分子结构(8) ○9.1离子键及离子化合物 9.2价键理论及共价化合物 9.3分子间力和氢键 9.4晶体结构简介(自学) 9.5超分子化学(自学) 本章作业
第九章 化学键和分子结构(8h) 9.1 离子键及离子化合物 9.2 价键理论及共价化合物 9.3 分子间力和氢键 9.4 晶体结构简介(自学) 9.5 超分子化学(自学) 本章作业

9.1离子键及离子化合物
9.1 离子键及离子化合物

9.1.1离子键(自学) 内容提纲: 1.离子键的形成 2.离子键的主要特征(无方向性、无饱和性) 3.决定离子化合物性质的因素 (1)离子半径及其变化规律 (2)离子的电荷 (3)离子的电子构型 4.品格能
9.1.1 离子键(自学) 内容提纲: 1. 离子键的形成 2. 离子键的主要特征(无方向性、无饱和性) 3. 决定离子化合物性质的因素 (1)离子半径及其变化规律 (2)离子的电荷 (3)离子的电子构型 4. 晶格能
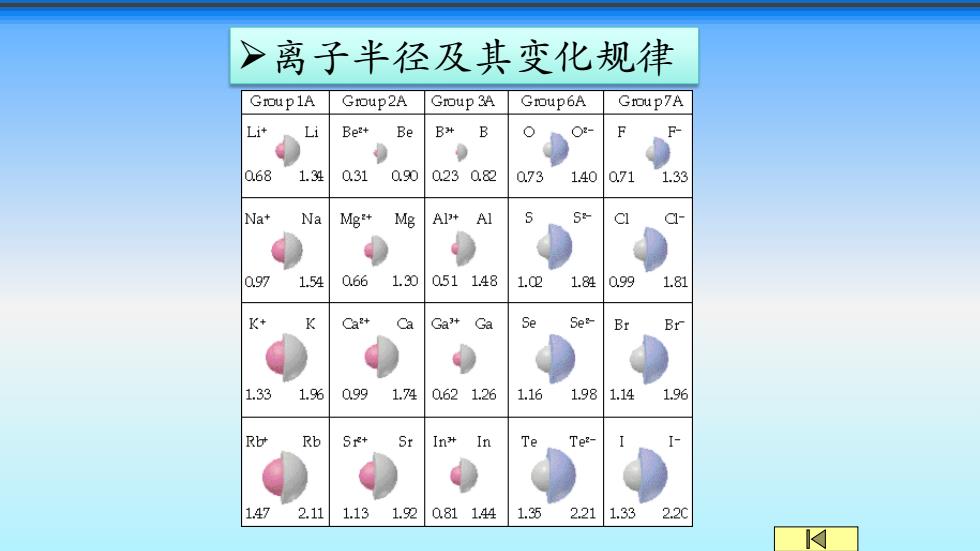
>离子半径及其变化规律 Group1A Group2A Group 3A Gmoup6A Group7A L计 Li Be+ Be B>B 0.68 1.34 0.31 090 0230.82 073 1.40 0.71 1.33 Na+ Na Mg+ Mg Ap+Al 0.97 1.54 0.661.30 0511.48 1.021.84 099 1.81 K+ Ca+ Ca Ga+ Ga Se 5e& Br Br 1.33 1.6 0991.74 0621.26 1.161.981.141.96 Rb Rb Sr+ Sr In* In Te- 1.47 2.11 1.131.920811.441.35 2.211.332.2
➢离子半径及其变化规律

>离子的电子构型 ※正离子的电子构型: ·2电子构型:(n-1)s2 如:Lit、Be2+ 8电子构型:n-1)s2n-1)p6 如:K+、Na+、Al3+ 18电子构型:n-1)s2(n-1)p(n-1)d10 如:Ag*、Hg2+ 18+2电子构型:n-1)s2(n-1)p6(n-1)d10ns2如:Sn2+、Pb2+ 9~17电子构型:n-1)s2(n-1)p6(n-1)d19 如:Fe2+、Mn2+ ※负离子的电子构型: 均为8电子构型
➢ 离子的电子构型 ※ 正离子的电子构型: • 2电子构型:(n-1)s2 如:Li+ 、Be2+ • 8电子构型:(n-1)s2 (n-1)p6 如: K+、Na+ 、Al3+ •18电子构型:(n-1)s2 (n-1)p6 (n-1)d10 如:Ag+ 、Hg2+ •18 + 2电子构型:(n-1)s2 (n-1)p6 (n-1)d10ns 2 如:Sn2+ 、Pb2+ •9 ~ 17电子构型:(n-1)s2 (n-1)p6 (n-1)d1~9 如:Fe2+ 、Mn2+ ※ 负离子的电子构型: 均为8电子构型

9.1.2离子的极化作用及变形性一离子化合物的性质 1.离子的极化作用 >离子极化的定义 在阴、阳离子自身电场的作用下,使其周围带异号电荷 的离子的电子云发生变形的现象 >影响离子极化的因素 阳离子的极化力:指离子产生电场强度的大小 ·离子的半径:半径↓,极化力个 ·离子的电荷:电荷个,极化力个 ·离子的电子构型:2e,18e,18+2e型>9~17e型>8e型
9.1.2 离子的极化作用及变形性—离子化合物的性质 ➢ 离子极化的定义 在阴、阳离子自身电场的作用下,使其周围带异号电荷 的离子的电子云发生变形的现象 ➢ 影响离子极化的因素 阳离子的极化力:指离子产生电场强度的大小 •离子的半径:半径 ,极化力 •离子的电荷:电荷 ,极化力 •离子的电子构型:2e , 18e , 18+2e型 > 9~17e型 > 8e 型 1 . 离子的极化作用
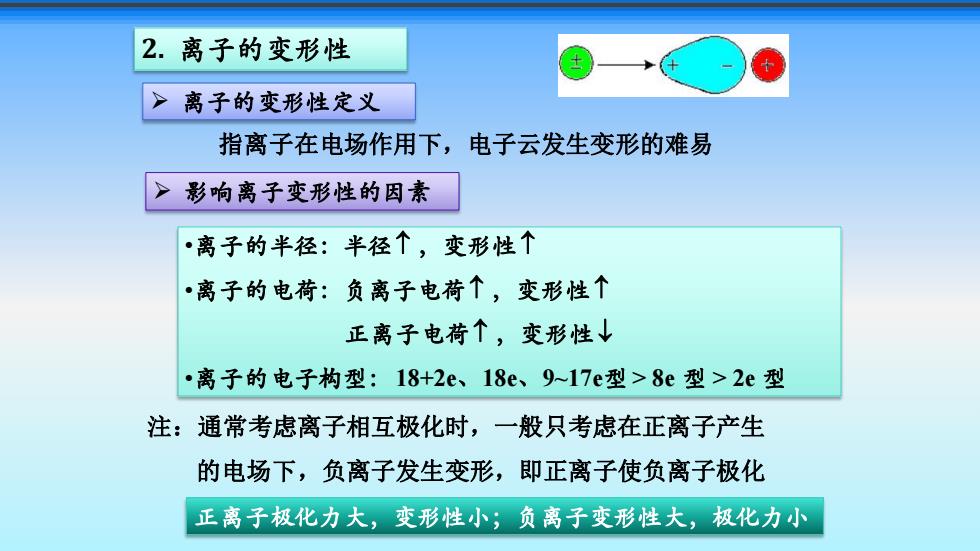
2.离子的变形性 离子的变形性定义 指离子在电场作用下,电子云发生变形的难易 影响离子变形性的因素 •离子的半径:半径个,变形性个 ·离子的电荷:负离子电荷个,变形性个 正离子电荷个,变形性↓ ·离子的电子构型:18+2e、18e、9-17e型>8e型>2e型 注:通常考虑离子相互极化时,一般只考虑在正离子产生 的电场下,负离子发生变形,即正离子使负离子极化 正离子极化力大,变形性小;负离子变形性大,极化力小
•离子的半径:半径 ,变形性 •离子的电荷:负离子电荷 ,变形性 正离子电荷 ,变形性 •离子的电子构型:18+2e、18e、9~17e型 > 8e 型 > 2e 型 注:通常考虑离子相互极化时,一般只考虑在正离子产生 的电场下,负离子发生变形,即正离子使负离子极化 正离子极化力大,变形性小;负离子变形性大,极化力小 ➢ 离子的变形性定义 指离子在电场作用下,电子云发生变形的难易 2. 离子的变形性 ➢ 影响离子变形性的因素
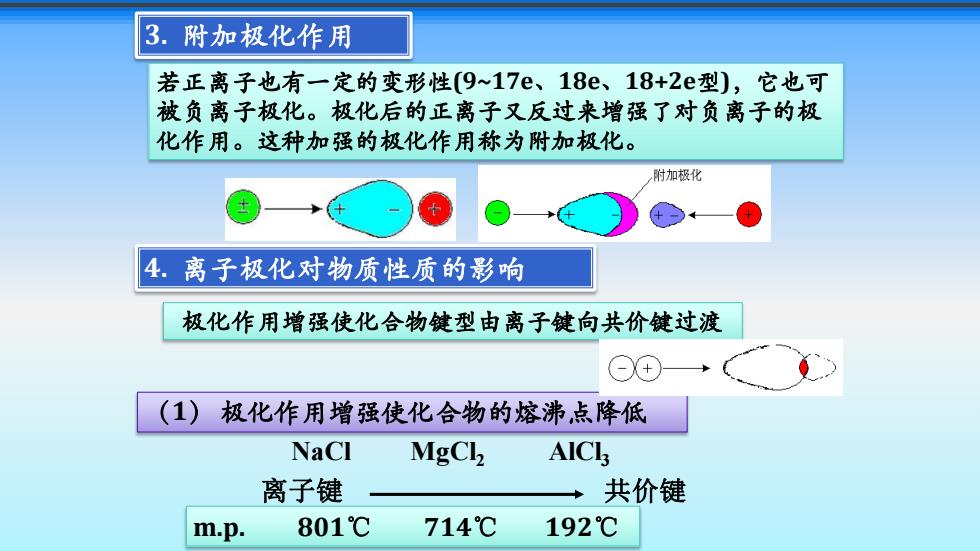
3.附加极化作用 若正离子也有一定的变形性(9~17e、18e、18+2e型),它也可 被负离子极化。极化后的正离子又反过来增强了对负离子的极 化作用。这种加强的极化作用称为附加极化。 附加极化 4.离子极化对物质性质的影响 极化作用增强使化合物键型由离子键向共价键过渡 (1) 极化作用增强使化合物的熔沸,点降低 NaCl MgCl AICls 离子键 共价键 m.p. 801℃ 714℃ 192℃
若正离子也有一定的变形性(9~17e、18e、18+2e型),它也可 被负离子极化。极化后的正离子又反过来增强了对负离子的极 化作用。这种加强的极化作用称为附加极化。 4. 离子极化对物质性质的影响 极化作用增强使化合物键型由离子键向共价键过渡 NaCl MgCl2 AlCl3 离子键 共价键 m.p. 801℃ 714℃ 192℃ (1) 极化作用增强使化合物的熔沸点降低 3. 附加极化作用
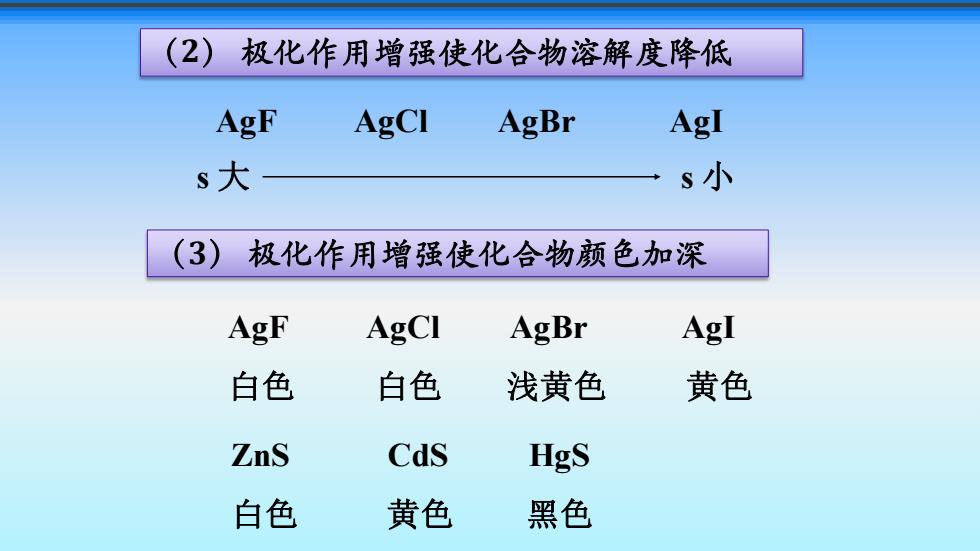
(2) 极化作用增强使化合物溶解度降低 AgF AgCI AgBr AgI s大 s小 (3)极化作用增强使化合物颜色加深 AgF AgCI AgBr AgI 白色 白色 浅黄色 黄色 ZnS Cds HgS 白色 黄色 黑色
(2) 极化作用增强使化合物溶解度降低 AgF AgCl AgBr AgI s 大 s 小 (3) 极化作用增强使化合物颜色加深 AgF AgCl AgBr AgI 白色 白色 浅黄色 黄色 ZnS CdS HgS 白色 黄色 黑色

(4)极化作用增强使化合物的热稳定性减弱 极化作用强,共价性强 分解温度 BeCO; <100°C MgCO3 CaCO3 极化作用减弱 540°C 900。C SrCO; 1290°C BaCO; 1360°C 极化作用弱,离子性强
(4) 极化作用增强使化合物的热稳定性减弱 BeCO3 MgCO3 CaCO3 SrCO3 BaCO3 极化作用强,共价性强 极化作用弱,离子性强 < 100 °C 540 °C 900 °C 1290 °C 1360 °C 分解温度 极 化 作 用 减 弱