
北京化工大学2013—2014学年第一学期 《基础化学》期中考试试卷 课程代码cHM10700T□ 班级: 姓名: 学号: 任课教师: 分数: 题号 三 四 五 总分 得分 一、判断题:(每空1分,共12分) (X)1.由于B为非极性分子,所以BL分子中无极性键。 (×)2.同核双原子分子双键的键能等于其单键键能的两倍。 (√)3.主量子数为4时,有4、4p、4d和4f四种原子轨道。 (×)4.过渡元素的原子的电子填充顺序是先填3d然后填45,所以失去电子时也 是按照这个次序。 (×)5.第八族元素的基态价电子层排布式为(m-1)fs2。 (×)6.元素原子在化合物中形成共价键的数目等于该基态原子未成对的电子数。 (×)7.18电子构型阳离子相应元素在周期表中的位置主要为d区。 (×)8.pH值为3.29的溶液中的H浓度值为5.13×10mol·dm3。 (×)9.在恒温恒容条件下,对于一可逆反应,增大某反应物浓度,则该反应物的 转化率增大。 (√)10.一个可逆反应的平衡常数与反应物的起始浓度和分压无关。 (√)11.当向某未达到平衡的反应体系中加入正催化剂时(其他条件不变),反应 速率会增加,反应物的平衡转化率不变。 (×)12.单质的△G、△H和S均为零。 第1页共6页
第 1 页 共 6 页 北京化工大学 2013——2014 学年第一学期 《基础化学》期中考试试卷 课程代码 C H M 1 0 7 0 0 T 班级: 姓名: 学号: 任课教师: 分数: 题号 一 二 三 四 五 总分 得分 一、判断题:(每空 1 分,共 12 分) (×)1. 由于 BI3 为非极性分子,所以 BI3 分子中无极性键。 (×)2. 同核双原子分子双键的键能等于其单键键能的两倍。 (√)3. 主量子数为 4 时,有 4s、4p、4d 和 4f 四种原子轨道。 (×)4. 过渡元素的原子的电子填充顺序是先填 3d 然后填 4s,所以失去电子时也 是按照这个次序。 (×)5. 第八族元素的基态价电子层排布式为(n-1)d6 ns 2 。 (×)6. 元素原子在化合物中形成共价键的数目等于该基态原子未成对的电子数。 (×)7. 18 电子构型阳离子相应元素在周期表中的位置主要为 ds 区。 (×)8. pH 值为 3.29 的溶液中的 H+ 浓度值为 -4 3 5.13 10 mol dm− × ⋅ 。 (×)9. 在恒温恒容条件下,对于一可逆反应,增大某反应物浓度,则该反应物的 转化率增大。 (√)10. 一个可逆反应的平衡常数与反应物的起始浓度和分压无关。 (√)11. 当向某未达到平衡的反应体系中加入正催化剂时(其他条件不变),反应 速率会增加,反应物的平衡转化率不变。 (×)12. 单质的 θ Δ f Gm 、 θ Δ f Hm 和 θ m S 均为零

二、选择题:(每题2分,共20分) 1.NH,和CC14之间的分子间作用力包括 () A.取向力和色散力 B.取向力、诱导力、色散力和氢键 C.诱导力和色散力 D.取向力、诱导力和色散力 2.下列各组用四个量子数来描述核外电子的运动状态,合理的是 A.n=31=3m=2m,=-1/2 B.n=31=2m=2m,=+1/2 C.n=41=2m=3m,=+1/2 D.n=21=1m=1m,=-1 3.下列轨道上的电子在)平面上出现的几率密度为0的是 () A.3d. B.3d C.3s D.3p. 4.对离子或原子半径大小的判断不正确的是 A.r(S)>r(CI) B.r(Fe2)>r(Fe) C.r(CD)15kJmor! C.<15 kJ-mol! D.无法判断 6.减少偶然误差的方法是 () A.增加平行测定次数 B.作对照实验 C.做空白实验 D.进行仪器校正 7.在某温度下,AB(g)+CD(g)=AC(g)+BD(g,Imol化合物AB与1mo 化合物CD参与反应并达到平衡,AB和CD都有34被转化了,体积不变,则该反 应的平衡常数是 () A.9/16 B.1/9 C.9 D.无法判断 8.反应NO2(g)+NO(g)一NO(g)的△,H=-40.5kJ·mo',反应达到平衡 时,下列因素中可使平衡逆向移动的是 A.保持T和V不变,压入氖气 B.保持P和T不变,压入氨气 C.保持V和p不变,T减小 D.保持T不变,使V减小 9.下列物质中△,H为零的是 A.石墨,白磷B.石墨,红磷 C.金刚石,白磷D.金刚石,红磷 10.某基元反应mA(g)+B(g)一pC(g)达到平衡时,如果压强增大一倍,则正 反应速率增加 () A.+n倍 B.mn倍 C.2m+2倍 D.2m"倍 第2页共6页
第 2 页 共 6 页 二、选择题:(每题 2 分,共 20 分) 1. NH3 和 CCl4 之间的分子间作用力包括 ( ) A. 取向力和色散力 B. 取向力、诱导力、色散力和氢键 C. 诱导力和色散力 D. 取向力、诱导力和色散力 2. 下列各组用四个量子数来描述核外电子的运动状态,合理的是 ( ) A. n = 3 l = 3 m = 2 ms = -1/2 B. n = 3 l = 2 m = 2 ms = +1/2 C. n = 4 l = 2 m = 3 ms = +1/2 D. n = 2 l = 1 m = 1 ms = -1 3. 下列轨道上的电子在 xy 平面上出现的几率密度为 0 的是 ( ) A. 2 z 3d B. 2 2 x -y 3 C. 3s D. d 3pz 4. 对离子或原子半径大小的判断不正确的是 ( ) A. r (S) > r (Cl) B. r (Fe2+) > r (Fe3+) C. r (Cl- ) 15 kJ·mol-1 C.<15 kJ·mol-1 D.无法判断 6. 减少偶然误差的方法是 ( ) A.增加平行测定次数 B.作对照实验 C.做空白实验 D.进行仪器校正 7. 在某温度下,AB(g) + CD(g) AC(g) + BD(g),1mol 化合物 AB 与 1mol 化合物 CD 参与反应并达到平衡,AB 和 CD 都有 3/4 被转化了,体积不变,则该反 应的平衡常数是 ( ) A.9/16 B.1/9 C.9 D.无法判断 8. 反应 NO2(g) + NO(g) N2O3(g)的 1 40.5kJ mol− Δ =- ⋅ θ rHm ,反应达到平衡 时,下列因素中可使平衡逆向移动的是 ( ) A.保持 T 和 V 不变,压入氖气 B.保持 p 和 T 不变,压入氦气 C.保持 V 和 p 不变,T 减小 D.保持 T 不变,使 V 减小 9. 下列物质中 θ Δ f Hm 为零的是 ( ) A.石墨,白磷 B.石墨,红磷 C.金刚石,白磷 D.金刚石,红磷 10. 某基元反应 mA(g) + nB(g) pC(g)达到平衡时,如果压强增大一倍,则正 反应速率增加 ( ) A.m+n 倍 B.mn 倍 C.2m+2n 倍 D.2m+n 倍

三、填空:(每空1分,共20分) 1,在NH、HF、HBO、HNO、CHF3、CH6中,能够形成分子内氢键的是NO 形成分子间氢键的是NH、HF、HBO: 2.CH4、NH、BF3、HO分子中,键角由大到小的顺序为BF3>CH>NH>HO。 3.当=4时,电子层的最大电子容量为32一,4电子实际在第云周期 中开始出现。 4.CaCl2、NaC1、MnC2、ZnCl2按离子极化大小排列ZnC2、MnC2、CaC2,NaC。 5、已知2P(s)+3C12(g)=2PC13(0△,H=-634.5 kJ.mol- PCl)+C12(g)=PC1s(s)△,H2=-173.1kJ·mol 求PC1l5(s)的△,H=-490.3或-490.4kJmo。 6.封闭体系吸热1000J,对环境做540J的功,则体系的热力学能的变化460 7120x426-1240-245 5.4375 8.在一定温度下,密闭容器中,加入一定量的NO2,发生2NO2(g)=N2O(g) 反应,经过一段时间达到平衡,其最终压强为初始压强的85%。则NO2的转化率为 30%。 9、因为正催化剂参与到反应中,降低了反应的活化能,所以可以使反应速率增加。 10.反应N2(g)+3H(g)亡2NH(g)的压力平衡常数的表达式 K,= (Pw.)2 单位为Pa2 (PwPm 11某反应的△,H(298.15K)=146.0 kJ.mol~,△,S(298.15K)=110.4Jmol.K-1, 则反应的转变温度为1322K 12.将少量NHNO3溶于水,这是一个吸热的过程,则△G3_0和△S20。(请填 写>,<,=) 第3页共6页
第 3 页 共 6 页 三、填空:(每空 1 分,共 20 分) 1. 在 NH3、HF、H3BO3、HNO3、CHF3、C6H6 中,能够形成分子内氢键的是 HNO3, 形成分子间氢键的是 NH3、HF、H3BO3 。 2. CH4、NH3、BF3、H2O 分子中,键角由大到小的顺序为 BF3 > CH4 > NH3 > H2O。 3. 当 n = 4 时,电子层的最大电子容量为 32 ,4f 电子实际在第 六 周期 中开始出现。 4. CaCl2、NaCl、MnCl2、ZnCl2 按离子极化大小排列 ZnCl2、MnCl2、CaCl2 、NaCl 。 5、已知 2P(s) + 3Cl2(g) 2PCl3(l) 1 634.5kJ mol− Δ = − ⋅ θ rHm PCl3(l) + Cl2(g) PCl5 (s) 1 173.1kJ mol− Δ = − ⋅ θ rHm 求 PCl5 (s)的 θ Δ f Hm = -490.3 或 -490.4 kJ·mol-1 。 6. 封闭体系吸热 1000 J,对环境做 540 J 的功,则体系的热力学能的变化 460J 。 7. = ( - ) 5.4375 1.20× 112.6 1.240 24.5 。 8. 在一定温度下,密闭容器中,加入一定量的 NO2,发生 2NO2(g) N2O4(g) 反应,经过一段时间达到平衡,其最终压强为初始压强的 85%。则 NO2 的转化率为 30%。 9、因为正催化剂参与到反应中,降低了反应的活化能,所以可以使反应速率增加。 10. 反应 N2(g) + 3H2(g) 2NH3(g)的压力平衡常数的表达式 K p = 3 2 ( )( ) ( ) 2 2 3 N H NH p p p ,单位为 Pa-2 。 11.某反应的Δ (298.15K) = θ rHm 1 146.0kJ mol− ⋅ ,Δ (298.15K) = θ r m S 1 1 110.4J mol K − − ⋅ ⋅ , 则反应的转变温度为 1322K 。 12. 将少量 NH4NO3 溶于水,这是一个吸热的过程,则ΔG 0。(请填 写 >, <, =)
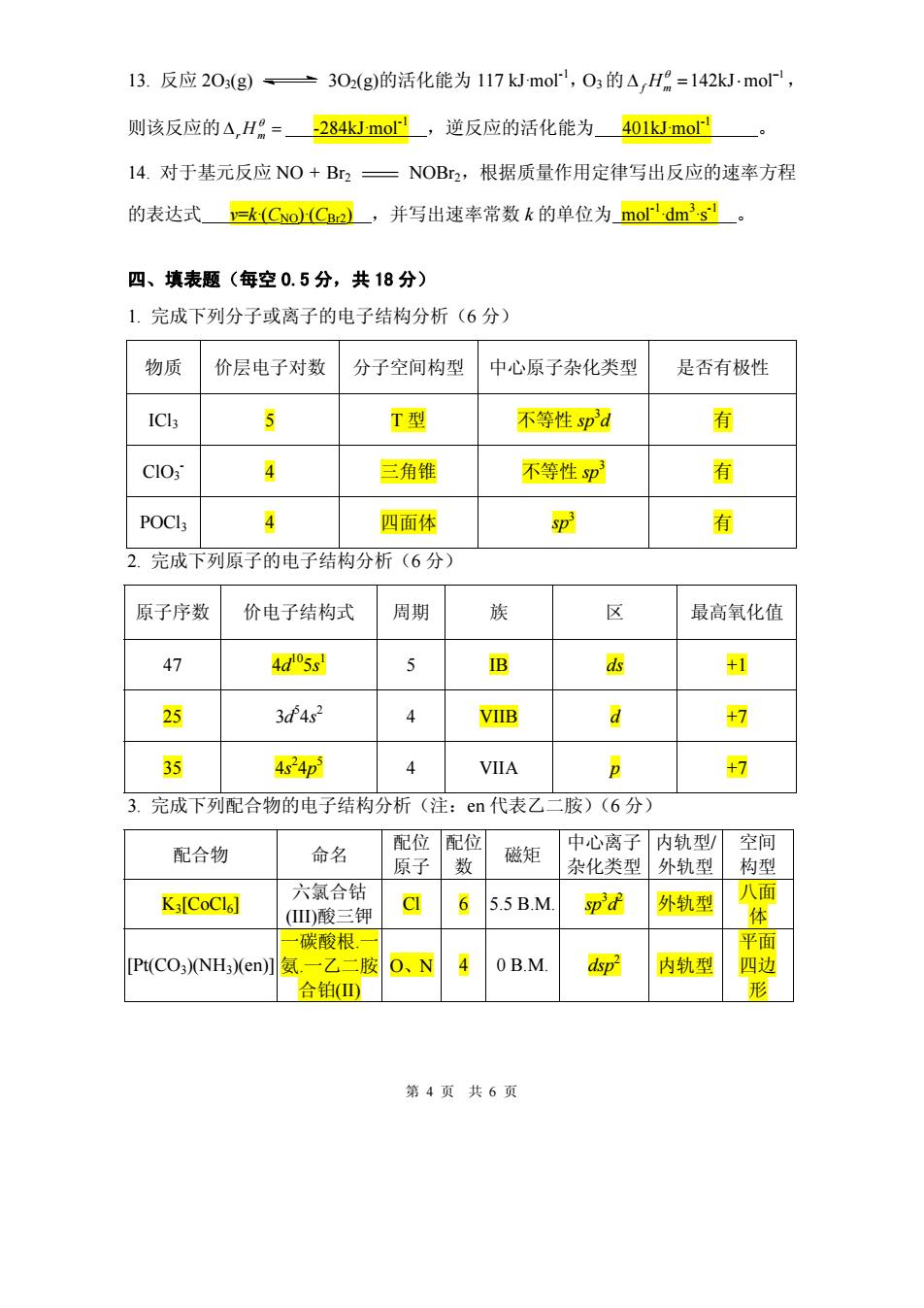
13.反应20s(g)、→302(g)的活化能为117kmo,03的△,H=142kJ·mol 则该反应的△,H=284kJmo,逆反应的活化能为401kJmo 14.对于基元反应NO+B一NOBr2,根据质量作用定律写出反应的速率方程 的表达式=k(CoC2),并写出速率常数k的单位为mor'dm's。 四、填表题(每空0.5分,共18分) 1.完成下列分子或离子的电子结构分析(6分) 物质 价层电子对数 分子空间构型中心原子杂化类型 是否有极性 ICls T型 不等性pa 有 CIO 4 三角锥 不等性sp 有 POCI 四面体 鄂 内 2.完成下列原子的电子结构分析(6分) 原子序数 价电子结构式 周期 族 区 最高氧化值 47 4d53 B +1 25 3d4s 4 VIIB a +7 424p 4 VIIA +7 3.完成下列配合物的电子结构分析(注:en代表乙二胺)(6分) 配合物 命名 配位配位 原子数 磁矩 中心离子内轨型空间 杂化类型外轨型构型 六合钻 八面 K3[CoCl6] 钾 65.5B.M sp'd 外轨型 )酸 碳酸根. PtCO3)NH)en]氮 -乙二胺O、N40B.M dsp- 内轨型 四 合铂(山 第4页共6页
第 4 页 共 6 页 13. 反应 2O3(g) 3O2(g)的活化能为 117 kJ·mol-1,O3 的 1 142kJ mol− Δ = ⋅ θ f Hm , 则该反应的Δ = θ rHm -284kJ·mol-1 ,逆反应的活化能为 401kJ·mol-1 。 14. 对于基元反应 NO + Br2 NOBr2,根据质量作用定律写出反应的速率方程 的表达式 v=k·(CNO)·(CBr2) ,并写出速率常数 k 的单位为 mol-1·dm3 ·s-1 。 四、填表题(每空 0.5 分,共 18 分) 1. 完成下列分子或离子的电子结构分析(6 分) 物质 价层电子对数 分子空间构型 中心原子杂化类型 是否有极性 ICl3 5 T 型 不等性 sp 3 d 有 ClO3 - 4 三角锥 不等性 sp 3 有 POCl3 4 四面体 sp 3 有 2. 完成下列原子的电子结构分析(6 分) 原子序数 价电子结构式 周期 族 区 最高氧化值 47 4d105s 1 5 IB ds +1 25 3d5 4s 2 4 VIIB d +7 35 4s 2 4p 5 4 VIIA p +7 3. 完成下列配合物的电子结构分析(注:en 代表乙二胺)(6 分) 配合物 命名 配位 原子 配位 数 磁矩 中心离子 杂化类型 内轨型/ 外轨型 空间 构型 K3[CoCl6] 六氯合钴 (III)酸三钾 Cl 6 5.5 B.M. sp 3 d2 外轨型 八面 体 [Pt(CO3)(NH3)(en)] 一碳酸根.一 氨.一乙二胺 合铂(II) O、N 4 0 B.M. dsp2 内轨型 平面 四边 形

五、计算题:(共4道题,总分30分) 1.对一种物质有效成份的含量进行平行测定,结果为10.17%,10.04%,10.19% 1017%1014%1015%。墙对数据分析后,计算(1)结果的平均值:2)平均偏美 和标准偏差:(3)平均值的标准偏差和置信度为95%的平均值的置信区间。(8分) 0值衣 t分布表 测定次数4 56 f-1 置信度95% Q0950.840.730.64 4 2.776 5 2.571 6 2.447 解:将测量值由小到大排列 10.04%,10.14%,10.15%,10.17%,10.17%,10.19% 极差R=10.19%-10.04%=0.15% 对于10.19% 4=5-10.19%-1017%-013 R 0.15% 2t=0.132(P-95%,n=6)=0.64舍去 排除10.04%后,再做统计分析 F-10.14%+10.15%+10.17%+10.17%+10.19% =10.16% 1分 7=∑k-_0.02%+0.01%+0.01%+0.01%+0.03% 5 1分 =0.02% 5=②出 0.02%2+0.01%2+0.01%2+0.01%2+0.03% u-1 5-1 1分 =0.02% 1分 =5,P=95%,查表2.776 ="=016%±276x02% 5 =10.16%±0.02% 置信区间为110.14%-10.18% 2分 2.已知CaC0(s) Ca0(s)+C02(g)在973K时,K=3.00102 ,在1173K 第5页共6页
第 5 页 共 6 页 五、计算题:(共 4 道题,总分 30 分) 1. 对一种物质有效成份的含量进行平行测定,结果为 10.17%, 10.04%, 10.19%, 10.17%, 10.14%, 10.15%。请对数据分析后,计算(1) 结果的平均值;(2) 平均偏差 和标准偏差;(3) 平均值的标准偏差和置信度为 95%的平均值的置信区间。(8 分) Q 值表 t 分布表 测定次数 4 5 6 f=n-1 置信度 95% Q0.95 0.84 0.73 0.64 4 2.776 5 2.571 6 2.447 解:将测量值由小到大排列 10.04%, 10.14%, 10.15%, 10.17%, 10.17%, 10.19% 极差 R=10.19%-10.04%=0.15% 对于 10.19% 0.13 0.15% 1 10.19% 10.17% = − = − = − R x x Q n n 计 Q计 = 0.13 Q (P=95%,n=6) = 0.64 舍去 排除 10.04%后,再做统计分析 10.16% 5 10.14% 10.15% 10.17% 10.17% 10.19% = + + + + x = 1 分 0.02% 5 0.02% 0.01% 0.01% 0.01% 0.03% 5 = + + + + = − = ∑ x x d i 1 分 0.02% 5 1 0.02% 0.01% 0.01% 0.01% 0.03% 1 ( ) 2 2 2 2 2 2 = − + + + + = − − = ∑ n x x s i 1 分 0.01% 5 0.02% = = = n s sx 1 分 n=5, P =95%,查表 t=2.776 10.16% 0.02% 5 0.02% 10.16% 2.776 = ± = ± ⋅ = ± × n s μ x t 置信区间为 [10.14%~10.18%] 2 分 2. 已知 CaCO3(s) CaO(s) + CO2(g) 在 973K 时, 2 3.00 10- = × θ K ,在 1173K

时,K0=1.00, 问:(1)上述反应是吸热反应还是放热反应?(2)该反应的△,H是多少?(6分) 解:由于温度上升时K“增大的,该反应为吸热反应。 2分 按照下式 n0-A气}代入素值计第 K°(973K) 公式 2分 1.00 △,HQ 1 1 a30x10-83J:mo.K973K73K) 所以结果△,H=1.66×10Jmol=1.66×102 kJ.moI 结果 2分 3.反应:PCls(g) →PC1(g)+C12(g)在760K时的平衡常数K°为33.3.若将50.0 克的PCl5注入容积为3.00dm3的密闭容器中,求平衡时PC1s的分解百分数。 此时容器中的压力是多少?已知PC15的分子量为208。(8分) 解:刚开始PCs未分解时的压力为 50.0g p=XRx _208gm0x831m0.K'×760K 2分 V 3.00×10-3m3 =5.06×103Pa 设平衡时PCl的分压为xP PCI(g) PCl(g) + Cl(g) 开始 5.06×10Pa 0 mol 0 mol 2分 平衡时(5.06×105.x)Pa xPa xPa K°=p(PCl p(C,)/p' (x/105)(x/10) (PCI)/D I5.06×105-x)/10] =33.3 整理得到方程x2+3.33×10°-1.68×102=0 2分 解得x=4.45×105Pa 所以PC5的分解百分数=445x10心Px100%=87.9% 1分 5.06×10Pa 平衡时总压力为4.45×105Pa+5.06×105Pa=9.51×10Pa 1分 4.一化学反应,当其温度由300K升温到310K时,其反应速率加快到10倍。 第6页共6页
第 6 页 共 6 页 时, =1.00 θ K , 问:(1)上述反应是吸热反应还是放热反应?(2)该反应的 θ ΔrHm 是多少?(6 分) 解:由于温度上升时 θ K 增大的,该反应为吸热反应。 2 分 按照下式 ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ − Δ = 1 2 r m 1 2 1 1 (973K) (1173K) ln R T T H K K θ θ θ 代入数值计算 公式 2 分 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − ⋅ ⋅ Δ = × − 1173K 1 973K 1 3.00 10 8.31 J mol K 1.00 ln -1 -1 r m 2 θ H 所以结果 5 -1 2 -1 Δr m = 1.66×10 J ⋅mol = 1.66×10 kJ ⋅mol θ H 结果 2 分 3. 反应:PCl5(g) PCl3(g) + Cl2(g)在 760K 时的平衡常数 θ K 为 33.3。若将 50.0 克的 PCl5 注入容积为 3.00dm-3 的密闭容器中,求平衡时 PCl5 的分解百分数。 此时容器中的压力是多少?已知 PCl5 的分子量为 208。(8 分) 解:刚开始 PCl5 未分解时的压力为 5.06 10 Pa 3.00 10 m 8.31 J mol K 760K 208g mol 50.0g 5 3 3 -1 -1 1 × × × ⋅ ⋅ × ⋅ = × × = − − = V n R T p 2 分 设平衡时 PCl3 的分压为 x Pa PCl5(g) PCl3(g) + Cl2(g) 开始 5.06 10 Pa 5 × 0 mol 0 mol 2 分 平衡时 Pa (5.06 10 - ) 5 × x x Pa x Pa 33.3 [(5.06 10 - )/ 10 ] ( / 10 )( / 10 ) [ (PCl )/ ] [ (PCl )/ ] [ (Cl )/ ] 5 5 5 5 5 θ 3 2 = × = × = x x x p p p p p p K θ θ θ 整理得到方程 3.33 10 -1.68 10 0 2 6 12 x + × × = 2 分 解得 4.45 10 Pa 5 x = × 所以 PCl5 的分解百分数= 100% 5.06 10 Pa 4.45 10 Pa 5 5 × × × =87.9% 1 分 平衡时总压力为4.45 10 Pa 5.06 10 Pa 9.51 10 Pa 5 5 5 × + × = × 1 分 4. 一化学反应,当其温度由 300K 升温到 310K 时,其反应速率加快到 10 倍

(1)求此反应的活化能? (2)在300K下,如果加入催化剂后,其活化能减小了20%,问加入催化剂后,反 应速率增大了多少倍。(8分) 解:按照下式计算 1nk(310KN-E1-1) 代入数值 3分 k (300K)RT T 10 oT= E。 1 .31Jmol1.K300K310K 整理得到E,=1.78×105Jmol=1.78×102 kJ.mol 1分 (2)按下式计算 k RT 3分 =E,1-0.80E1=4-0.8W×1.78×10J·mo -=14.3 RT 8.31J-mol1.K1×300K 所以=e4=1.62x10倍 1分 k 第7页共6页
第 7 页 共 6 页 (1) 求此反应的活化能? (2) 在 300K 下,如果加入催化剂后,其活化能减小了 20%,问加入催化剂后,反 应速率增大了多少倍。(8 分) 解:按照下式计算 ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ = − 1 2 a 1 2 1 1 (300K) (310K) ln R T T E k k 代入数值 3 分 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − ⋅ ⋅ = 310 K 1 300 K 1 1 8.31 J mol K 10 ln -1 -1 Ea 整理得到 5 -1 2 -1 Ea =1.78×10 J ⋅mol = 1.78×10 kJ ⋅mol 1 分 (2)按下式计算 14.3 8.31 J mol K 300K 0.80 1 0.80 1.78 10 J mol ln -1 -1 5 -1 a1 a1 a2 a1 a1 a2 1 2 = (- ) - - - = ⋅ ⋅ × × × ⋅ = − = − ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ = RT E E RT E E RT E RT E k k 3 分 所以 14.3 6 倍 1 2 = e = 1.62×10 k k 1 分