
酸碱溶液浓度的比较 一、实验目的 1.学会满定管的洗涤、涂油、试和气泡除方法, 2.练习滴定操作技术,学会正确使用酸式、碱式滴定管和读数方法, 3.学会正确判断酚肽,甲基两种酸碱指示剂的滴定终点(即变色点) 4,学会分析数据的正确记录和计算方法, 实验前要求预习第四章第六节(一)滴定管的准备和使用 二、实验试剂 1.浓度为-0.1mol/LNaOH溶液(要求不含碳酸根) 2.浓度为-0.1mol/LHC溶液 3.0.1指示剂: 4.0.1%甲基橙指示剂 三、实验内容 1.实验仪器的准备 (1)酸式、碱式滴定管各一支,洗涤至内壁不挂水珠,然后涂油、试漏,最后用5~10ml 去离子水润洗三次备用。 (2)锥形瓶三个、称量瓶两个,用自来水洗至不挂水珠,再用少量去离子水洗三次,备 用,称量瓶洗净后倒扣在干净的表面皿或滤纸上,令其自然干燥,以备下次实验用, 2.酸碱溶液浓度的比较 (1)将洗好的酸碱定管分别用-0.1mol/L的HC溶液和-0.1ml/L NaOH溶液5~10ml润洗滴定管内壁和尖嘴3次,然后将HCl和NOH溶液分别装入酸、碱 滴定管,并把液面刻度调到近“0”处,静置1分钟再调至刻度“0”处,记录初始读数, (2)由碱式滴定管放出25.00ml,浓度co-0.1mol/LNaOH溶液子锥形瓶中,加 20ml去离子水和1~2滴0.1%甲基橙指示剂,用浓度-0.1ml/LHCl溶液璃定,溶液 由黄变橙即为滴定终点,记录最终读数, 按此方法重复滴定几次,计算酸、碱溶液的浓度比/ 若滴过终点还可从碱滴定管加几滴NOH溶液,再用=0.1mol/LHCl溶液滴定至 由黄变橙为止,由最终读数计算浓度比, (3)由式滴定管放出25.00ml浓度=0.1mol/LHCl溶液维形瓶中,加20ml去 离子水和1~2滴0.1%指示剂,用浓度cm-0.1mol/LNaOH溶液滴定,溶液微红 色保持30m不退即为终点,记录最终读数, 依此方法重复滴定几次,计算酸碱溶液浓度比/,若定过了终点,也可以从 酸式滴定管加几滴HCl溶液,使溶液变为无色,再用-0.1ml/LNOH溶液滴定到微 红色,根据最终读数计算浓度比, 四、思考题 1,在装人标准溶液之前,滴定管为什么要用标准溶液洗3次?滴定中使用的锥形瓶是 否需要用试液润洗3次? 2.用碱标准溶液滴定酸时,要酚酞为指示剂滴定到微红色终点后放置一段时间为什么微 红色会退去?是否需要再滴定? 3.滴定时在锥形瓶中加人少量去离子水,是否影响终点读数?为什么? 五、实验记录表格和数据处理(表6-1)(供参考) 1.用甲基橙作指示剂, 2.用酚作指示剂(格式同表6-1)
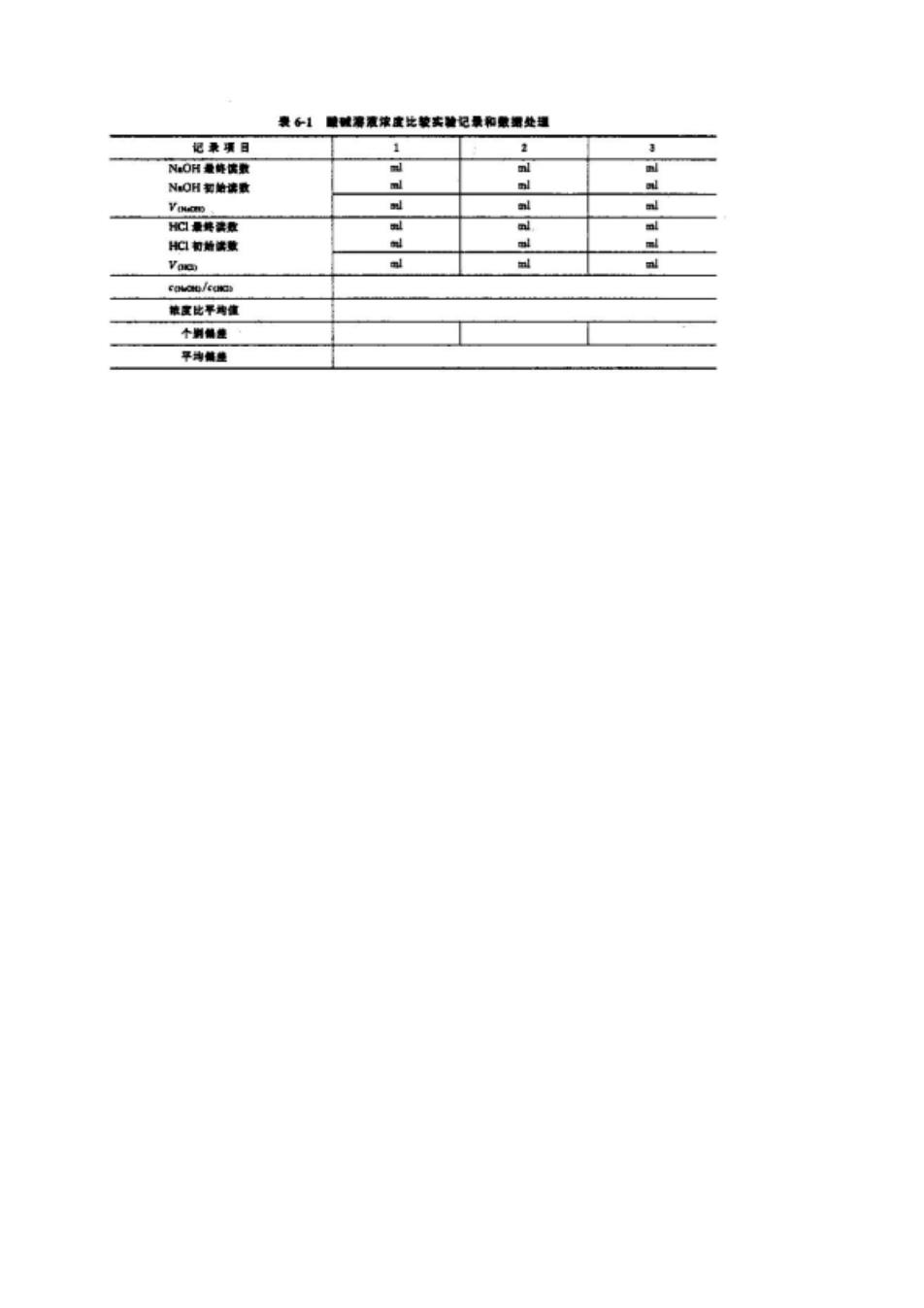
要各】酸城溶液辣度比敏实被记最和雕理处理 起兼W目 1 OH象降害取 N:OH套敏读数 口知给法数 辣度比平鸡准 个到餐复 果相门