
第四章萃取 第一节概述 Extraction 11更义 苏海传 深背瓷整赛科到袍毫魏吸的分季数价 1-2分與 至少有一相为流体,即为草取剂(Extractant) 分 物的科 1-3革取燥作的几个程 根据率取荆种类和形式不同: 澄清过程:分散的液滴藏聚合并,形成两相。 (简称剂草取 溶再生:多来用燕馏或反取 l-4反華取(Back extraction) 15应用围 反苯取: 口液体混合物中相对挥发度a1,精馏操作不经 [萃取完成后→→→纯化同标产物或下一步分离 济 制药、食品、生物产品】 洗漆操作: 口液体混合物中含有较多气化潜热很大的岛椰 腐诗透系到有教湘的条质,提高反苹浅中目标产物 亮桃念:而板命又不走用棉物,林排排林中
1 第四章 萃取 (Extraction) 苏海佳 生化分离工程 第四章 第四章 | 萃取:溶质在互不相溶的两相之间分配系数的 不同而使溶质得到纯化或浓缩的方法。 1-1 定义 生化分离工程 第四章 第四章 | 1-2 分类 至少有一相为流体,即为萃取剂(Extractant) 根据萃取剂种类和形式不同: 分类 萃取剂 目标物的原料 液液萃取 液 液 固液萃取或浸取(leaching)液 固 超临界萃取 超临界流体 固或液 生化分离工程 第四章 第四章 | 根据萃取剂种类和形式不同: 有机溶剂萃取(简称溶剂萃取) 液液萃取 双水相萃取 液膜萃取 反胶团萃取 1-3 萃取操作的几个过程 混合过程:原料液和萃取剂充分接触,各组分 发生不同程度的相际转移,进行质量传递。 生化分离工程 第四章 第四章 | 澄清过程:分散的液滴凝聚合并,形成两相。 溶剂再生:多采用蒸馏或反萃取。 1-4 反萃取(Back extraction) 萃取完成后纯化目标产物或下一步分离 调节水相条件,将目标产物从有机相转 入水相的萃取操作。 反萃取: 生化分离工程 第四章 第四章 | 除去萃取到有机相的杂质,提高反萃液中目标产物 的纯度。 洗涤操作: 1-5 应用范围 液体混合物中相对挥发度α≈1,精馏操作不经 济 液体混合物在蒸馏时出现恒沸物; 热敏性物料,加热易分解、聚合或变性,如 生化分离工程 第四章 第四章 | 制药、食品、生物产品。 液体混合物中含有较多气化潜热很大的易挥 发组分,而组分又不是目标物,精馏操作中 能耗大
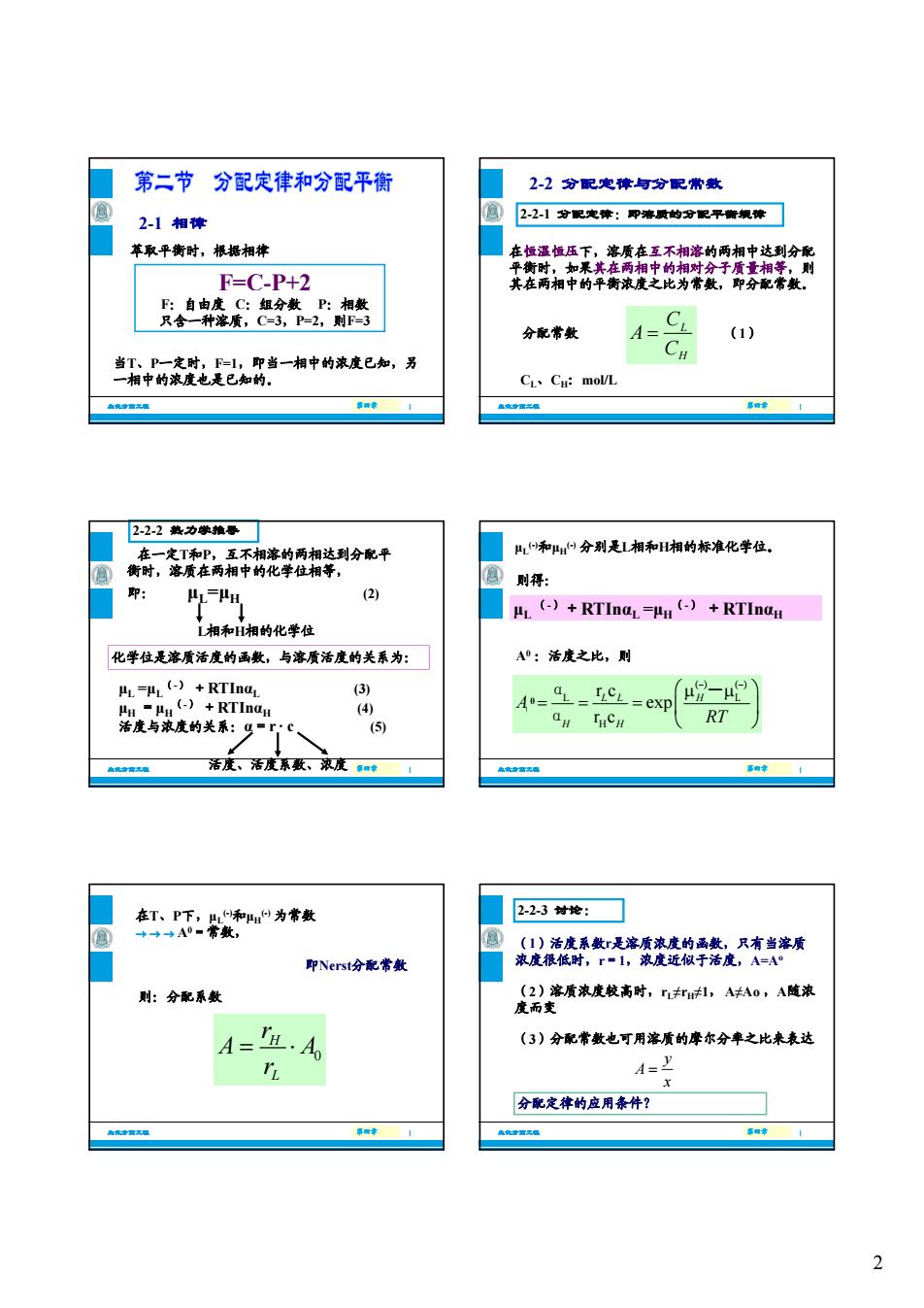
第二节分配定律和分配平衡 2-2分配定律与分配常数 21相德 2-2,1分配克障:即溶受的分配平衡规障 草取平衡时,根搭相 F=D42 平相中的 及降: 分配常数 (1) 盖有中的资比一湘中的冰成已加,为 C、C:molL 2-22热力噪推票 分别是湘和H湘的标准化学位。 国则得: HL HH (2 相和H相的化学位 化学位是溶质活度的画戴,与溶质活度的关系为: A:活度之比,则 .-BL()+RTIna. (3) aM THCH RT 活度、活度东数、浓度中 在却T:为常货 ■223材e:☐ 即Nersta分配常数 促产吸盛检手醛有美客质 则:分配系数 设生项我度段高时,,A0,A道流 A=且.A (3)分配常数也可用溶质的摩尔分率之比来表达 A=2 分配定律的应用泰件? 2
2 2-1 相律 F=C-P+2 萃取平衡时,根据相律 生化分离工程 第四章 第四章 | F:自由度 C:组分数 P:相数 只含一种溶质,C=3,P=2,则F=3 当T、P一定时,F=1,即当一相中的浓度已知,另 一相中的浓度也是已知的。 在恒温恒压下,溶质在互不相溶的两相中达到分配 平衡时,如果其在两相中的相对分子质量相等,则 其在两相中的平衡浓度之比为常数,即分配常数。 2-2 分配定律与分配常数 2-2-1 分配定律:即溶质的分配平衡规律 生化分离工程 第四章 第四章 | L H C A C CL、CH:mol/L 分配常数 (1) L相和H相的化学位 在一定T和P,互不相溶的两相达到分配平 衡时,溶质在两相中的化学位相等, 即: μL=μH (2) 化学位是溶质活度的函数,与溶质活度的关系为: 2-2-2 热力学推导 生化分离工程 第四章 第四章 | μL =μL (-) +RTInαL (3) μH =μH (-) +RTInαH (4) 活度与浓度的关系:α=r · c (5) 化学位是溶质活度的函数,与溶质活度的关系为: 活度、活度系数、浓度 μL (-)和μH (-) 分别是L相和H相的标准化学位。 μL (-)+RTInαL =μH (-) +RTInαH A0 :活度之比,则 则得: 生化分离工程 第四章 第四章 | A0 :活度之比,则 L 0 H r c exp r c LL H H H A RT (-) (-) α - L α 0 则:分配系数 在T、P下,μL (-)和μH (-) 为常数 A0=常数, 即Nerst分配常数 生化分离工程 第四章 第四章 | 0 H L r A A r 2-2-3 讨论: (1)活度系数r是溶质浓度的函数,只有当溶质 浓度很低时,r=1,浓度近似于活度,A=Ao (2)溶质浓度较高时,rL≠rH≠1, A≠Ao ,A随浓 度而变 生化分离工程 第四章 第四章 | (3)分配常数也可用溶质的摩尔分率之比来表达 y A x 分配定律的应用条件?
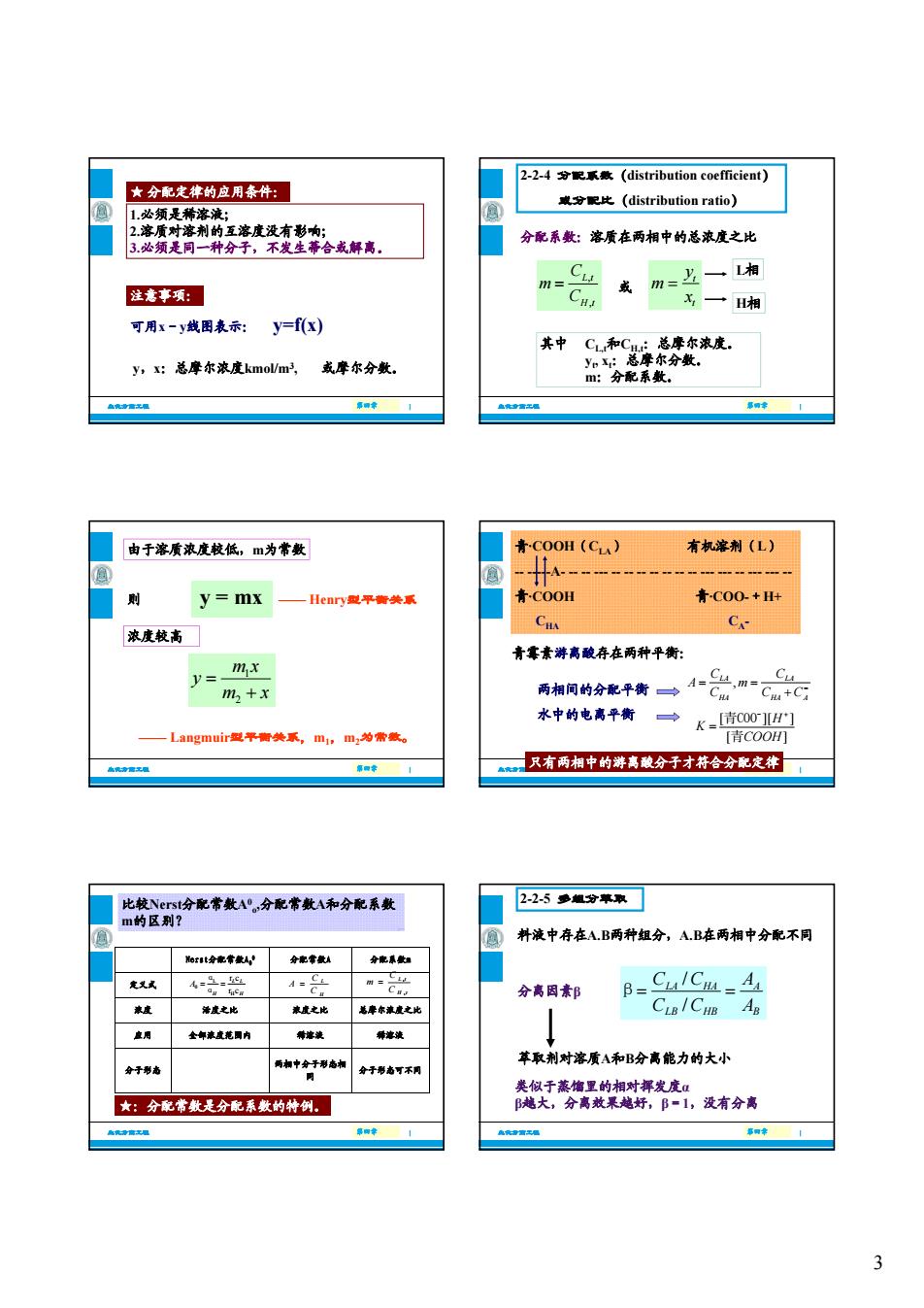
★分配走律的应用泰件: k分起比(distribution ratio) 分配系数:溶质在两相中的总浓度之比 注意事项: mC 或m=上一湘 x一H相 可用x-y线围表示:y=f(x) 其中C和C y,:总摩尔浓度kmol/m,或摩尔分数。 m:分配系数 由于溶质浓度校低,m为常数 青CO0H(C) 有机津荆(L) 则 y=mx Henn要平衡关系 青C00H 青C00++ C C- 来度較高 青素游高酸存在两种平衡: m.x y=m+x 两相同的分配平衡一4=兴m 水中的电高牛→K- 只有两相中的游离酿分子才符合分定 配常A分配常数A不分配系数 225●题分草取 的区别? 补液中存在AB两种组分,AB在两相中分配不同 分高因素邦 B 苹取剂对溶质A和B分高能力的大小 :分配常数分配系数的特创。 泰于透的对度,凌有合高 3
3 1.必须是稀溶液; 2.溶质对溶剂的互溶度没有影响; 3.必须是同一种分子,不发生蒂合或解离。 ★ 分配定律的应用条件: 注意事项: 生化分离工程 第四章 第四章 | 可用x-y线图表示: y=f(x) y,x:总摩尔浓度kmol/m3, 或摩尔分数。 2-2-4 分配系数(distribution coefficient) 或分配比(distribution ratio) 分配系数:溶质在两相中的总浓度之比 CL t, m C 或 t y m L相 生化分离工程 第四章 第四章 | CH t, 或 t x 其中 CL,t和CH,t:总摩尔浓度。 yt , xt :总摩尔分数。 m:分配系数。 H相 则 由于溶质浓度较低,m为常数 浓度较高 y = mx —— Henry型平衡关系 生化分离工程 第四章 第四章 | 1 2 m x y m x —— Langmuir型平衡关系,m1,m2为常数。 青·COOH(CLA) 有机溶剂(L) -- -----A- -- -- --- -- -- -- -- -- -- -- --- --- -- --- --- -- 青·COOH 青·COO-+H+ CHA CA- 青霉素游离酸存在两种平衡: 生化分离工程 第四章 第四章 | 青霉素游离酸存在两种平衡: 两相间的分配平衡 水中的电离平衡 , LA LA HA HA A C C A m C CC [ ][ ] [ ] H K COOH 青COO- 青 只有两相中的游离酸分子才符合分配定律 L 0 H r c r c L L H H A α α L H C A C , , L t H t C m C 浓度 活度之比 浓度之比 总摩尔浓度之比 定义式 Nerst分配常数A 分配常数A 分配系数m 0 0 比较Nerst分配常数A0 o,分配常数A和分配系数 m的区别? 生化分离工程 第四章 第四章 | ★:分配常数是分配系数的特例。 分子形态可不同 两相中分子形态相 同 分子形态 应用 全部浓度范围内 稀溶液 稀溶液 2-2-5 多组分萃取 料液中存在A.B两种组分,A.B在两相中分配不同 分离因素β / / LA HA A LB HB B CC A CC A β 生化分离工程 第四章 第四章 | 类似于蒸馏里的相对挥发度α β越大,分离效果越好,β=1,没有分离 萃取剂对溶质A和B分离能力的大小
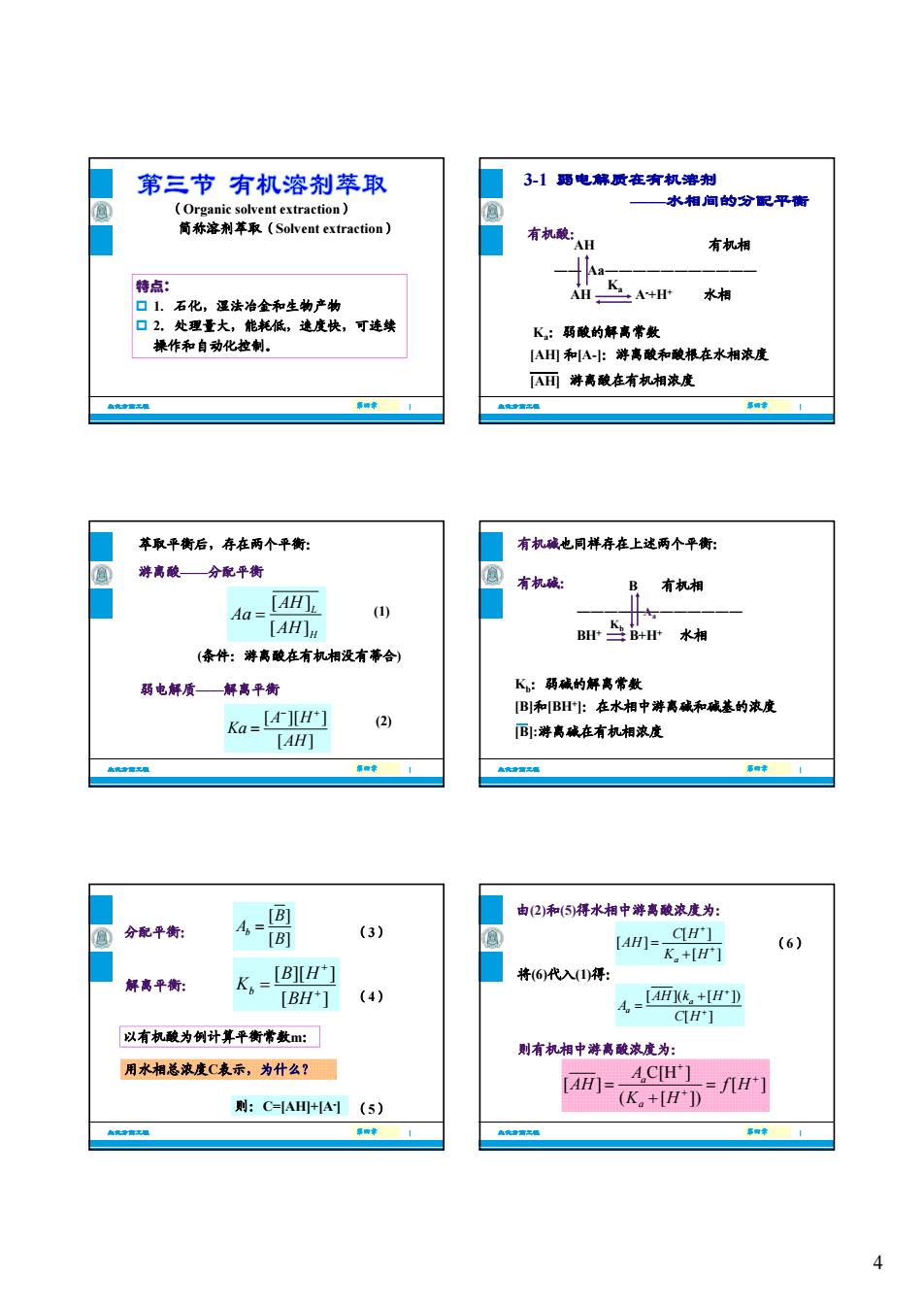
第三节有机溶剂萃取 3-1用电解质在有机塘荆 水相间的分配平衡 有机政A 有机湘 特点: KA+水相 口2处理量 K:药酸的解高常数 操作和自动化拉制。 A田和A:游离酸和被根在水相浓度 A而游离酸在有机相浓度 苹取平衡后,存在两个平衡: 有机碱也同样存在上递两个平衡: 游高酸—分配平街 B有机湘 Aa-气An 「AHI1. ) B上B+r水相 (条件:游高酸在有机湘没有蒂合) 弱电解质—解离平衡 Ko-] [B吲和BF上在水湘中游离碱遂的滚废 B:游离碱在有机相浓度 AF 由2)和(5得水相中游离酸浓度为: 分配平衡: (3) 【4H]-K。+F CIH'1 (6) 解离平衡: K.-[B) 将6代入山得: [BH+](4) 以有机酸为例计算平衡常数m: 则有机湘中游离酸度为: 用水相总浓度C表示,为什么?☐ AH)= AC门 则:C-AH用+HA(5) (K。+H) =几H
4 特点: 简称溶剂萃取(Solvent extraction) (Organic solvent extraction) 生化分离工程 第四章 第四章 | 特点: 1. 石化,湿法冶金和生物产物 2.处理量大,能耗低,速度快,可连续 操作和自动化控制。 3-1 弱电解质在有机溶剂 ——水相间的分配平衡 有机酸:AH 有机相 ―― Aa――――――――――― AH A H+ 水相 Ka 生化分离工程 第四章 第四章 | Ka:弱酸的解离常数 [AH] 和[A-]:游离酸和酸根在水相浓度 游离酸在有机相浓度 AH A- +H+ 水相 a [AH] 萃取平衡后,存在两个平衡: 游离酸——分配平衡 [ ] [ ] L H AH Aa AH (条件:游离酸在有机相没有蒂合) (1) 生化分离工程 第四章 第四章 | (条件:游离酸在有机相没有蒂合) 弱电解质——解离平衡 [ ][ ] [ ] A H Ka AH (2) 有机碱也同样存在上述两个平衡: 有机碱: B 有机相 ―――――――――――― BH+ B+H+ 水相 Kb Aa 生化分离工程 第四章 第四章 | Kb:弱碱的解离常数 [B]和[BH+]:在水相中游离碱和碱基的浓度 [B]:游离碱在有机相浓度 分配平衡: 解离平衡: [ ] [ ] b B A B [ ][ ] [ ] b B H K BH (3) (4) 生化分离工程 第四章 第四章 | 用水相总浓度C表示,为什么? 以有机酸为例计算平衡常数m: 则:C=[AH]+[A- ] (5) 由(2)和(5)得水相中游离酸浓度为: [ ] [ ] [ ] a C H AH K H 将(6)代入(1)得: [ ]( [ ]) [ ] a a AH k H A C H (6) 生化分离工程 第四章 第四章 | C H[ ] 则有机相中游离酸浓度为: + C[H ] [ ] [] ( [ ]) a a A AH fH K H

则游离酸的分配系数: 则游离碱的分配系数m为: ®品p =x+阿p 两边取对数: 四会 周理可得有机湘中游离碱的浓度为: @会气小-成-p 作业:推导公式↑ 3-2化苹取平衡 K CHOO台RCHCOO+H 氯遂收 -ur]0) A () 桌基酿解离平衡 K,和K,为解离常数 AA,和A表示偶板高子,阳离于和朋离于型基酸 积 (1) 几。阴高学变热菜取村 (r)(o 三辛基甲候(记作 则可推导出: K.-IFIcT 【AI[R'Cr] m,=Km+,W工 (6) K:KK2 基酿表观☆配系 m,=R C=[A]+[A]+[A C表观分配系数 3
5 则游离酸的分配系数m: 两边取对数: [ ] [ ] ( ) ( [ ]) a a a AH A H m f pH C KH log[ 1] a a A pH pK pKa=-logKa 生化分离工程 第四章 第四章 | g[ ] a a p p m p a= g a 同理可得有机相中游离碱的浓度为: CKb [] [ ] ( [ ]) b b A B fH K H [ ] b b b b KH A K m ( ) [ ] b b b b K m A f pH K H 则游离碱的分配系数mb为: 生化分离工程 第四章 第四章 | log( 1) b b b A pK pH m 作业:推导公式 3-2 化学萃取平衡 氨基酸 萃取剂:季铵盐类(氯化三辛基甲铵) 磷酸酯类(二(2-乙基己基)磷酸) 氨基酸解离平衡 生化分离工程 第四章 第四章 | 1 3 3 ( )() K RCHOOH RCHCOO H NH NH A A 1 [ ][ ] [ ] A H K A (1) (2) 2 [ ][ ] [ ] A H K A K1和K2为解离常数 ( ) ( ) 3 2 2 A A NH NH RCHOO RCHCOO H K (A) (A- ) 生化分离工程 第四章 第四章 | 采用阴离子型萃取剂,氯化三辛基甲铵(记作 R+Cl- ),萃取阴离子氨基酸 A,A+,和A- 表示偶极离子,阳离子和阴离子型氨基酸 1. 阴离子交换萃取剂 [ ][ ] [ ][ ] Kecl ecl R Cl A R A Cl R A Cl K A R Cl (3) 氨基酸表观分配系数 [ ] A A R A m C (4) 生化分离工程 第四章 第四章 | [ ][ ][] CA A A A [ ] [ ] cl R Cl m Cl Cl (5) - 表观分配系数 则可推导出: 2 1 2 12 [ ][ ] (1 ) A ecl cl H H m Km K KK 阴离子氨基酸的离子交换反应需高于其等电点的 pH范围内进行,故[A+]≈0 (6) 生化分离工程 第四章 第四章 | p 范围内进行,故[ ] 上式简化为: ( ) [ ] 2 2 f pH K H K mA Keclmcl
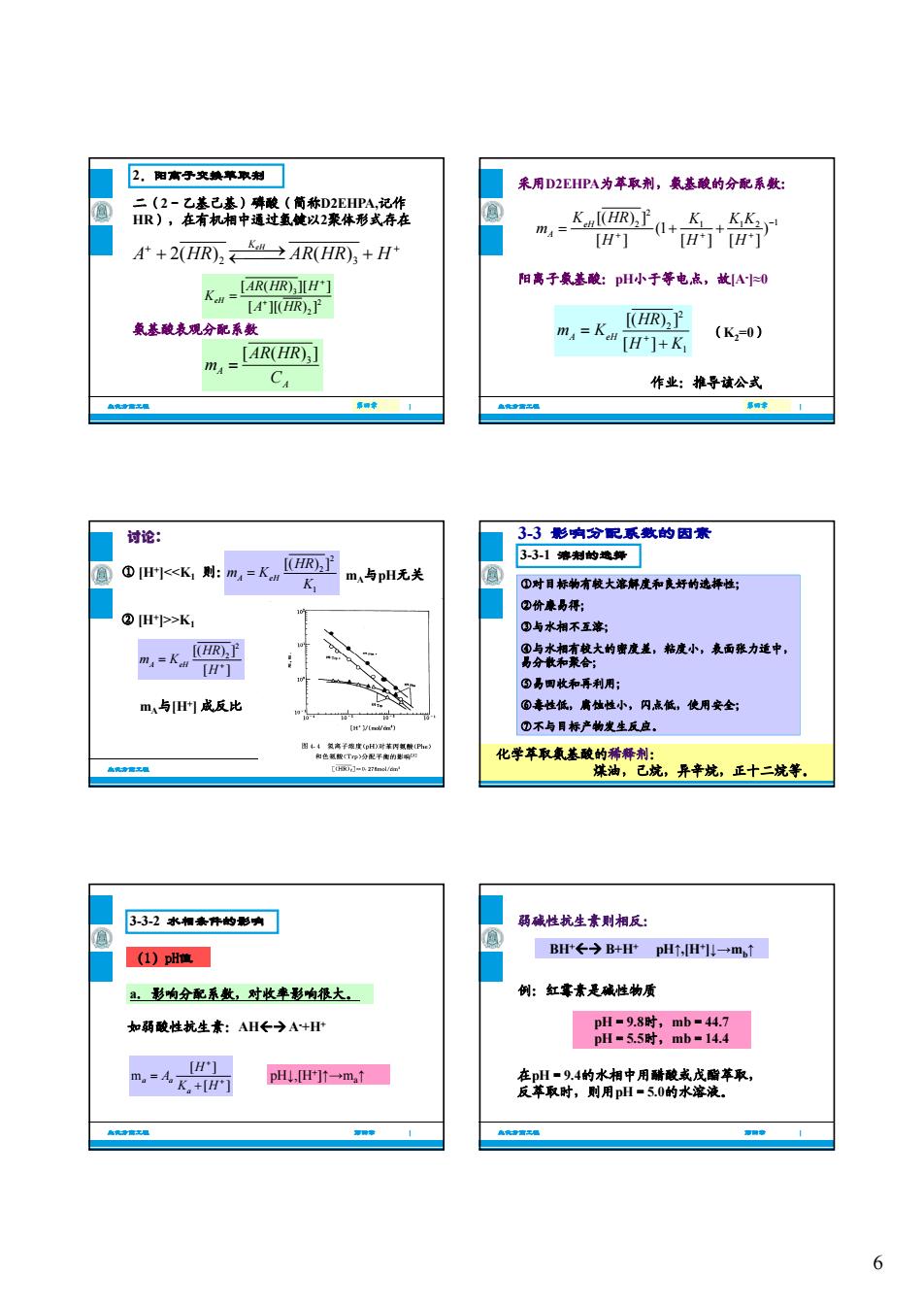
2,阳高子文热苹取刺门 采用D2EHPA为本取荆,基酸的分配系数 品只:森提智 +2(HR)5AR(HR)+H 阳离子象基酸:pH小于等电点,故IA0 差酸表观分配系 m =LAR(HR)] 火- (K,=0) C 作业:推导该公式 讨论: 3-3影响分配系敷的因素 331薄村的装舞门 m,与pH无关 ①对用标有大解度和好的择性 ④H>K, 0与水南 m,与成反比 闪点低,使用安全 332水相素件的影有] 码碱性抗生素则相反: )度 B←今B+HPp,一→m, 出影物分起系数,对收率影响很大 例:红年素是成性物质 如隔酸性抗生素:AH←→A+H 人圆 p4t→m,1 变翠的水和中用精来瘦本取 6
6 二(2-乙基己基)磷酸(简称D2EHPA,记作 HR),在有机相中通过氢键以2聚体形式存在 2.阳离子交换萃取剂 2 3 2( ) ( ) KeH A HR AR HR H 3 [ ( ) ][ ] AR HR H K 生化分离工程 第四章 第四章 | 3 2 2 [ ( ) ][ ] [ ][( ) ] KeH A HR 氨基酸表观分配系数 3 [ ( )] A A AR HR m C 采用D2EHPA为萃取剂,氨基酸的分配系数: 2 2 1 12 1 [( ) ] (1 ) [ ] [ ][ ] eH A K HR K KK m H HH 阳离子氨基酸:pH小于等电点,故[A- ]≈0 生化分离工程 第四章 第四章 | 2 2 1 [( ) ] [ ] A eH HR m K H K (K2=0) 作业:推导该公式 ① [H+]>K1 讨论: 2 2 [( ) ] HR 生化分离工程 第四章 第四章 | 2 [( ) ] [ ] A eH HR m K H mA与[H+] 成反比 3-3 影响分配系数的因素 3-3-1 溶剂的选择 ①对目标物有较大溶解度和良好的选择性; ②价廉易得; ③与水相不互溶; ④与水相有较大的密度差,粘度小,表面张力适中, 生化分离工程 第四章 | ④与水相有较大的密度差,粘度小,表面张力适中, 易分散和聚合; ⑤易回收和再利用; ⑥毒性低,腐蚀性小,闪点低,使用安全; ⑦不与目标产物发生反应。 化学萃取氨基酸的稀释剂: 煤油,己烷,异辛烷,正十二烷等。 a.影响分配系数,对收率影响很大。 3-3-2 水相条件的影响 (1)pH值 生化分离工程 第四章 | 如弱酸性抗生素:AH A- +H+ [ ] m [ ] a a a H A K H pH↓,[H+]↑→ma↑ BH+ B+H+ pH↑,[H+]↓→mb↑ 弱碱性抗生素则相反: 例:红霉素是碱性物质 = 时, = 生化分离工程 第四章 | 在pH=9.4的水相中用醋酸或戊酯萃取, 反萃取时,则用pH=5.0的水溶液。 pH=9.8时,mb=44.7 pH=5.5时,mb=14.4
山p对选择性的影验 ②)集成 皮整黄在数路性时精业样袋型 一表在宝温或低江下进行 然转鞋运丁窗为平取,平 分系 p-9.0苹取 pH-3时,青车蜂酸只占青车素的4%. 。p=45反苹 。p山选择在使产物穗史的范围 010203040℃ 《③)线新 ()希海湘 不猪时诗发G降可座金 两种性远: 创: 8物来迷性果要:产技有软接来速狮位 聚实:入时有针的 包题: 线子 8铁绿 起进入荆中: 柠檬酸+降氧能类草取剂(如啡酸三丁酯(TB即)) 3-4乳化现豪 酸性条件 形成中性站合物 朵华的现装使结柔水金的浅 进入 有机湘(C,H,03TBP2,0) 两种去带: ●发酵液度液中夹带有机溶剂徽浦,造成发酵单位的 反应草取 津剂相中央带发味来横浦,岭以后的精制速成国幸 7
7 如酸性产物酸性条件下萃到有机相,碱性杂质则 成盐留在水相,而对酸性杂质,则应选择高pH。 b. pH对选择性的影响 例:青霉素,pH=2时,醋酸丁酯为萃取剂,萃 取液中青霉烯酸可达12.5%。 生化分离工程 第四章 | pH=3时,青霉烯酸只占青霉素的4%。 c.pH选择在使产物稳定的范围 一般在室温或低温下进行 (2) 温度分配系 数 pH=9.0萃取 生化分离工程 第四章 | 0 10 20 30 40 oC 数 m pH=4.5反萃 无机盐 如硫酸铵,NaCl等可降低产物和溶剂在 水相中的溶解度 (3) 盐析 提取VB12时,加入硫酸铵,有利于VB12的萃取; 例: 生化分离工程 第四章 | 提取VB12时,加入硫酸铵,有利于VB12的萃取; 提取青霉素,加入NaCl,对青霉素萃取有利。 ①盐析剂应适量,过多会使杂质一起进入溶剂中; ②盐析剂用量大时,考虑回收和再利用。 问题: ①产物水溶性较强,通常的有机溶剂中溶解度很小 ②产物水溶性不强,为了提高其收率和选择性 (4) 带溶剂 两种情况: 生化分离工程 第四章 | 带溶剂: 该物质能和欲提取的生物物质形成复合物,而易溶于 溶剂中,且此复合物在一定条件下又要容易分解。 柠檬酸+磷氧键类萃取剂(如磷酸三丁酯(TBP)) 酸性条件 形成中性络合物 进入 生化分离工程 第四章 | 有机相(C6H8O7·3TBP·2H2O) 反应萃取 乳化:一种液体分散在另一种不相混合的液 体中的现象,使有机相和水相分层困难。 3-4 乳化现象 生化分离工程 第四章 | 发酵液废液中夹带有机溶剂微滴,造成发酵单位的 损失。 溶剂相中夹带发酵液微滴,给以后的精制造成困难 两种夹带:

乳浊液的形式: 乳浊液的威坏: 回染清会数在热半:陵务然色农贸囊乳注淡 1.过海和离心分散打碎乳化液清 国上和热,,可保货天政还林 形成的愿因: 5这中加入选埃湘使化液 离死元对物质一表西活性州的春在,这种物质将 袁面活性荆: -端具有泰水基团(知-C00a,-S0,Na,- 电西,NOH,HC高价高子(aP半) 心”请精柔国(经)县能牌低界西张力的物质 科法:如CaC03吸附水,不吸附油。 第四节萃取方式和理论收得率的计第 4-1单概草取 羊取只包一个流哈和一个分离 根据液液率取设备分 单板本取 蝶量合某取是 计算萃取操作的理论收得率: :+,-+y 柔甜经 h盆您含绕 布中 日L-2/ain) 已如: 同时 HxF LyF =H'y/m+L'y m L.v 则上或得 Hx:Lyr Hx Ly (即草取平衡后苹取相与苹余湘中滤质量之比) 所以 y-月x,- 一苹取过程的操作线 8
8 乳浊液的形式: 油滴分散在水中,称为水包油型或o/w型乳浊液; 水滴分散在油中,成为油包水型或w/o型乳浊液 形成的原因: 有第三种物质——表面活性剂的存在,这种物质称 为乳化剂。 生化分离工程 第四章 | 一端具有亲水基团(如-COONa,-SO3Na,- N+(CH3)3Cl- 等); 一端具有亲油基团(烃链)且能降低界面张力的物质 为乳化剂。 表面活性剂: 1.过滤和离心分散——打碎乳化液滴 乳浊液的破坏: 3.稀释法:在乳浊液中,加入连续相,使乳化液 浓度降低而减轻乳化; 4.加电解质:离子型乳化剂加入电解质,中和其 2.加热,t↑,μ↓,可促使其破坏; 生化分离工程 第四章 | 电性而促使聚沉。 NaCl,NaOH,HCl及高价离子(Al3+等) 5.吸附法:如CaCO3吸附水,不吸附油。 缺点:耗费能量和物质 常用电解质: 根据液液萃取设备分类 混合-澄清式萃取器 塔式微分萃取器 错流萃取 逆流萃取 单级萃取 多级萃取 生化分离工程 第四章 第四章 | 45 假设: 1.萃取相和萃余相能很快达到平衡,即每个级都是理论级; 2.两相完全不互溶,且能完全分离。 计算萃取操作的理论收得率: 4-1 单级萃取 单级萃取只包括一个混合器和一个分离器 生化分离工程 第四章 第四章 | 46 xF yF x y-摩尔分数 H L-mol/min 或(mol/h) 物料衡算 得:HxF + LyF = Hx + Ly 注意单位 xF yF x y-摩尔浓度 (mol/dm3) H L-m3/min 或(m3) ① yF=0 (初始萃取相中溶质浓度一般为0) ② H,L 可认为是常数 ③ y=mx (萃取平衡时) 已知: 则上式得: HxF + LyF = Hx + Ly 生化分离工程 第四章 第四章 | 47 所以 (x x) L H y F ——萃取过程的操作线 H L m Ly E H x (即萃取平衡后萃取相与萃余相中溶质量之比) E m x y F 1 同时: 萃取因子 HxF + LyF =H·y/m+ L·y 生化分离工程 第四章 第四章 | 48 (即萃取平衡后萃取相与萃余相中溶质量之比)

42多板错诚草取 E品 单级萃取存在的缺点: 2为达一定的草取收率,草取剂用量大。 味不养州→瓷 1 移分,用强→小@ 多纸错取 各 21楼: y0,则 x,= .每一根摔质分配均站平衡,带合线做染爪, 则:y,= “本本 Ll.....-L. 则,第饭物科衡其: L yo 依此奏推: HX-1+L'Yo=H'X+L'y, H.x X=(HE ∑L L1 H.x E=(mL/m=170/82)=2.07 萃取后的有款相浓度? y=[mxa/(1+E)1=(170×6.8)/1+2.07)=377ma/iter 臭国醇的取分率 1-0=E1+=2.071+2.07)=067 9
9 H L m E m相平衡曲线的斜率 H/L操作线斜率 H x E H x 1 1 用φ表示萃余率,则 生化分离工程 第四章 第四章 | 49 H xF 1 E 萃取分率,即理论收得率 E E 1 1 1. 萃取效率低, 2. 为达一定的萃取收率,萃取剂用量大。 4-2 多级错流萃取 单级萃取存在的缺点: 生化分离工程 第四章 第四章 | 50 多级错流萃取:将多个混合-澄清器单元串联来, 各个混合器中分别通入新鲜萃取剂。 a. 每一级溶质分配均达平衡,符合线性关系, 则:yi = mxi b. 每一级的萃取剂流量均相等 L1=L2=……=Ln c 萃取剂中溶质浓度:y =0 4-2-1 假设: 生化分离工程 第四章 第四章 | 51 c. 萃取剂中溶质浓度:y0=0 H·xi-1+L·y0=H·xi +L·yi 则,第i级物料衡算: L, y0 L, yi H, xi-1 H, xi E x i i x 1 1 2 1 2 (1 ) 1 E x x F E x y0=0, 则: E x E x x F 1 1 0 1 生化分离工程 第四章 第四章 | 52 (1 E) 依此类推: n F E x n x (1 ) n y L L y y n i i n i i n i i i n 1 1 1 萃余相的溶质分率: n E F n H x H x (1 ) 1 1 1 n 生化分离工程 第四章 第四章 | 53 萃取分率: 1 1 1 1 n n E n E 1 例:类固醇萃取。类固醇水溶液浓度为 6.8 mg/liter , 用二氯甲烷萃取。已知类固醇的平衡常数m为 170, 水与萃取剂的用量比为82. 问:萃取后的有机相浓度? 类固醇的萃取分率? E = (mL/H) = (170/82) = 2.07 解:萃取因子E 生化分离工程 第四章 第四章 | 54 E (mL/H) (170/82) 2.07 y =[mxF/(1+E)]=(170×6.8)/(1+2.07)=377mg/liter 萃取后的有机相浓度? 类固醇的萃取分率 1-φ=E/(1+E)=2.07/(1+2.07)=0.67

422苹取平衡不合规关系 图解过程: 平衡线方: 作人 (. y.=f(x) 各感操作战方程: 讨论 日美被针的位皮餐作成件情 图解法: 草余分率: 树论: 日装: 0+Ey 草取分乘: 5或二n中 授绕经梁香含修特系,成气取的 查图会更为便利 萃余分平: 1 武 10+E) 4-3参级逆流菜取 推出 1p>1-p 克气:将事个演音一业清想单完卓地分则率左古 两墙的视合器中纯编通入料液和单取液。使料 液和苹取液些速蜂新,即构成多板逆速米取。 》苹取液平均浓皮粮有。 10
10 逐级计算法(自学) 图解法(掌握) 平衡线方程: f( ) 4-2-2 萃取平衡不符合线性关系 生化分离工程 第四章 第四章 | 55 1 0 x x y L H y i i i i 各级操作线方程: yi =f(xi ) 1) 直角坐标上绘出平衡线 2) 第一级操作线的初始点A(x1,y0)以-H/L1为斜率, 交平衡线于B(x1,y1) 3) 从B点作垂直线交直线y=y0于C(x1,y0)点 4) 过C点以-H/L2为斜率作操作线,交于D点(x2,y2) 5) 依次Q(xn ,yn), xn﹤x*→生产指标为止 6) 重复做操作线的次数即为所需的级数 图解过程: 生化分离工程 第四章 第四章 | 56 6) 重复做操作线的次数即为所需的级数 A 若每级L1=L2=…=Ln,则操作线斜率相等 B 类似于蒸馏吸收做梯级 讨论: 萃余分率: n E 1 1 萃取分率: 图解法: n (1 E) 1 1 生化分离工程 第四章 第四章 | 57 n E 1 ( ) 1 E=4,n=1则=20% E=2,n=2则=11% E=4,n=2则=4% 查图会更为便利 萃取因子E↑, ↓,萃取效果↑; 讨论: E不变,萃取级数n↑, ↓; L H/L为操作线斜率 H m E m为相平衡斜率 如果错流萃取不符合线性关系,或各级萃取的 生化分离工程 第四章 第四章 | 58 如果错流萃取不符合线性关系,或各级萃取的 萃取剂流量不同,则E不同 萃余分率φ: n i Ei 1 1 1 ' 1-φn>1-φn’ 可推出: 生化分离工程 第四章 第四章 | 59 萃取平衡符合线性关系,各级萃取剂流量之和为 常数,各级萃取剂流量相等时萃取率最大。 4-3 多级逆流萃取 定义: 将多个混合-澄清器单元串连,分别在左右 的合中续 料 萃 料 生化分离工程 第四章 第四章 | 60 只在最后一级中加入萃取剂,萃取剂耗量较少; 萃取液平均浓度较高。 与错流萃取的区别: 两端的混合器中连续通入料液和萃取液,使料 液和萃取液逆流接触,即构成多级逆流萃取