
第1章化学键与分子结构 一.键能,键长,偶极矩 二.电子效应和空间效应 三.分子轨道理论 四.芳香性和休克尔规则
第1章 化学键与分子结构 二. 电子效应和空间效应 三. 分子轨道理论 一. 键能, 键长, 偶极矩 四. 芳香性和休克尔规则

教学目的和要求 ■1、幸握电子效应(诱导、共轭、超共轭) 的基本概念(定义、方向、强弱、传导) ■2、幸握电子效应,场效应和空间效应对性 能的影响, 3、熟悉分子轨道理论的基本概念和初步应 ■ 用。 ■4、掌握芳香性、同芳香性和反芳香性的基本概 念,能运用休克尔规则判断环状化合物的芳香性, 课时安排:4h
教学目的和要求 ▪ 1、掌握电子效应(诱导、共轭、超共轭) 的基本概念(定义、方向、强弱、传导). ▪ 2、掌握电子效应,场效应和空间效应对性 能的影响. ▪ 3、熟悉分子轨道理论的基本概念和初步应 用。 ▪ 4、掌握芳香性、同芳香性和反芳香性的基本概 念, 能运用休克尔规则判断环状化合物的芳香性. 课时安排:4h

一.键长,键能,偶极矩 键能:是指在气态下,将结合两个原子的共价键断裂成原子时所吸收的能量。 A-B- A+B 键长:形成共价键的两个原子的原子核之间,保持一定的距离,这个距离称为键长。 偶极矩(共价键极性大小):μ=ed单位D(德拜) 偶极矩为电荷与正、负电荷距离的乘积。偶极矩的方向是正电荷指向负电荷,用“+→”表示 分子的偶极矩等于它所含键的偶极矩矢量总和。 例如: CH3 H=0.43D u=3.93D H3C -NO2 O2N —NO H=4.39D =OD NO 净NO2 NO
一. 键长,键能,偶极矩 键能:是指在气态下,将结合两个原子的共价键断裂成原子时所吸收的能量。 A—B A+B 键长:形成共价键的两个原子的原子核之间,保持一定的距离,这个距离称为键长。 偶极矩(共价键极性大小):μ=e·d 单位D(德拜) 偶极矩为电荷e与正、负电荷距离的乘积。偶极矩的方向是正电荷指向负电荷,用“+→”表示。 分子的偶极矩等于它所含键的偶极矩矢量总和。 例如:

二.电子效应和空间效应 诱导效应 (,π) 电子效应 共轭效应 (π-π,p-π) 超共轭效应 取代基效 (c-元,-p) 应 场效 应 空间传递 空间效 (立体效应) 应 电子效应(Electronic effect): 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响
二. 电子效应和空间效应 电子效应(Electronic effect): 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响. 取代基效 应 电子效应 场效 应 空间效 应 诱导效应 共轭效应 超共轭效应 (立体效应) (σ, π) ( π-π, p-π) (σ- π,σ- p) 空间传递

(一).诱导效应(Inductive effect) i 因某一原子或原子团的电负 8.( 性不同所引起的极性效应,通过化 学键传递到分子的其它部分,这种 作用称为诱导效应 结构特征:单、双、叁键 传递方式:0、π键 传递强度:与距离相关。距离越大,强度越弱。 诱导效应的相对强度: 取 取代基 中心原子 决 C-C-Z 电负性(Electronegativeties)
(一). 诱导效应 (Inductive effect) C C Cl δ δ δ C C Cl δ δ C C Cl δ δ 因某一原子或原子团的电负 性不同所引起的极性效应, 通过化 学键传递到分子的其它部分, 这种 作用称为诱导效应. 结构特征:单、双、叁键 传递方式:σ、π键 传递强度:与距离相关。距离越大,强度越弱。 诱导效应的相对强度: C C Z 取 决 中心原子 电负性 (Electronegativeties) 取代基

诱导效应(Ⅱ)分为I效应(吸电子基)和+效应(给电子基) -I效应一般规律: 1.同周期的原子:-CH3Cl>Br>I 电负性: 4.03.02.82.5 3.相同的原子:不饱和度越大,-I效应越强 -C=CR>-CH-CHR 4.带正电荷的取代基的-I强:-:NR3>NO2>-NR2 +I效应一般规律:带负电荷的取代基的+I强
诱导效应( I )分为 -I 效应(吸电子基)和+ I效应(给电子基). -I 效应一般规律: 1. 同周期的原子: -CH3 Cl > Br > I 电负性: 4.0 3.0 2.8 2.5 3. 相同的原子: 不饱和度越大,-I 效应越强 C CR > CH CHR 4. 带正电荷的取代基的-I 强: +I 效应一般规律: 带负电荷的取代基的+ I 强. -NR3 > -NO2 > -NR2 -I:
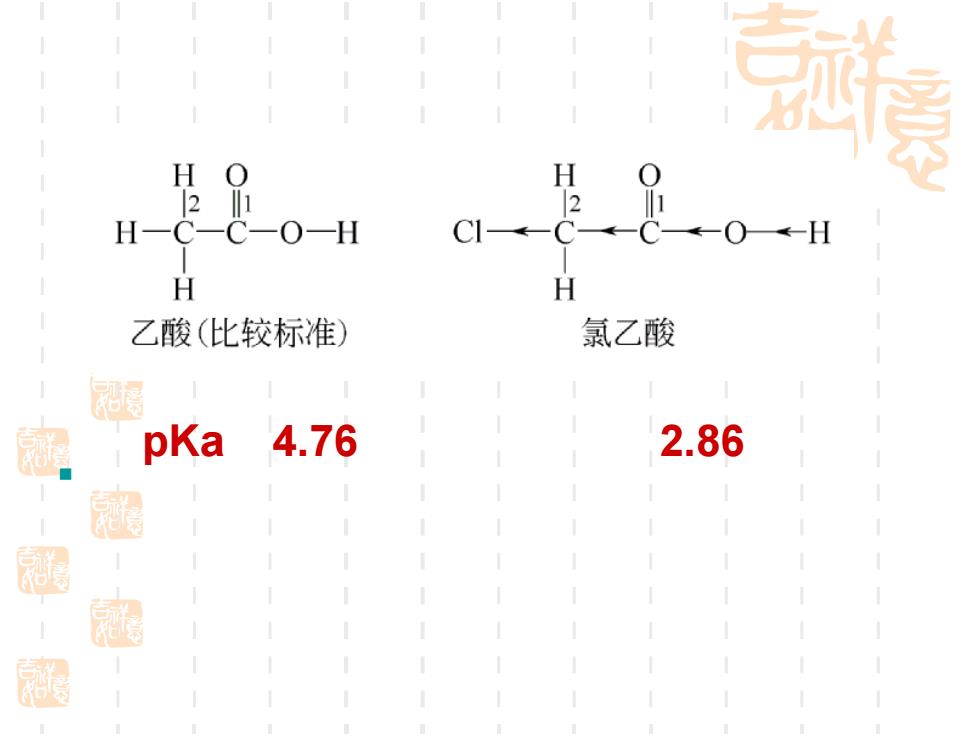
孤美 H O 21 H H 乙酸(比较标准) 氯乙酸 家 pKa 4.76 2.86 起 庭
▪ pKa 4.76 2.86
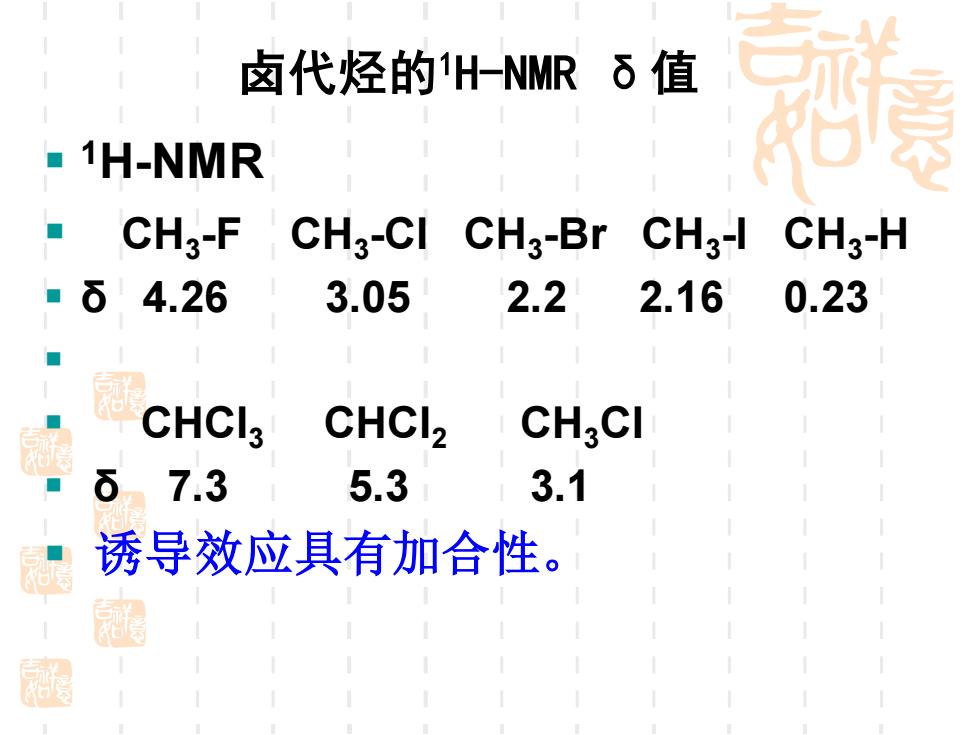
卤代烃的H-NMRδ值 -1H-NMR CHg-F CH3-CI CH3-Br CH3-1 CH3-H 6 4.26 3.05 2.2 2.16 0.23 CHCI3 CHCI2 CHgCI δ7.3 5.3 3.1 诱导效应具有加合性
▪ 1H-NMR ▪ CH3 -F CH3 -Cl CH3 -Br CH3 -I CH3 -H ▪ δ 4.26 3.05 2.2 2.16 0.23 ▪ ▪ CHCl3 CHCl2 CH3Cl ▪ δ 7.3 5.3 3.1 ▪ 诱导效应具有加合性。 卤代烃的1H-NMR δ值

a b CH3CH2Br 嬴 6 4 3 2 化学位移
6 5 4 3 0 吸收强度 化学位移 2 1 CH3 CH2 Br a b a b

诱导效应对反应性能的影响 1、对反应方向的影响: Cl3C-HC=CH2 +HBr->Cl3C-H2C-CH2Br 反马氏加成 又如:+N(CH3)3具有强烈的-效应,是一很强的间 位定位基。 2、对反应速率的影响 。如亲核加成反应活性: CI C-CHO >CI2CHCHO>CICH2CHO>CH3CHO ·又如RX发生SN反应的活性次序为:RI>RBr>RCI ·后者是动态诱导(极化)的结果
诱导效应对反应性能的影响 ▪ 1、对反应方向的影响: ▪ ▪ ▪ 又如:+N(CH3 )3具有强烈的-I效应,是一很强的间 位定位基。 ▪ 2、对反应速率的影响 ▪ 如亲核加成反应活性: ▪ Cl3C-CHO >Cl2CHCHO> ClCH2CHO> CH3CHO ▪ 又如RX发生SN反应的活性次序为:RI>RBr>RCl ▪ 后者是动态诱导(极化)的结果。 ▪ HC CH2 + HBr Cl 3 C H2 C CH2 Br 反马氏加成 Cl 3 C