
运城学院应用化学系 有机化学实验课件 (乙酸乙酯的制备及表征) 主讲人:弓巧娟 有机化学
运城学院应用化学系 有机化学实验课件 (乙酸乙酯的制备及表征) 主讲人: 弓巧娟

乙己酸乙酯的制备及表征 一、实验目的 1、了解从有机酸合成酯的一般原理及方法; 2、掌握蒸馏、分液漏斗的使用等操作
乙酸乙酯的制备及表征 一、实验目的 1、了解从有机酸合成酯的一般原理及方法; 2、掌握蒸馏、分液漏斗的使用等操作

二、实验原理 CH;COOH CHCHOH-CH;COOCHCH+H2o
二、实验原理 CH3 COOH + CH3 CH2 OH CH3 COOCH2 CH3 + H2 O H +
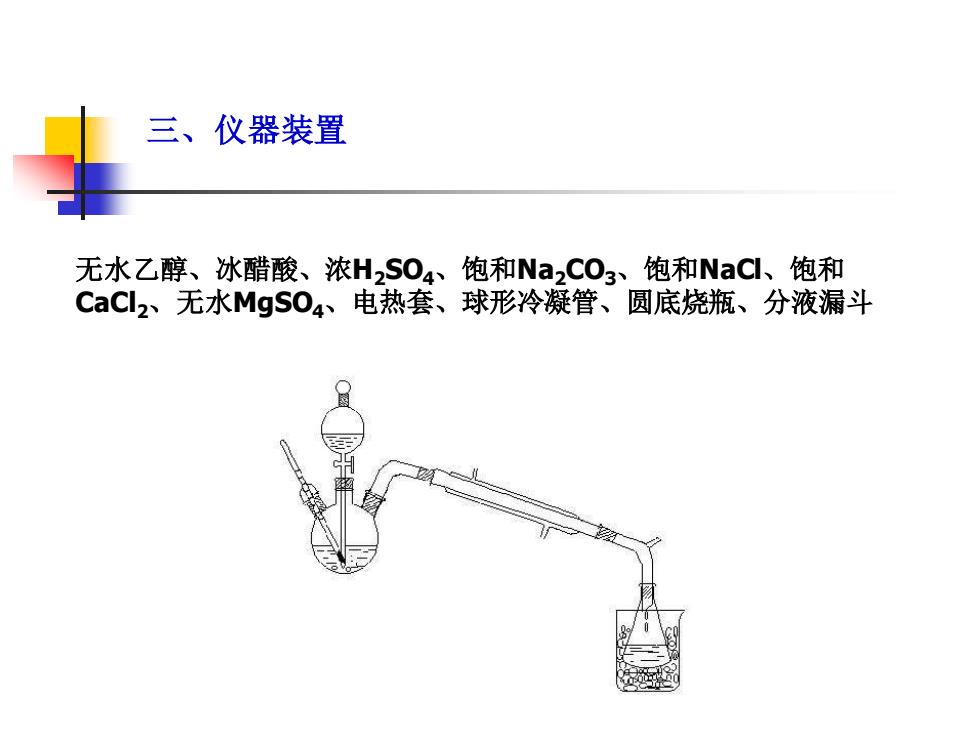
三、仪器装置 无水乙醇、冰醋酸、浓H2S04、饱和Na2C03、饱和NaC、饱和 CaCl2、无水MgS04、电热套、球形冷凝管、圆底烧瓶、分液漏斗
三、仪器装置 无水乙醇、冰醋酸、浓H2SO4、饱和Na2CO3、饱和NaCl、饱和 CaCl2、无水MgSO4、电热套、球形冷凝管、圆底烧瓶、分液漏斗

四、实验步骤 ① 在50ml圆底烧瓶中加入9.5ml(0.2mol)无水乙醇和6ml (0.1mol)冰醋酸,再小心加入2.5ml浓H2S04,混匀后, 加入沸石,装上冷凝管。 ② 小心加热反应瓶,缓慢回流1/2h,冷却反应物,将回流改成 蒸馏装置,接受瓶用冷水冷却,蒸出生成的乙酸乙酯,直到 镏出液约为反应物总体积的1/2为止。 ③ 在镏出液中慢慢加入饱和Na2CO3,振荡,至不再有C02气体 产生为止。 ④将混合液转入分液漏斗,分去水溶液,有机层用5m饱和 Nacl洗涤,再用5 mlCaCl2洗涤,最后用水洗涤一次,分去 下层液体。 ⑤ 有机层倒入干燥三角烧瓶中,用无水MgSO,干燥。 ⑥ 蒸馏10%H2S04、收集72-780C馏分。 ⑦ 测折光率,计算产率
四、实验步骤 ① 在50ml圆底烧瓶中加入9.5ml(0.2mol)无水乙醇和6ml (0.1mol)冰醋酸,再小心加入2.5ml浓H2SO4,混匀后, 加入沸石,装上冷凝管。 ② 小心加热反应瓶,缓慢回流1/2h,冷却反应物,将回流改成 蒸馏装置,接受瓶用冷水冷却,蒸出生成的乙酸乙酯,直到 镏出液约为反应物总体积的1/2为止。 ③ 在镏出液中慢慢加入饱和Na2CO3,振荡,至不再有CO2气体 产生为止。 ④ 将混合液转入分液漏斗,分去水溶液,有机层用5ml饱和 NaCl洗涤,再用5mlCaCl2洗涤,最后用水洗涤一次,分去 下层液体。 ⑤ 有机层倒入干燥三角烧瓶中,用无水MgSO4干燥。 ⑥ 蒸馏10%H2SO4、收集72-780 ℃馏分。 ⑦ 测折光率,计算产率

五、注意事项 1、控制反应温度在120一125℃,控制浓疏酸滴加速度。 2、洗涤时注意放气,有机层用饱和NaCI洗涤后,尽量将 水相分干净。 3、干燥后的粗产品进行蒸馏、收集65一71℃馏分
1、控制反应温度在120—125℃,控制浓硫酸滴加速度。 2、洗涤时注意放气,有机层用饱和NaCl洗涤后,尽量将 水相分干净。 3、干燥后的粗产品进行蒸馏、收集65—71℃馏分。 五、注意事项

六、问题讨论 1、酯化反应有什么特点?在实验中如何创造条件促使酯化反应尽 量向生成物方向进行? 2、本实验若采用醋酸过量的做法是否合适?为什么? 3、蒸出的粗乙酸乙酯中主要有哪些杂质?如何除去?
1、酯化反应有什么特点?在实验中如何创造条件促使酯化反应尽 量向生成物方向进行? 2、本实验若采用醋酸过量的做法是否合适?为什么? 3、蒸出的粗乙酸乙酯中主要有哪些杂质?如何除去? 六、问题讨论