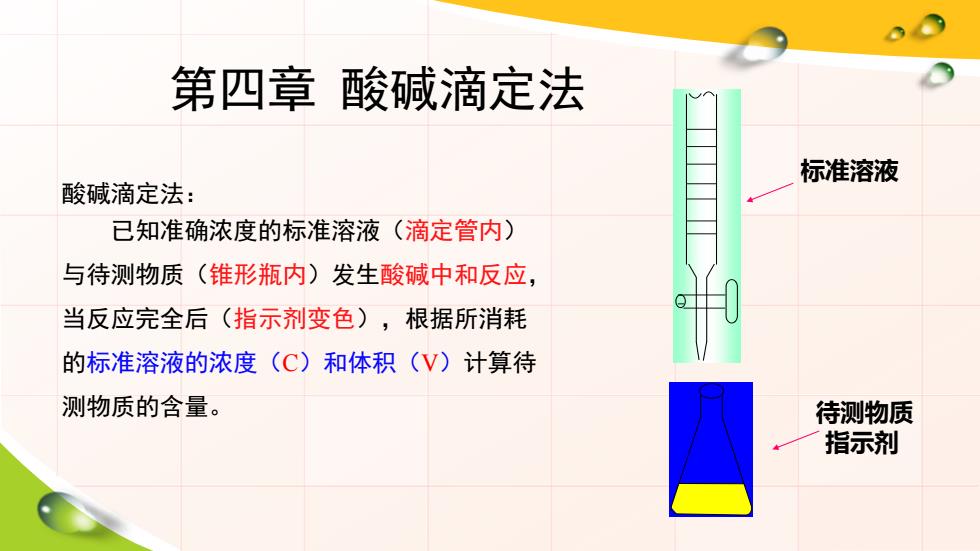
第四章酸碱滴定法 标准溶液 酸碱滴定法: 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生酸碱中和反应, 当反应完全后(指示剂变色),根据所消耗 的标准溶液的浓度(C)和体积(V)计算待 测物质的含量。 待测物质 指示剂
第四章 酸碱滴定法 酸碱滴定法: 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生酸碱中和反应, 当反应完全后(指示剂变色),根据所消耗 的标准溶液的浓度(C)和体积(V)计算待 测物质的含量。 标准溶液 待测物质 指示剂
最为理2大率 CHANGSHA UNIVERSITY OF SCIENCE&TECHNOLOGY 酸碱平衡理论 本章重点 各类酸碱溶液的pH值 计算方法 3 各类酸碱滴定曲线和 指示剂的选择
酸碱平衡理论 各类酸碱溶液的pH 值 计算方法 各类酸碱滴定曲线和 指示剂的选择 123 本章重点

第四章1 酸碱滴定法 第一节水溶液中的酸碱平衡 问题一:二 水:酸?碱?中性? 。0 水:p7.0 为什么?
第四章 酸碱滴定法 第一节 水溶液中的酸碱平衡 水:pH=7.0 为什么? 问题一: 水:酸?碱?中性?
酸碱的定义 酸一凡能给出质子的物质 质子理论 HSO4、HCI、HAc 碱一凡能接受质子的物质 NaOH、Na2C03 浪为理3大舞 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY
酸碱的定义 酸——凡能给出质子的物质 H2SO4 、HCl、HAc 碱——凡能接受质子的物质 NaOH、Na2CO3 ➢质子理论
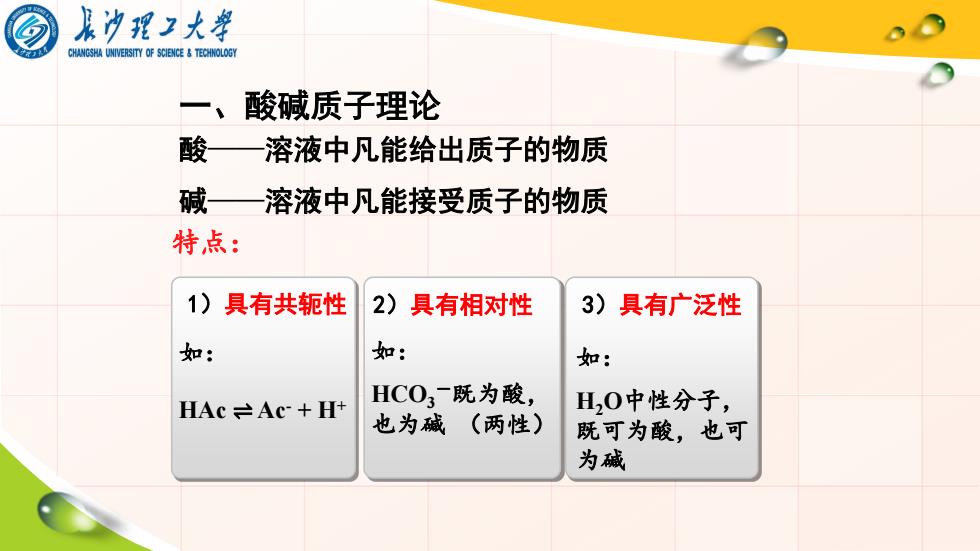
最为理工大 CHANGSHA UNIVERSITY OF SCIENCE&TECHNOLOGY 一、酸碱质子理论 酸—溶液中凡能给出质子的物质 碱—溶液中凡能接受质子的物质 特点: 1)具有共轭性 2)具有相对性 3)具有广泛性 如: 如: 如: HC03一既为酸, HAc≠Ac+Ht H,0中性分子, 也为碱(两性) 既可为酸,也可 为碱
一、酸碱质子理论 1)具有共轭性 2)具有相对性 3)具有广泛性 特点: 如: HAc ⇌ Ac- + H+ 如: HCO3 -既为酸, 也为碱 (两性) 如: H2O中性分子, 既可为酸,也可 为碱 酸——溶液中凡能给出质子的物质 碱——溶液中凡能接受质子的物质

娘冲理2大学 酸 去 质子+碱 共轭酸碱对 HA 土 H +A HA-A H2CO3 H HCO3 H2CO3-HCO: HCO3 C032 HC03-C032 NHA :H+ NHs NH4"-NHs 共轭酸碱对的质子得失反应 酸碱半反应
共轭酸碱对的质子得失反应—— 酸碱半反应

酸碱反应的实质 (靠两对共轭酸碱对相互作用来实现) 酸碱半反应:酸给出质子和碱接受质子的反应 HAc(酸1)+H,0(碱2)二H,0+(酸2)+Ac(碱1) 1、醋酸在 水中的离解 共轭酸碱对 NH3(碱1)+H,0(酸2)二OH(碱2)+NH,(酸1) 2、氨在水 中的离解 共轭酸碱对
酸碱反应的实质 (靠两对共轭酸碱对相互作用来实现) 酸碱半反应: 酸给出质子和碱接受质子的反应 2、氨在水 中的离解 HAc(酸1)+ H2O(碱2) H3O+(酸2)+ Ac-(碱1) NH3(碱1)+H2O(酸2) OH-(碱2) + NH4 +(酸1) 共轭酸碱对 共轭酸碱对 1、 醋酸在 水中的离解

从为理夕大孕 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY 溶剂的质子自递反应及质子自递常数K 水溶液中: H20+H20兰H30*+0H- K=K,=H]·H]=1.0×104 水的离子积 pH+pOH 14 011 因此:pH=7.0
溶剂的质子自递反应及质子自递常数 Kw 水溶液中: H2O + H2O H3O+ + OH – 水的离子积 pH + pOH = 14 因此:pH=7.0

k冲理3大举 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY 总结: 酸—溶液中凡能给出质子的物质 碱—溶液中凡能接受质子的物质 酸碱反应的实质: (靠两对共轭酸碱对相互作用来实现) H20+H20 KmH,0+0H- pH+pOH-pKw
总结: H2O + H2O KW H3O+ + OH – 酸碱反应的实质: (靠两对共轭酸碱对相互作用来实现) 酸——溶液中凡能给出质子的物质 碱——溶液中凡能接受质子的物质 pH+pOH=pKw

问题二: 强酸:H2SO4、HCl 弱酸:HAc 强碱:NaOH 弱碱:Na2C03 请问:如何判断酸碱的强弱?
请问:如何判断酸碱的强弱? 问题二: 强酸:H2SO4 、HCl 弱酸:HAc 强碱:NaOH 弱碱:Na2CO3