
第三章 滴定分析法 概论 李丹 k沙理)大 CHANGSHA UNNVERSITY OF SCENCE TECHNOLDGY
L/O/G/O 第三章 滴定分析法 概论 李 丹
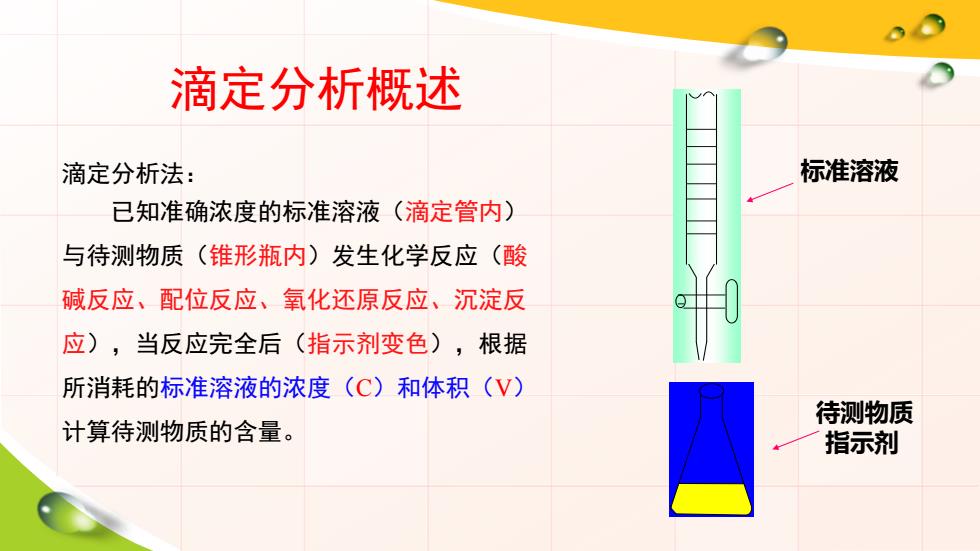
滴定分析概述 滴定分析法: 标准溶液 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生化学反应(酸 碱反应、配位反应、氧化还原反应、沉淀反 应),当反应完全后(指示剂变色),根据 所消耗的标准溶液的浓度(C)和体积(V) 待测物质 计算待测物质的含量。 指示剂
滴定分析概述 滴定分析法: 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生化学反应(酸 碱反应、配位反应、氧化还原反应、沉淀反 应),当反应完全后(指示剂变色),根据 所消耗的标准溶液的浓度(C)和体积(V) 计算待测物质的含量。 标准溶液 待测物质 指示剂
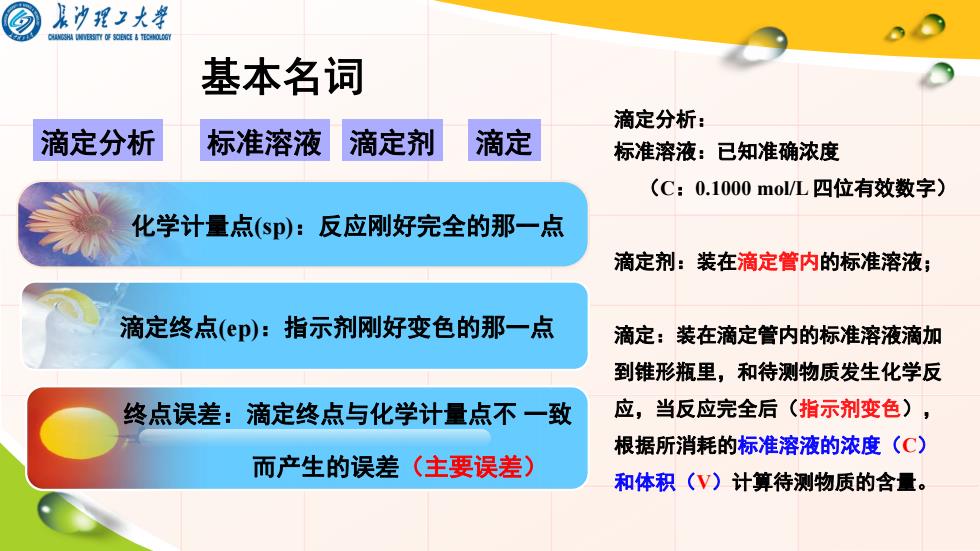
泉沙理)大举 基本名词 滴定分析: 滴定分析 标准溶液 滴定剂 滴定 标准溶液:已知准确浓度 (C:0.1000mol/L四位有效数字) 化学计量点(sp):反应刚好完全的那一点 滴定剂:装在滴定管内的标准溶液; 滴定终点(ep):指示剂刚好变色的那一点 滴定:装在滴定管内的标准溶液滴加 到锥形瓶里,和待测物质发生化学反 终点误差:滴定终点与化学计量点不一致 应,当反应完全后(指示剂变色), 根据所消耗的标准溶液的浓度(C) 而产生的误差(主要误差) 和体积(V)计算待测物质的含量
基本名词 化学计量点(sp):反应刚好完全的那一点 终点误差:滴定终点与化学计量点不 一致 而产生的误差(主要误差) 滴定分析 标准溶液 滴定剂 滴定 滴定终点(ep):指示剂刚好变色的那一点 滴定分析: 标准溶液:已知准确浓度 (C:0.1000 mol/L 四位有效数字) 滴定剂:装在滴定管内的标准溶液; 滴定:装在滴定管内的标准溶液滴加 到锥形瓶里,和待测物质发生化学反 应,当反应完全后(指示剂变色), 根据所消耗的标准溶液的浓度(C) 和体积(V)计算待测物质的含量
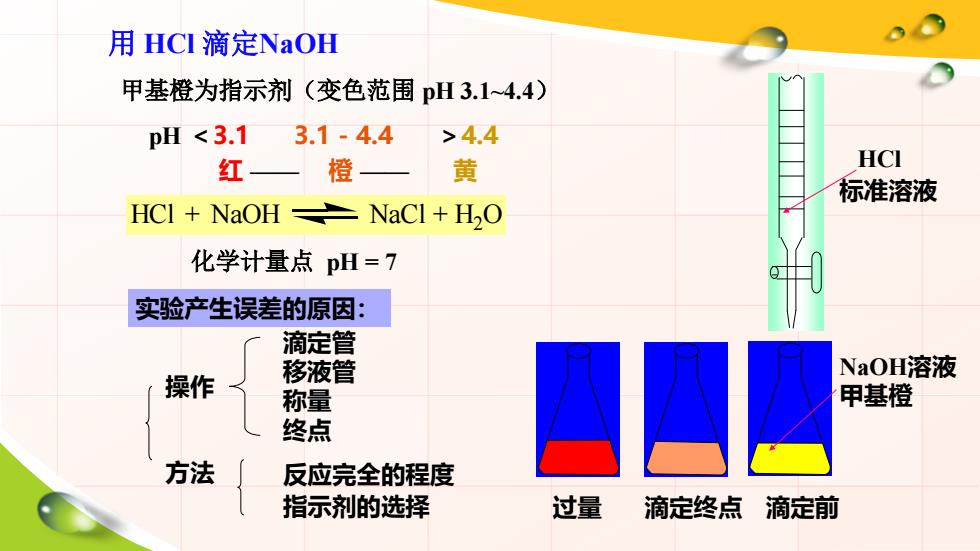
用HCI滴定NaOH 甲基橙为指示剂(变色范围pH3.14.4) pH4.4 红— 橙 黄 HCI 标准溶液 HCI NaOH NaCl H2O 化学计量点pH=7 实验产生误差的原因: 滴定管 操作 移液管 NaOH溶液 称量 甲基橙 终点 方法 反应完全的程度 指示剂的选择 过量 滴定终点 滴定前
用 HCl 滴定NaOH 甲基橙为指示剂(变色范围 pH 3.1~4.4) HCl + NaOH NaCl + H2 O 化学计量点 pH = 7 HCl 标准溶液 NaOH溶液 甲基橙 过量 滴定前 红 —— 橙 —— 黄 pH <3.1 3.1 - 4.4 >4.4 滴定终点 实验产生误差的原因: 操作 方法 滴定管 移液管 称量 终点 反应完全的程度 指示剂的选择

沙理工大举 滴定分析对化学反应的要求 (KMnO3,+ Na2S203)? (1)反应定量完成,反应完全,要求达99.9%以上 反应的平衡常数HAc=Ac+H中;平衡常数K, (2)有一定的化学计量关系。(化学反应方程式) 5C2042-+2Mn04+16H=10C02↑+2Mn2++8H,0 (3)反应速度快 (4)有比较简便的方法确定反应终点(合适的指示剂)
滴定分析对化学反应的要求 (1)反应定量完成,反应完全,要求达99.9%以上 反应的平衡常数 (2)有一定的化学计量关系。(化学反应方程式) (3)反应速度快 (4)有比较简便的方法确定反应终点(合适的指示剂) HAc ⇌ Ac- + H+;平衡常数 Ka 5C2O4 2-+2MnO4 ˉ +16H+ = 10CO2 ↑+2Mn2+ + 8H2O
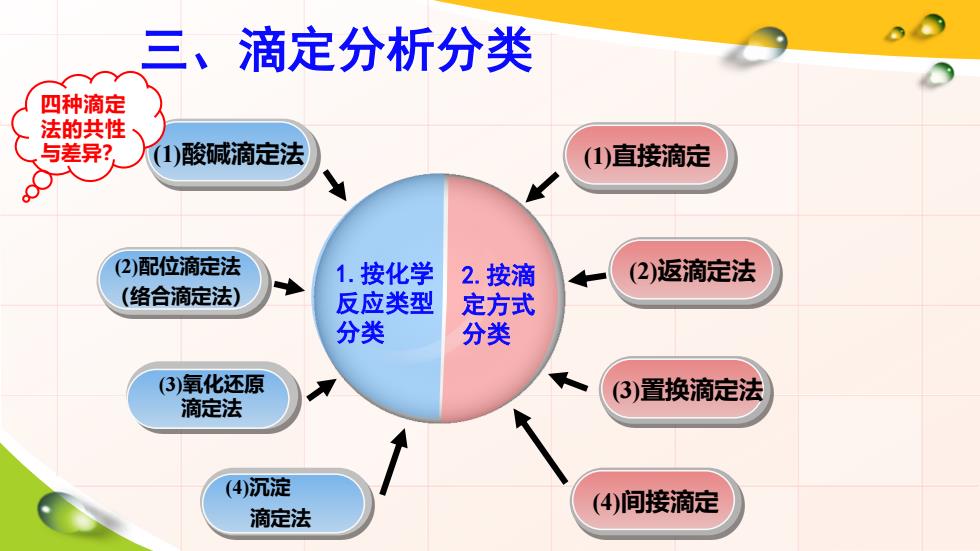
三、滴定分析分类 四种滴定 法的共性 与差异? (1酸减滴定法 (1)直接滴定 (2)配位滴定法 1.按化学 2.按滴 (2)返滴定法 (络合滴定法) 反应类型 定方式 分类 分类 (3)氧化还原 (3)置换滴定法 滴定法 (4)沉淀 (4)间接滴定 滴定法
三、滴定分析分类 1.按化学 反应类型 分类 2.按滴 定方式 分类 (1)酸碱滴定法 (1)直接滴定 (2)配位滴定法 (络合滴定法) (3)氧化还原 滴定法 (4)沉淀 滴定法 (2)返滴定法 (3)置换滴定法 (4)间接滴定 四种滴定 法的共性 与差异?

泉为理2大学 CHANGSHA UNNERSITY OF SCENCE TECHNOLOGY (1)直接滴定法 凡是满足滴定分析要求的反应,都可以采用直接滴定法。 标准溶液 直接滴定的物质 NaOH HCI:HAc EDTA Ca2+;Mg2+Zn2+ KMnO, C2042 AgNO3 CI-(摩尔法) 特点: 简便 快速 引入的误差较小 最冲理)大华 CAMGSA UNVERSITY OF SCENCE TECHNOLOG
凡是满足滴定分析要求的反应,都可以采用直接滴定法。 NaOH HCl;HAc EDTA Ca2+ ;Mg2+ ;Zn2+ KMnO4 C2O4 2- AgNO3 Cl- (摩尔法) 特点: 简便 快速 引入的误差较小 (1) 直接滴定法 标准溶液 直接滴定的物质

集沙理3大华 CHANGSHA UNNERSITY候SCE&TECHN核OG (2)返滴定法 (反应速度很慢) 一定量且过量 待测物 锥形瓶 的标准溶液 反应完成 再用另一种标准溶液滴定 前一种剩余的标准溶液 点 反应较慢(A+与EDTA的配位反应) A13+ + Y(标准溶液)午AIY+Y (待测物质)(一定量且过量)(V总) (过量) Zn2+(标准溶液)+Y ZnY (V) (过量) V总-V:A3+ 的量 最冲理大举 4 SHI LMREREITY OF楼LEs20
V总-V:Al3+ 的量 锥形瓶 一定量且过量 的标准溶液 反应完成 终 点 (2)返滴定法(反应速度很慢) 待测物 再用另一种标准溶液滴定 前一种剩余的标准溶液 反应较慢(Al3+与EDTA的配位反应) Al 3+ + Y (标准溶液 ) AlY + Y (待测物质) (一定量且过量) (V总) (过量) Zn 2+(标准溶液 )+ Y ZnY (V) (过量)

泉为理2大辛 CHANGSHA UNNERSITY OF SCENCE TECHNOLOGY (3) 置换滴定法(无定量关系) 待测物 → 锥形瓶 适当的试剂 置换反应 标准溶液 置换出一种被定量滴定的物质 滴定 终点 例如 Na2S203与K,Cr0,之间无计量关系 置换:Cr20,2-+61+14H与2Cr3++3L2+7H20 (过量K) 滴定: 2+2S2032与2I+S,062- (标准溶液) 最冲理)大华 AMGSHA UNVERSITY OF SCENCE TECHIOLOG
(3)置换滴定法(无定量关系) 待测物 锥形瓶 置换反应 置换出一种被定量滴定的物质 标准溶液 滴定 终点 Na2 S2O3与 K2Cr2O7之间无计量关系 置换: Cr2O7 2- + 6I ˉ+ 14H+ 2Cr3+ + 3I 2 + 7H2O (过量KI) 滴定: I 2 + 2S2O3 2 - 2I ˉ + S4O6 2 - (标准溶液) 例如 适当的试剂

最冲理)大孝 CHANGSHA UNNERSITY候sCE&TECHN核OGY (4)间接滴定法 不能与滴定剂直接反应的物质,可通过另外的化 学反应间接地进行滴定。 例如,用氧化还原法测定Ca+ Ca2++C,0,2=CaC204↓ CaC204+H2S04=CaS04+H2C204 5C2042+2Mn04+16H+=10C02↑+2Mn2++8H20 (标准溶液) 晨冲理大华 4 SHI LMREREITY OF:楼LEs2t
(4 ) 间接滴定法 不能与滴定剂直接反应的物质,可通过另外的化 学反应间接地进行滴定。 例如,用氧化还原法测定Ca²+ Ca²+ + C2O4 2ˉ = CaC2O4 ↓ 5C2O4 2-+2MnO4 ˉ +16H+ = 10CO2 ↑+2Mn2+ + 8H2O (标准溶液) CaC2O4 + H2 SO4 = CaSO4 + H2C2O4