
运城学院应用化学系 有机化学实验课件 (蒸馏、分馏及沸点的测定) 主讲人:弓巧娟 有机化
运城学院应用化学系 有机化学实验课件 (蒸馏、分馏及沸点的测定) 主讲人: 弓巧娟

菱馏、分馏及佛点的测定 一、实验目的: 1、了解蒸馏和测定沸点的意义; 2、理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏, 什么情况下用分馏。 3、熟练掌握蒸馏装置的安装和使用方法 4、掌握分馏柱的工作原理和常压下的简单分馏操作方法
蒸馏、分馏及沸点的测定 一、实验目的: 1、了解蒸馏和测定沸点的意义; 2、理解蒸馏和分馏的基本原理,应用范围,什么情况下用蒸馏, 什么情况下用分馏。 3、熟练掌握蒸馏装置的安装和使用方法 4、掌握分馏柱的工作原理和常压下的简单分馏操作方法
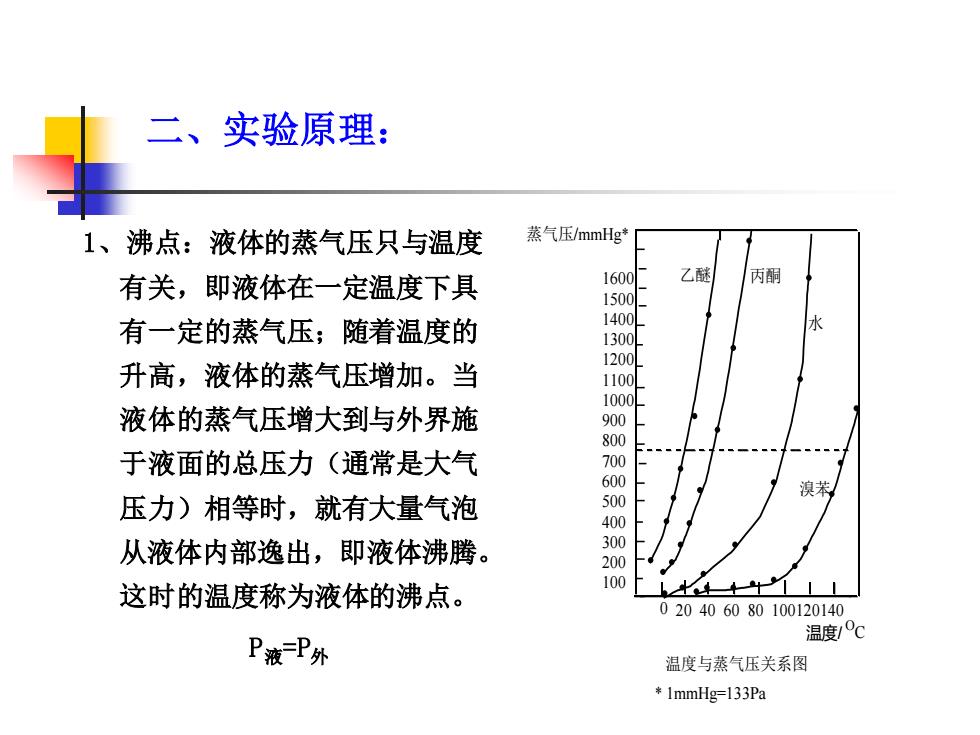
二、实验原理: 1、沸点:液体的蒸气压只与温度 蒸气压/mmHg* 有关,即液体在一定温度下具 1600 乙醚 丙酮 1500 有一定的蒸气压;随着温度的 1400 1300 1200 升高,液体的蒸气压增加。当 1100 1000 液体的蒸气压增大到与外界施 900 800 于液面的总压力(通常是大气 700 600 溴苯 压力)相等时,就有大量气泡 500 400 从液体内部逸出,即液体沸腾。 300 200 这时的温度称为液体的沸点。 100 020406080100120140 温度/c P液P外 温度与蒸气压关系图 1mmHg=133Pa
二、实验原理: 1、沸点:液体的蒸气压只与温度 有关,即液体在一定温度下具 有一定的蒸气压;随着温度的 升高,液体的蒸气压增加。当 液体的蒸气压增大到与外界施 于液面的总压力(通常是大气 压力)相等时,就有大量气泡 从液体内部逸出,即液体沸腾。 这时的温度称为液体的沸点。 P液=P外 0 20 40 60 80 100120140 1600 1500 1400 1300 1200 1100 1000 900 800 700 600 500 400 300 200 100 温度/ 蒸气压/mmHg* O C 温度与蒸气压关系图 * 1mmHg=133Pa 乙醚 丙酮 水 溴苯

通常所说的沸点是在0.1Mpa(即760 nmHg)压力下液体的沸腾温 度。例如水的沸点为100℃,即指大气压为760 nmHg时,水在 100℃时沸腾。在其它压力下的沸点应注明,如水的沸点可表 示为95℃/85.3kPa. 注意: 纯粹的液体有机化合物在一定的压力下具有一定的沸点。可初 步鉴定物质。但是具有固定沸点的液体不一定都是纯粹的化合 物,因为某些有机化合物常和其它组分形成二元或三元共沸混 合物,它们也有一定的沸点
通常所说的沸点是在0.1Mpa(即760mmHg)压力下液体的沸腾温 度。例如水的沸点为100oC,即指大气压为760mmHg时,水在 100oC时沸腾。在其它压力下的沸点应注明,如水的沸点可表 示为95oC/85.3kPa。 注意: 纯粹的液体有机化合物在一定的压力下具有一定的沸点。可初 步鉴定物质。但是具有固定沸点的液体不一定都是纯粹的化合 物,因为某些有机化合物常和其它组分形成二元或三元共沸混 合物,它们也有一定的沸点

2、蒸馏 蒸馏就是将液体化合物加热至沸腾变为蒸气,又将蒸气冷凝为液体 化合物这两个过程的联合操作过程。它是分离液体有机化合物最常 用的一种方法。 3、蒸馏的作用: 1)通过蒸馏可将易挥发的物质和不挥发的物质分开。 2)将沸点不同的液体化合物分开,但不同液体沸点必须相差30℃ 以上。 3)可测化合物的沸点
2、蒸馏 蒸馏就是将液体化合物加热至沸腾变为蒸气,又将蒸气冷凝为液体 化合物这两个过程的联合操作过程。它是分离液体有机化合物最常 用的一种方法。 3、蒸馏的作用: 1)通过蒸馏可将易挥发的物质和不挥发的物质分开。 2)将沸点不同的液体化合物分开,但不同液体沸点必须相差30℃ 以上。 3)可测化合物的沸点

4、分馏 应用分馏柱将几种沸点相近的混合物进行分离的方法称为分馏。 分馏是借助于分馏柱进行多次气化和冷凝,使一系列的蒸馏不需多次 重复,一次得以完成的蒸馏(分馏就是多次蒸馏), 在分馏柱内,当上升的蒸气与下降的冷凝液互凝相接触时,上升 的蒸气部分冷凝放出热量使下降的冷凝液部分气化,两者之间发生 了热量交换,其结果,上升蒸气中易挥发组分增加,而下降的冷凝 液中高沸点组分(难挥发组分)增加,如果继续多次,就等于进行 了多次的气液平衡,即达到了多次蒸馏的效果。这样靠近分馏柱顶 部易挥发物质的组分比率高,而在烧瓶里高沸点组分(难挥发组分) 的比率高。这样只要分馏柱足够高,就可将这种组分完全彻底分开。 工业上的精馏塔就相当于分馏柱
4、分馏 应用分馏柱将几种沸点相近的混合物进行分离的方法称为分馏。 分馏是借助于分馏柱进行多次气化和冷凝,使一系列的蒸馏不需多次 重复,一次得以完成的蒸馏(分馏就是多次蒸馏), 在分馏柱内,当上升的蒸气与下降的冷凝液互凝相接触时,上升 的蒸气部分冷凝放出热量使下降的冷凝液部分气化,两者之间发生 了热量交换,其结果,上升蒸气中易挥发组分增加,而下降的冷凝 液中高沸点组分(难挥发组分)增加,如果继续多次,就等于进行 了多次的气液平衡,即达到了多次蒸馏的效果。这样靠近分馏柱顶 部易挥发物质的组分比率高,而在烧瓶里高沸点组分(难挥发组分) 的比率高。这样只要分馏柱足够高,就可将这种组分完全彻底分开。 工业上的精馏塔就相当于分馏柱
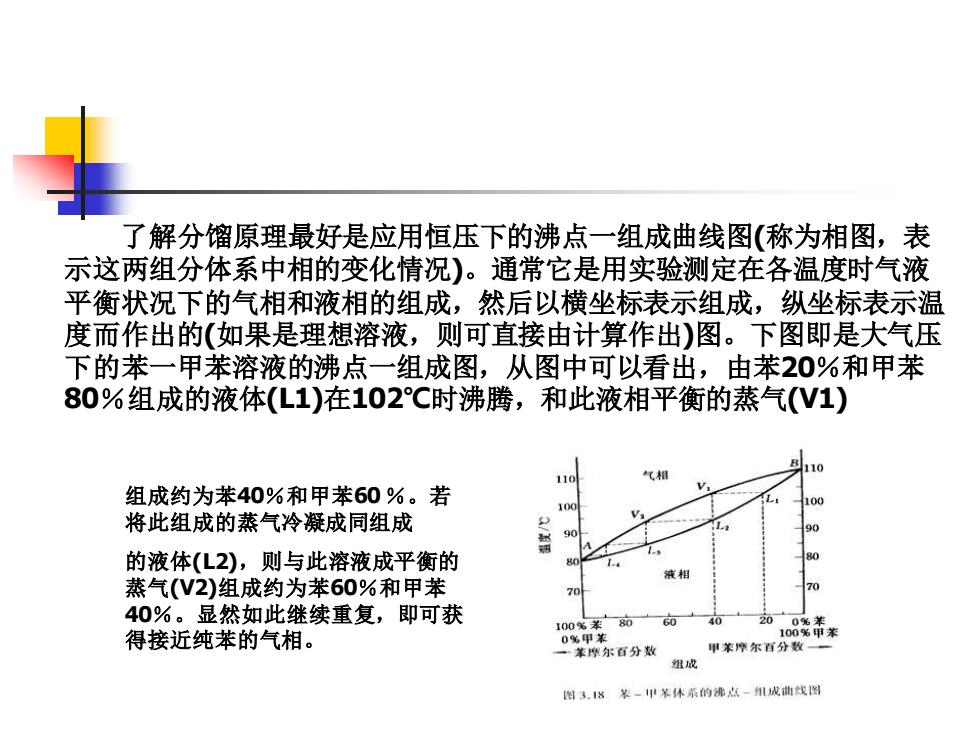
了解分馏原理最好是应用恒压下的沸点一组成曲线图(称为相图,表 示这两组分体系中相的变化情况)。通常它是用实验测定在各温度时气液 平衡状况下的气相和液相的组成,然后以横坐标表示组成,纵坐标表示温 度而作出的(如果是理想溶液,则可直接由计算作出)图。下图即是大气压 下的苯一甲苯溶液的沸点一组成图,从图中可以看出,由苯20%和甲苯 80%组成的液体(L1)在102℃时沸腾,和此液相平衡的蒸气(V1) 10 组成约为苯40%和甲苯60%。若 100 将此组成的蒸气冷凝成同组成 2 的液体(L2),则与此溶液成平衡的 液相 蒸气(V2)组成约为苯60%和甲苯 40%。显然如此继续重复,即可获 100%苯 80 60 40 20 00关 得接近纯苯的气相。 0%甲苯 100%甲苯 一苯摩尔石分数 甲养摩尔百分数 组成 图3.8装一甲苯体系的沸点-成曲线图
组成约为苯40%和甲苯60 %。若 将此组成的蒸气冷凝成同组成 的液体(L2),则与此溶液成平衡的 蒸气(V2)组成约为苯60%和甲苯 40%。显然如此继续重复,即可获 得接近纯苯的气相。 了解分馏原理最好是应用恒压下的沸点一组成曲线图(称为相图,表 示这两组分体系中相的变化情况)。通常它是用实验测定在各温度时气液 平衡状况下的气相和液相的组成,然后以横坐标表示组成,纵坐标表示温 度而作出的(如果是理想溶液,则可直接由计算作出)图。下图即是大气压 下的苯一甲苯溶液的沸点一组成图,从图中可以看出,由苯20%和甲苯 80%组成的液体(L1)在102℃时沸腾,和此液相平衡的蒸气(V1)

在分馏过程中,有时可能得到与单纯化合物相似的混合物。 它也具有固定的沸点和固定的组成。其气相和液相的组成也完全 相同,因此不能用分馏法进一步分离。这种混合物称为共沸混合 物(或恒沸混合物)。它的沸点(高于或低于其中的每一组分)称为 共沸点(或恒沸点)
在分馏过程中,有时可能得到与单纯化合物相似的混合物。 它也具有固定的沸点和固定的组成。其气相和液相的组成也完全 相同,因此不能用分馏法进一步分离。这种混合物称为共沸混合 物(或恒沸混合物)。它的沸点(高于或低于其中的每一组分)称为 共沸点(或恒沸点)

三、蒸馏仪器的选择与安装 1、仪器的选择 1)蒸馏瓶:一般为圆底烧瓶(蒸馏物液体的体积,一般不要超过蒸馏 瓶容积的2/3,也不要少于1/3。) 2)冷凝管:液体沸点小于130℃用直型冷凝管;大于130℃用直型冷 凝管 3)蒸馏头:普通蒸馏头;克氏蒸馏头(减压蒸馏用) 4)温度计:其量程不低于液体沸点 5)接液管:或称尾接管。(根据需要安装不同用途的尾接管,例如, 减压蒸馏需安装真空尾接管) 6)接受瓶:一般常压蒸馏用锥形瓶,减压蒸馏用圆底烧瓶。 5)、6)统称为接受器
三、蒸馏仪器的选择与安装 1、仪器的选择 1)蒸馏瓶:一般为圆底烧瓶(蒸馏物液体的体积,一般不要超过蒸馏 瓶容积的2/3,也不要少于1/3。) 2)冷凝管:液体沸点小于130 ℃用直型冷凝管;大于130 ℃用直型冷 凝管 3)蒸馏头:普通蒸馏头;克氏蒸馏头(减压蒸馏用) 4)温度计:其量程不低于液体沸点 5)接液管:或称尾接管。 (根据需要安装不同用途的尾接管,例如, 减压蒸馏需安装真空尾接管) 6)接受瓶:一般常压蒸馏用锥形瓶,减压蒸馏用圆底烧瓶。 5)、6)统称为接受器

2、蒸馏装置的安装 仪器安装顺序一般为:自下而上,从左到右。撤卸仪器与安装顺 序相反。 热源→蒸馏瓶(固定方法、离热源的距离,其轴心保持垂直)→蒸 馏头(其对称面与铁架平行)→冷凝管(若为直形冷凝管则应保证 上端出水口向上,与橡皮管相连至水池;下端进水口向下,通过橡 皮管与水龙头相连;才能保证套管内充满水)→接液管→接受瓶 (正式接受馏液的接受瓶应事先称重并做记录)→温度计(借助温 度计导管将温度计固定在蒸馏头的上口处,使温度计水银球的上限 与蒸馏头侧管的下限同处一水平线上)
2、蒸馏装置的安装 热源→蒸馏瓶(固定方法、离热源的距离,其轴心保持垂直)→蒸 馏头(其对称面与铁架平行)→冷凝管(若为直形冷凝管则应保证 上端出水口向上,与橡皮管相连至水池;下端进水口向下,通过橡 皮管与水龙头相连;才能保证套管内充满水)→接液管→接受瓶 (正式接受馏液的接受瓶应事先称重并做记录)→温度计(借助温 度计导管将温度计固定在蒸馏头的上口处,使温度计水银球的上限 与蒸馏头侧管的下限同处一水平线上)。 仪器安装顺序一般为:自下而上,从左到右。撤卸仪器与安装顺 序相反