正在加载图片...
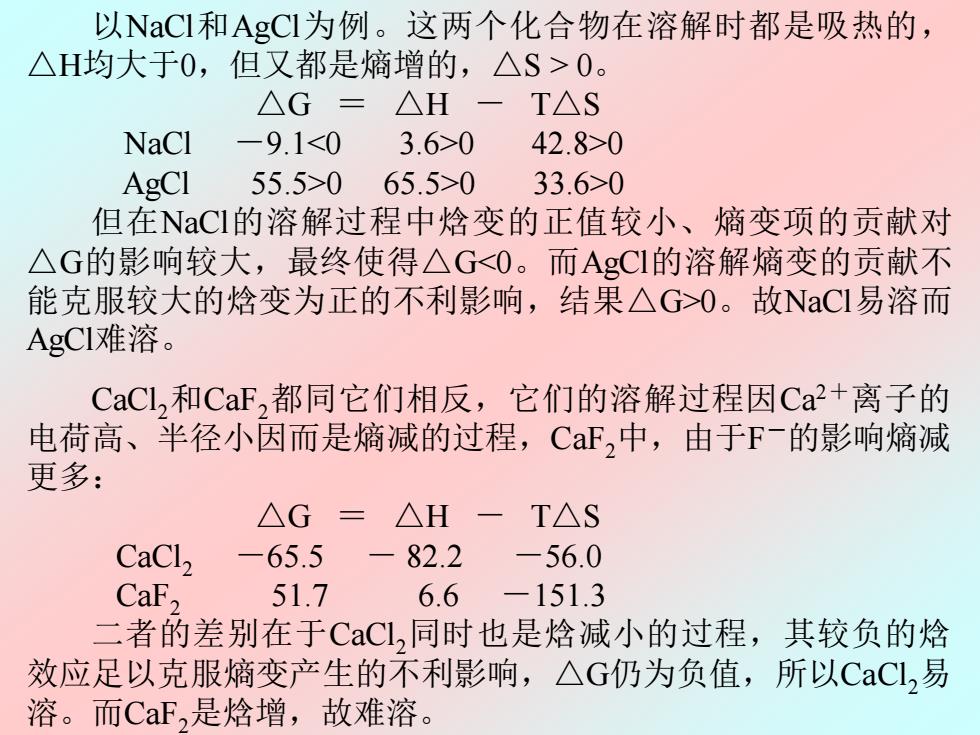
以NaCI和AgCI为例。这两个化合物在溶解时都是吸热的, △H均大于0,但又都是熵增的,△S>0。 △G=△H-T△S NaCl-9.1<03.6>0 42.8>0 AgCl 55.5>065.5>0 33.6>0 但在NaCI的溶解过程中焓变的正值较小、熵变项的贡献对 △G的影响较大,最终使得△G<0。而AgCI的溶解熵变的贡献不 能克服较大的焓变为正的不利影响,结果△G>0。故NaCI易溶而 AgCI难溶。 CaCl,和CaF,都同它们相反,它们的溶解过程因Ca+离子的 电荷高、半径小因而是熵减的过程,CF,中,由于F-的影响熵减 更多: △G=△H -T△S CaCl, -65.5 一 82.2 -56.0 CaF, 51.7 6.6 -151.3 二者的差别在于CaCl,同时也是焓减小的过程,其较负的焓 效应足以克服熵变产生的不利影响,△G仍为负值,所以CaCL,易 溶。而CaF,是焓增,故难溶。 以NaCl和AgCl为例。这两个化合物在溶解时都是吸热的, △H均大于0,但又都是熵增的,△S > 0。 △G = △H - T△S NaCl -9.1<0 3.6>0 42.8>0 AgCl 55.5>0 65.5>0 33.6>0 但在NaCl的溶解过程中焓变的正值较小、熵变项的贡献对 △G的影响较大,最终使得△G<0。而AgCl的溶解熵变的贡献不 能克服较大的焓变为正的不利影响,结果△G>0。故NaCl易溶而 AgCl难溶。 CaCl2和CaF2都同它们相反,它们的溶解过程因Ca2+离子的 电荷高、半径小因而是熵减的过程,CaF2中,由于F-的影响熵减 更多: △G = △H - T△S CaCl2 -65.5 - 82.2 -56.0 CaF2 51.7 6.6 -151.3 二者的差别在于CaCl2同时也是焓减小的过程,其较负的焓 效应足以克服熵变产生的不利影响,△G仍为负值,所以CaCl2易 溶。而CaF2是焓增,故难溶