正在加载图片...
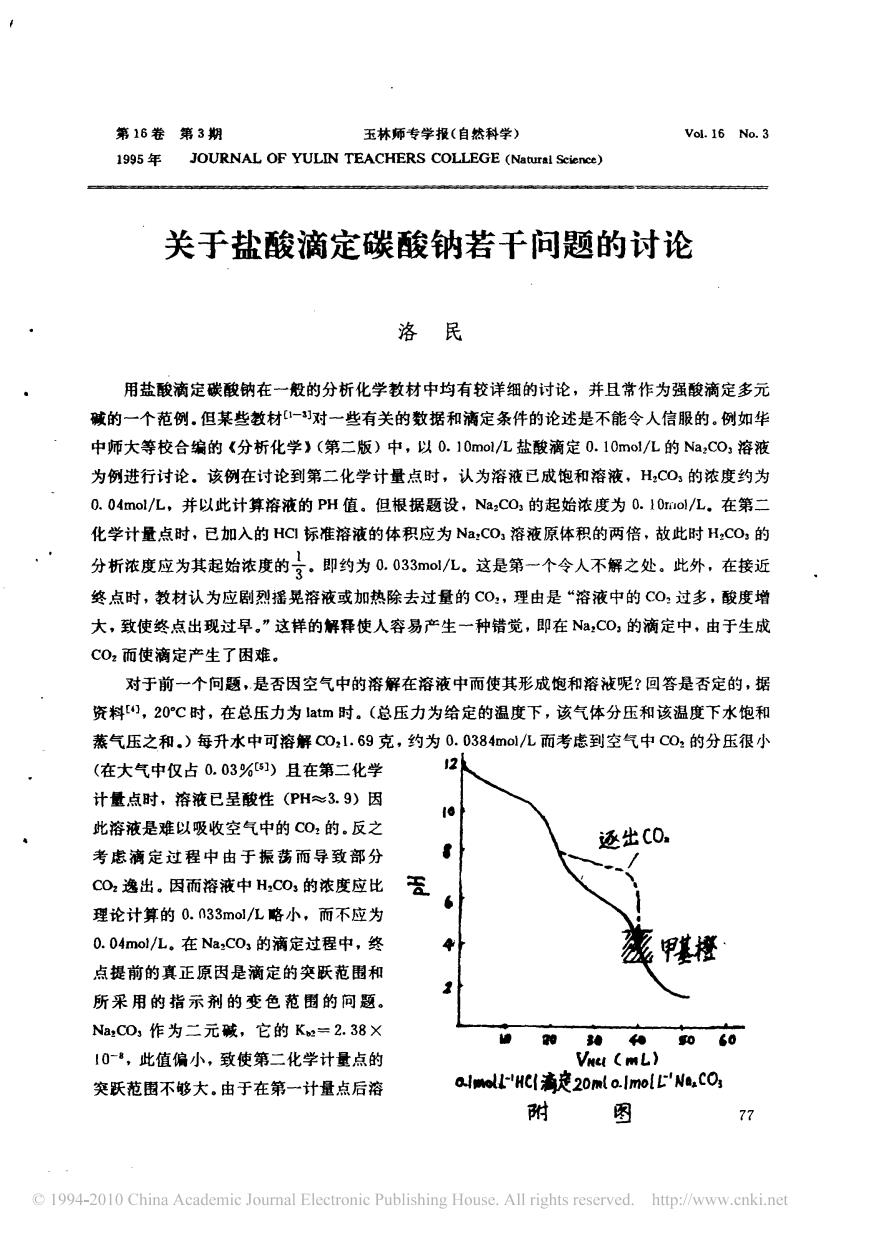
第16卷第3期 玉林师专学报(白然科学) Vol.16 No.3 1995年 JOURNAL OF YULIN TEACHERS COLLEGE () 关于盐酸滴定碳酸钠若干问题的讨论 洛民 用盐酸滴定碳酸钠在一般的分析化学教材中均有较详细的讨论,并且常作为强酸滴定多元 碱的一个范例.但某些教材对一些有关的数据和满定条件的论述是不能令人信服的.例如华 中师大等校合编的《分析化学)(第二版)中,以0.10mol/L盐酸滴定0.10mo/L的Na,C0,溶液 为例进行讨论。该例在讨论到第二化学计量点时,认为溶液已成饱和溶液,H,C0,的浓度约为 0.04mo/L,并以此计算溶液的PH值。但根据题设,Na,CO,的起始浓度为0.10rol/L.在第二 化学计量点时,已如入的HG标准溶液的体积应为Na,CO溶液原体积的两倍,故此时H,CO,的 分析浓度应为其起始浓度的了,即约为0.033ml/L,这是第一个令人不解之处。此外,在接近 终点时,教材认为应剧烈摇晃溶液或加热除去过量的C0,理由是“溶液中的C0过多,酸度增 大,致使终点出现过早,”这样的解释使人容易产生一种错觉,即在N,CO,的滴定中,由于生成 C0而使滴定产生了困难。 对于前一个向题,是香因空气中的溶解在溶液中而使其形成饱和溶被呢?回答是否定的,据 资料),20℃时,在总压力为atm时。(总压力为给定的温度下,该气体分压和该温度下水饱和 蒸气压之和.)每升水中可溶解00,1.69克,约为0.0384ol/L而考虑到空气中C0的分压很小 (在大气中仅占0.03%)且在第二化学 计量点时,溶液已呈酸性(PH≈3.9)因 e 此溶液是难以吸收空气中的C0的.反之 还出C0. 考虑滴定过程中由于振荡而导致部分 CO2逸出,因而溶液中H,C03的浓度应比 6 理论计算的0.n33mol/L略小,而不应为 0.04mol/L.在Na:C0,的滴定过程中,终 甲 点提前的真正原因是滴定的交跃范围和 所采用的指示剂的变色范围的问题 NaCD,作为二元碱,它的Ke=2.38X 060 10,此值偏小,致使第二化学计量点的 突跃范围不够大,由于在第一计量点后溶 arHC海ě20mla.ImoLL'W,cO 附 图 77 1994-2010 China Academic Joumal Electronie Publishing House.All rights reserved.http:/www.cnki.net第 16 卷 第 3 期 19 导5 年 J O U R N A L O F 玉林师专学报 ( 自然科学) V ol . 1 6 N o . 3 y U L 刀月 TE A CH E R S ( N 妞t t l r a l sc 沁n ( e ) 关于盐酸滴定碳酸钠若干问题的 讨论 洛 民 用盐酸滴定 碳酸钠 在一般的分析化 学教材中均有较详细的讨论 , 并且 常作 为强酸滴定多元 碱的一个 范例 。 但某些教材 [卜幻 对一些有关的 数据和 滴定条 件的论述是不能 令人信服的 。 例如 华 中师大等校 合编的 《分析化 学 》(第二 版) 中 , 以 0 . 1o m of /L 盐酸滴 定 0 . l o m ol / L 的 Na ZC o : 溶液 为 例进行 讨论 。 该例 在讨论 到第二 化学计量 点 时 , 认为溶液 已成 饱和溶 液 , H 刃0 3 的浓度约 为 0 . O4mo l/ L , 并以此计 算溶液的 P H 值 。 但根据题设 , Na 厂0 3 的起始浓度 为 0 . 1 00 01 /L 。 在第 二 化 学计量点时 , 已 加入的 H cl 标准溶液 的体积应为 N a 式0 : 溶液 原体积 的两 倍 , 故此时 H :C o : 的 分析浓度应为其起 始浓 度的冬 。 即约 为 。 . 。3 3m 。, / L 。 这是第一 个令人不 解之处 。 此外 , 在接 近 尹J F ’ 「 卜 ~ 一 z J ~ ~ 户“ 万 卜 ~ “ J 3 . 一 ‘ J 产J - - 一 一- - 一 尹 一 ~ ~ z 卜 ’ 、 / 、 ” ‘盯 ~ ~ “ 一“ / ‘ ’ 一~ ~ 终 点时 , 教材认 为 应剧烈摇 晃溶液或加 热除去过量的 C o : , 理 由是 “ 溶液中 的 C o : 过 多 , 酸度 增 大 , 致使 终点 出现过早 。 ” 这样的解释使人容 易 产生 一种错觉 , 即在 N a 厂o : 的滴定中 , 由于 生成 c o : 而 使滴定产生 了困难 。 对于前一个 问题 , 是否 因空气中的溶解在 溶液 中而 使其形成 饱和溶 液呢? 回答是否 定的 , 据 资料[41 , 2 0o c 时 , 在 总压力为 lat m 时 。 (总压 力 为给定的温度下 , 该气体分压 和该温度下水 饱和 蒸气压 之和 。 ) 每升水中可溶 解 co Z 1 . 69 克 , 约 为 0 . 0 3 8 4 m ol / L 而考虑到 空气 中 co : 的分 压很 小 (在 大气中仅 占 0 . 03 % [s1 ) 且在第二化学 计量点时 , 溶液已呈酸性 (PH 、3 . 9) 因 此溶液是难以 吸收空 气中的 co : 的 。 反之 考 虑滴 定 过 程 中 由 于 振 荡 而导 致 部分 C o , 逸出 。 因而溶 液中 H : C o : 的浓度应 比 理论计算的 0 . O3 m of / L 略小 , 而 不应 为 0. O4m ol / L . 在 N a 刃o : 的滴定过程中 , 终 点提前的 真正原 因是滴 定的 突跃范 围和 所采 用 的 指 示 剂 的 变 色 范 围 的 问 题 。 Na , C O : 作 为 二 元 碱 , 它 的 K 。: ~ 2 . 38 X 10 一 , 此值偏 小 , 致使第二 化学计量点 的 突跃 范 围不 够大 。 由于在第一计量点后 溶 还出CO. 、 t ‘ 令 J , _ / 、. 性橙 甘 湘 拍 和 和 ‘0 偏“ 〔用 L ) 川, 以上 . , c l浦建如, 。 , o £‘ ’“、c 仇 耐 图 : 7