正在加载图片...
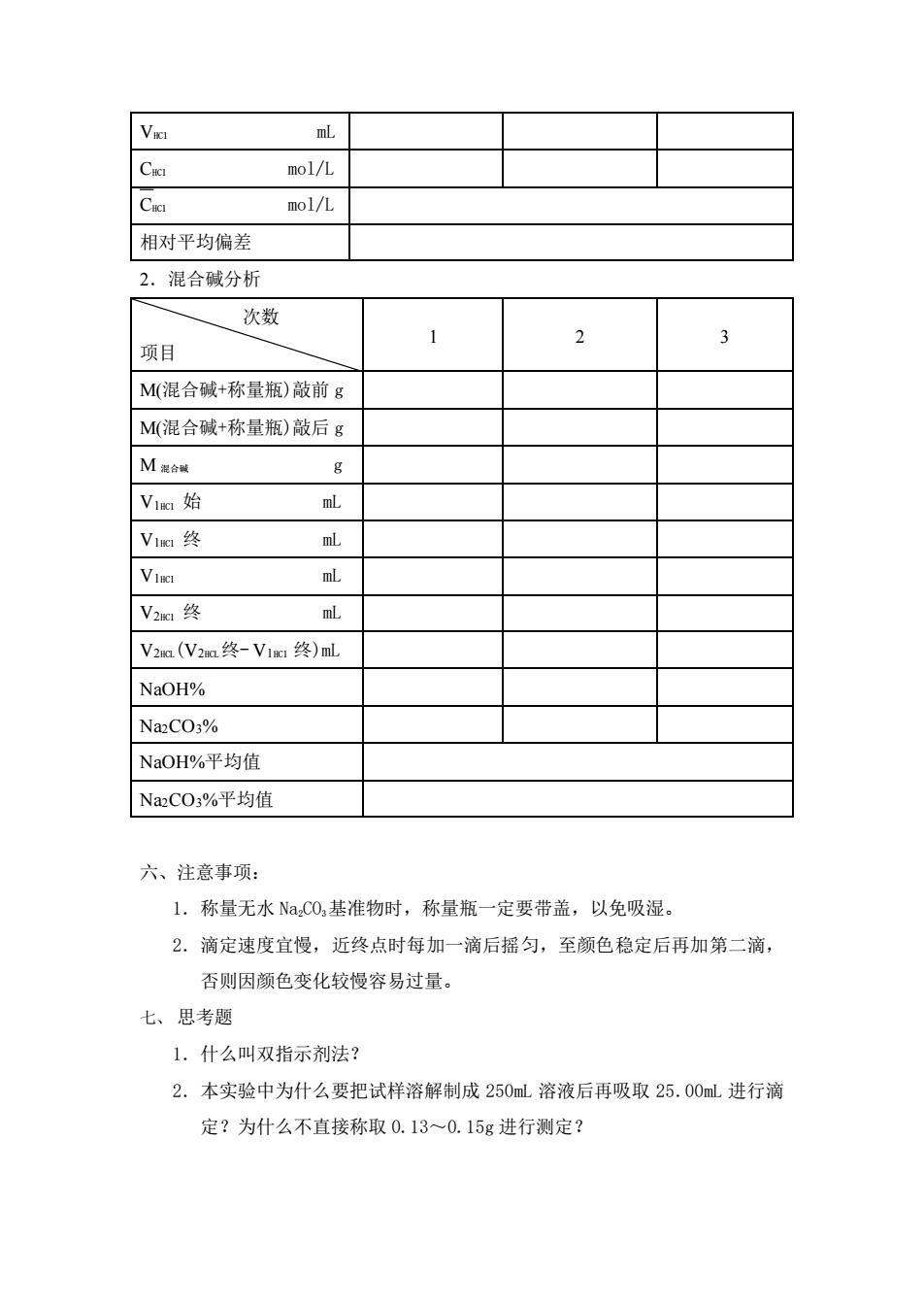
Va mL mol/L mol/L 相对平均偏差 2.混合碱分析 次数 1 2 项目 M(混合碱+称量瓶)敲前g M(混合碱+称量瓶)敲后g M起合装 g V1a始 mL V1阳终 VIn mL V2a终 mL V2a(V2a终-V1g终)mL NaOH% NazCO3% NaOH%平均值 NaCO3%平均值 六、注意事项: 1.称量无水Na,C0,基准物时,称量瓶一定要带盖,以免吸湿。 2.滴定速度宜慢,近终点时每加一滴后摇匀,至颜色稳定后再加第二滴, 否则因颜色变化较慢容易过量。 七、思考题 1.什么叫双指示剂法? 2.本实验中为什么要把试样溶解制成250mL溶液后再吸取25.00mL进行滴 定?为什么不直接称取0.13~0.15g进行测定?VHCl mL CHCl mol/L CHCl mol/L 相对平均偏差 2.混合碱分析 次数 项目 1 2 3 M(混合碱+称量瓶)敲前 g M(混合碱+称量瓶)敲后 g M 混合碱 g V1HCl 始 mL V1HCl 终 mL V1HCl mL V2HCl 终 mL V2HCL(V2HCL终- V1HCl 终)mL NaOH% Na2CO3% NaOH%平均值 Na2CO3%平均值 六、注意事项: 1.称量无水 Na2CO3基准物时,称量瓶一定要带盖,以免吸湿。 2.滴定速度宜慢,近终点时每加一滴后摇匀,至颜色稳定后再加第二滴, 否则因颜色变化较慢容易过量。 七、 思考题 1.什么叫双指示剂法? 2.本实验中为什么要把试样溶解制成 250mL 溶液后再吸取 25.00mL 进行滴 定?为什么不直接称取 0.13~0.15g 进行测定?