正在加载图片...
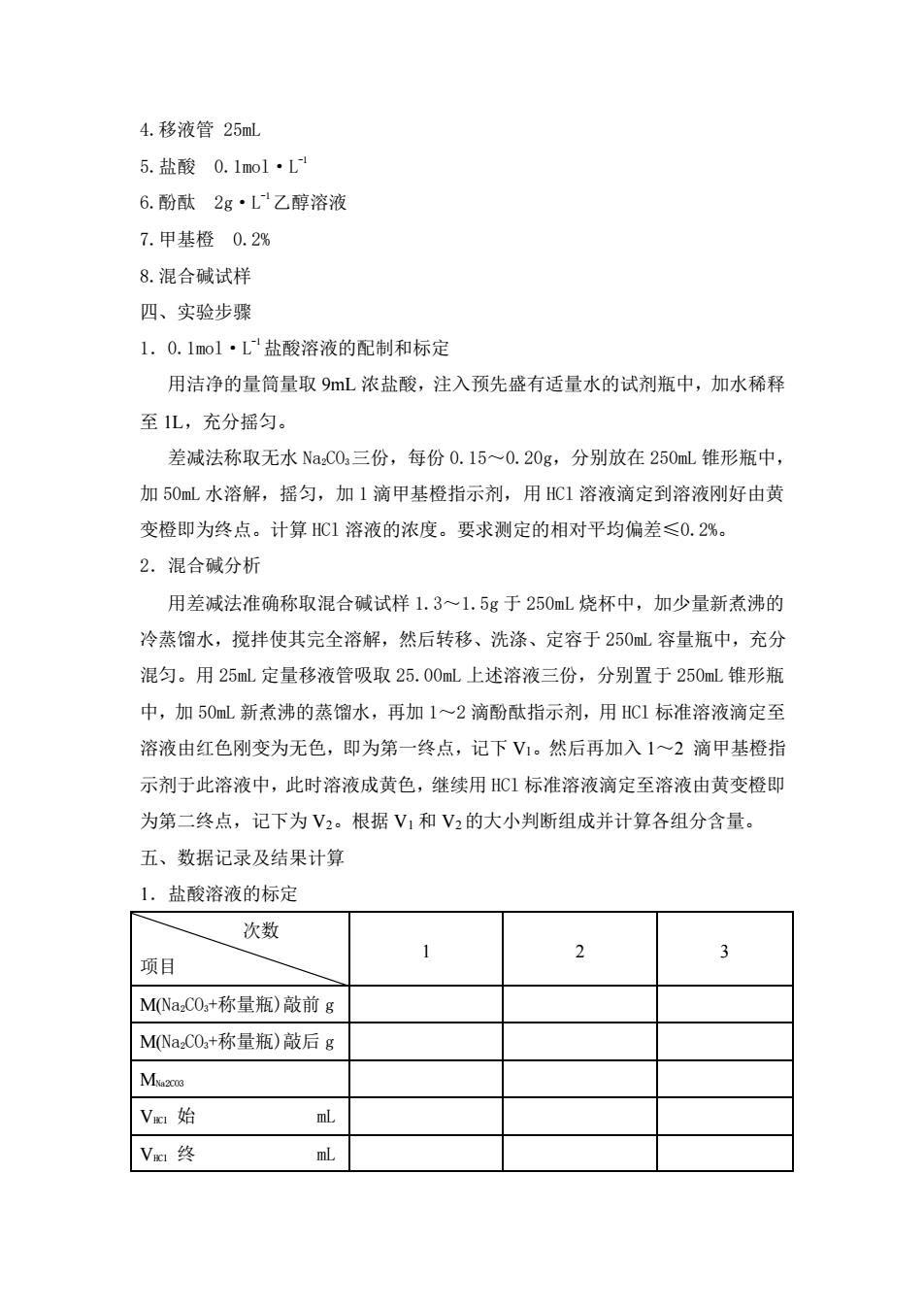
4.移液管25ml 5.盐酸0.1o1L 6.酚酞2g·L乙醇溶液 7.甲基橙0.2% 8.混合碱试样 四、实验步骤 1,0.1mol·L盐酸溶液的配制和标定 用洁净的量筒量取9mL浓盐酸,注入预先盛有适量水的试剂瓶中,加水稀释 至1L,充分摇匀。 差减法称取无水NaC0,三份,每份0.15~0.20g,分别放在250mL维形瓶中, 加50mL水溶解,摇匀,加1滴甲基橙指示剂,用HC1溶液滴定到溶液刚好由黄 变橙即为终点。计算HC1溶液的浓度。要求测定的相对平均偏差≤0.2%。 2.混合碱分析 用差减法准确称取混合碱试样1.3~1.5g于250mL烧杯中,加少量新煮沸的 冷蒸馏水,搅拌使其完全溶解,然后转移、洗涤、定容于250ml容量瓶中,充分 混匀。用25ml定量移液管吸取25.00ml上述溶液三份,分别置于250ml锥形瓶 中,加50mL新煮沸的蒸馏水,再加1~2滴酚酞指示剂,用HC1标准溶液滴定至 溶液由红色刚变为无色,即为第一终点,记下V1。然后再加入1~2滴甲基橙指 示剂于此溶液中,此时溶液成黄色,继续用HC1标准溶液滴定至溶液由黄变橙即 为第二终点,记下为V2。根据V1和V2的大小判断组成并计算各组分含量。 五、数据记录及结果计算 1.盐酸溶液的标定 次数 1 2 3 项目 MNa,C0+称量瓶)敲前g M(NaCO,+称量瓶)敲后g Mo Vm始 Vm终 mL 4.移液管 25mL 5.盐酸 0.1mol·L -1 6.酚酞 2g·L -1乙醇溶液 7.甲基橙 0.2% 8.混合碱试样 四、实验步骤 1.0.1mol·L -1盐酸溶液的配制和标定 用洁净的量筒量取 9mL 浓盐酸,注入预先盛有适量水的试剂瓶中,加水稀释 至 1L,充分摇匀。 差减法称取无水 Na2CO3三份,每份 0.15~0.20g,分别放在 250mL 锥形瓶中, 加 50mL 水溶解,摇匀,加 1 滴甲基橙指示剂,用 HCl 溶液滴定到溶液刚好由黄 变橙即为终点。计算 HCl 溶液的浓度。要求测定的相对平均偏差≤0.2%。 2.混合碱分析 用差减法准确称取混合碱试样 1.3~1.5g 于 250mL 烧杯中,加少量新煮沸的 冷蒸馏水,搅拌使其完全溶解,然后转移、洗涤、定容于 250mL 容量瓶中,充分 混匀。用 25mL 定量移液管吸取 25.00mL 上述溶液三份,分别置于 250mL 锥形瓶 中,加 50mL 新煮沸的蒸馏水,再加 1~2 滴酚酞指示剂,用 HCl 标准溶液滴定至 溶液由红色刚变为无色,即为第一终点,记下 V1。然后再加入 1~2 滴甲基橙指 示剂于此溶液中,此时溶液成黄色,继续用 HCl 标准溶液滴定至溶液由黄变橙即 为第二终点,记下为 V2。根据 V1 和 V2的大小判断组成并计算各组分含量。 五、数据记录及结果计算 1.盐酸溶液的标定 次数 项目 1 2 3 M(Na2CO3+称量瓶)敲前 g M(Na2CO3+称量瓶)敲后 g MNa2CO3 VHCl 始 mL VHCl 终 mL