
实验九动物细胞培养 Dr.Tian 2002
实验九 动物细胞培养

一、实验目的 ·掌握无菌操作 ·掌握原代和传代细胞培养; ·了解培养成纤维细胞的形态。 Dr.Tian 2002
一、实验目的 • 掌握无菌操作; • 掌握原代和传代细胞培养; • 了解培养成纤维细胞的形态

二、实验原理 ·原代培养:培养直接来自动物机体的细胞群,将 细胞从一个培养瓶转移到另外一个培养瓶称为传 代或传代培养。 ·细胞株:从原代培养细胞群中筛选出的具有特定 性质或标志的细胞群。 细胞系:从肿瘤组织培养建立的细胞群或培养过 程中发生突变或转化的细胞,可无限繁殖。 Dr.Tian 2002
• 原代培养 :培养直接来自动物机体的细胞群,将 细胞从一个培养瓶转移到另外一个培养瓶称为传 代或传代培养。 • 细胞株:从原代培养细胞群中筛选出的具有特定 性质或标志的细胞群。 • 细胞系:从肿瘤组织培养建立的细胞群或培养过 程中发生突变或转化的细胞,可无限繁殖。 二、实验原理

三、实验器材与试剂 ·1.器具 ·显微镜、电热恒温水浴锅、天平、CO2培养箱、 蒸汽灭菌器、超净工作台、解剖刀、眼科剪、眼 科镊、培养皿、锥形瓶、容量瓶、纱布、培养瓶、 移液枪。 ·2.材料 ·9-12日龄发育良好的鸭胚。 Dr.Tian 2002
三、实验器材与试剂 • 1. 器具 • 显微镜、电热恒温水浴锅、天平、CO2培养箱、 蒸汽灭菌器、超净工作台、解剖刀、 眼科剪、眼 科镊、培养皿 、锥形瓶、容量瓶、纱布、培养瓶、 移液枪。 • 2. 材料 • 9 - 12 日龄发育良好的鸭胚

·3.主要试剂 。双蒸水、Hank's液、0.25%胰蛋白酶、 EDTA、NaHCO3、台盼蓝、洋红。 ·营养液:DMEM培养基(含8%小牛血清、 1万单位/ml青、链霉素)。 ·维持液:DMEM培养基(含5%小牛血清、 1万单位ml青、链霉素)。 Dr.Tian 2002
• 3. 主要试剂 • 双蒸水、Hank’s液、0.25%胰蛋白酶、 EDTA、NaHCO3 、台盼蓝、洋红。 • 营养液:DMEM培养基(含8%小牛血清、 1万单位/ml青、链霉素)。 • 维持液: DMEM培养基(含5%小牛血清、 1万单位/ml青、链霉素)

四、原代培养 ·1.酒精棉球消毒鸭蛋,剥出鸭胚,去头、翅、爪和内脏,加Hank's 液,剪碎为0.5-1mm3的小块,Hank's液洗涤2-3次。 ·2.组织块移入培养瓶,间距0.5c摆放后倒置培养瓶,加少量营养液, 保持湿润,37℃培养,2r后翻转培养瓶,添营养液继续培养。 ·3.定期观察细胞贴壁生长状况,如颜色变黄,说明细胞生长,3-5天 后更换培养液。 。4.倒置显微镜下观察拍照。 ·5.单层细胞用Hank's液洗涤后,加入维持液,用于原代细胞维持。 Dr.Tian 2002
四、原代培养 • 1.酒精棉球消毒鸭蛋,剥出鸭胚,去头、翅、爪和内脏, 加Hank’s 液,剪碎为0. 5 -1mm3 的小块, Hank’s 液洗涤2 - 3 次。 • 2. 组织块移入培养瓶,间距0.5cm摆放后倒置培养瓶,加少量营养液, 保持湿润,37 ℃培养,2hr后翻转培养瓶,添营养液继续培养。 • 3. 定期观察细胞贴壁生长状况,如颜色变黄,说明细胞生长,3-5天 后更换培养液。 • 4 .倒置显微镜下观察拍照。 • 5.单层细胞用Hank’s 液洗涤后,加入维持液,用于原代细胞维持

五、传代培养 ·当培养细胞接近汇合成片时,倾去培养液。 ·加入0.25%(含0.02%EDTA)消化2-3分钟,倾去大部 分消化液,留少量消化液浸润细胞。发现细胞层出现裂痕 或空洞后,加入Hank's液洗去残留消化液,终止消化。 ·加适量营养液吹打分散,补加营养液后,1:2分装培养。 ·汇合后挑取少许细胞,染色,观察拍照。 Dr.Tian 2002
五、传代培养 • 当培养细胞接近汇合成片时,倾去培养液。 • 加入0. 25 %(含0. 02 %EDTA )消化2-3分钟,倾去大部 分消化液,留少量消化液浸润细胞。发现细胞层出现裂痕 或空洞后,加入Hank’s 液洗去残留消化液,终止消化。 • 加适量营养液吹打分散,补加营养液后,1:2分装培养。 • 汇合后挑取少许细胞,染色,观察拍照

原代培养的绍鸭成纤维细胞,相差显微镜照片
原代培养的绍鸭成纤维细胞,相差显微镜照片
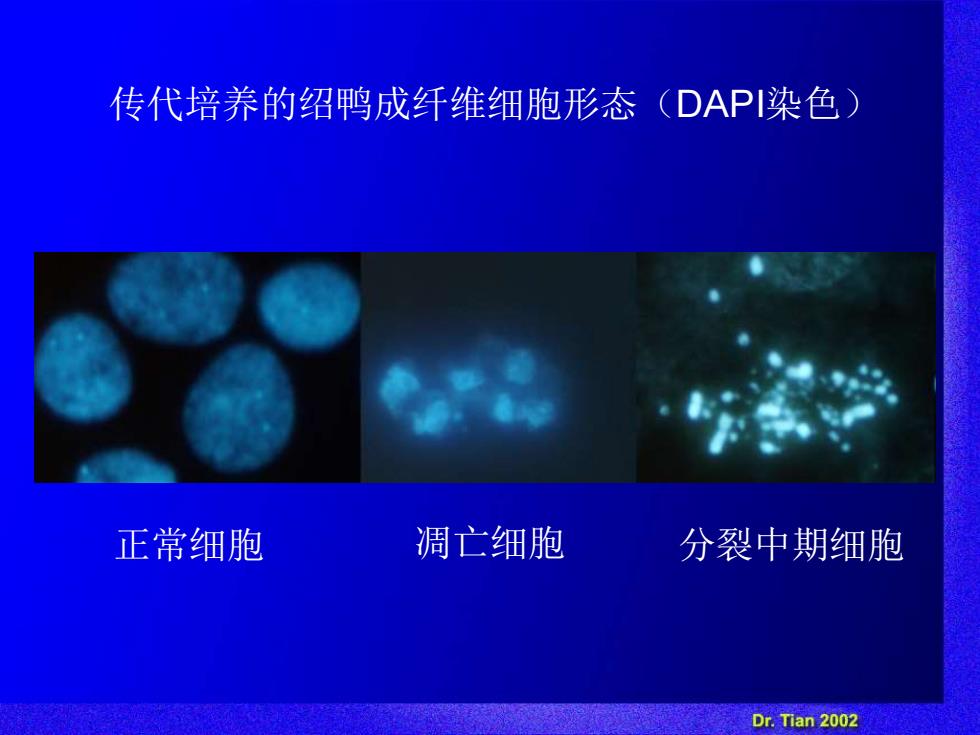
传代培养的绍鸭成纤维细胞形态(DAPI染色 正常细胞 凋亡细胞 分裂中期细胞 Dr.Tian 2002
正常细胞 凋亡细胞 分裂中期细胞 传代培养的绍鸭成纤维细胞形态(DAPI染色)

六、作业 ·1.细胞培养过程中应该注意哪些事项? 。2.描绘培养成纤维细胞的形态(或提供照 片)。 Dr.Tian 2002
六、作业 • 1. 细胞培养过程中应该注意哪些事项? • 2. 描绘培养成纤维细胞的形态(或提供照 片)