正在加载图片...
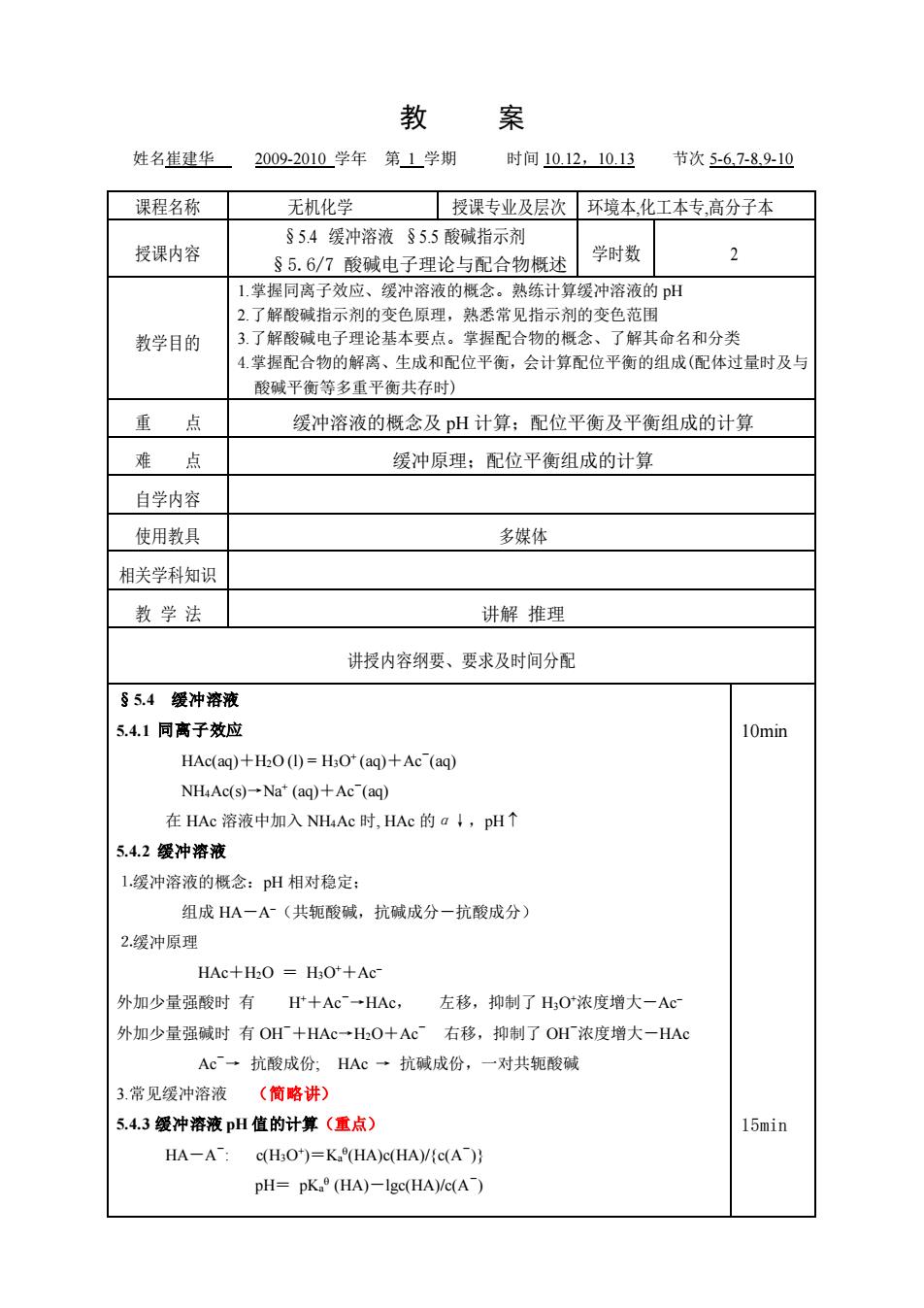
教 案 姓名崔建华 2009-2010学年第1学期 时间1012,1013 节次5-6.7-89.10 课程名称 无机化学 授课专业及层次环境本化工本专,高分子本 §54缓冲溶液S55酸碱指示剂 授课内容 S5.61酸碱电子理论与配合物概述学时数 2 1.掌握同离子效应、缓冲溶液的概念。熟练计算缓冲溶液的pH 2了解酸碱指示剂的变色原理,熟悉常见指示剂的变色范围 教学目的 3.了解酸碱电子理论基本要点。掌握配合物的概念、 了解其命名和分类 掌握配合物的解离、生成和配位平衡,会计算配位平衡的组成(配体过量时及与 酸碱平衡等多重平衡共存时) 重点 缓冲溶液的概念及pH计算:配位平衡及平衡组成的计算 难点 缓冲原理:配位平衡组成的计算 自学内容 使用教具 多媒体 相关学科知识 教学法 讲解推理 讲授内容纲要、要求及时间分配 §5.4缀冲溶液 5.41同高子效应 10min HAc(aq)+H2O(I)=H;O*(aq)+Ac(aq) NHaAc(s)-Na"(aq)+Ac (aq) 在HAc溶液中加入NHAc时,HAc的a!,pH↑ 54.2缓冲溶液 1缓冲溶液的概念:pH相对稳定 组成HA一A(共轭酸碱,抗碱成分一抗酸成分) 2.缓冲原理 HAc+H:O H3O'+Ac- 外加少量强酸时有H十Ac一HAc, 左移,抑制了HO浓度增大一Ac 外加少量强碱时有OH+HAc一HO十Ac右移,抑制了OH浓度增大-HAc Ac一抗酸成份;HAc一抗碱成份,一对共轭酸碱 3.常见缓冲溶液(简略讲) 5.4.3缓冲溶液pH值的计算(重点) 15min HA-A-:c(HaO)=K(HA)c(HA)/C(A) pH=pK(HA)-lgc(HA)/c(A)教 案 姓名崔建华 2009-2010 学年 第 1 学期 时间 10.12,10.13 节次 5-6,7-8,9-10 课程名称 无机化学 授课专业及层次 环境本,化工本专,高分子本 授课内容 §5.4 缓冲溶液 §5.5 酸碱指示剂 §5.6/7 酸碱电子理论与配合物概述 学时数 2 教学目的 1.掌握同离子效应、缓冲溶液的概念。熟练计算缓冲溶液的 pH 2.了解酸碱指示剂的变色原理,熟悉常见指示剂的变色范围 3.了解酸碱电子理论基本要点。掌握配合物的概念、了解其命名和分类 4.掌握配合物的解离、生成和配位平衡,会计算配位平衡的组成(配体过量时及与 酸碱平衡等多重平衡共存时) 重 点 缓冲溶液的概念及 pH 计算;配位平衡及平衡组成的计算 难 点 缓冲原理;配位平衡组成的计算 自学内容 使用教具 多媒体 相关学科知识 教 学 法 讲解 推理 讲授内容纲要、要求及时间分配 §5.4 缓冲溶液 5.4.1 同离子效应 HAc(aq)+H2O (l) = H3O+ (aq)+Ac- (aq) NH4Ac(s)→Na+ (aq)+Ac- (aq) 在 HAc 溶液中加入 NH4Ac 时, HAc 的α↓,pH 5.4.2 缓冲溶液 ⒈缓冲溶液的概念:pH 相对稳定; 组成 HA-A−(共轭酸碱,抗碱成分-抗酸成分) ⒉缓冲原理 HAc+H2O = H3O++Ac− 外加少量强酸时 有 H++Ac-→HAc, 左移,抑制了 H3O+浓度增大-Ac− 外加少量强碱时 有 OH-+HAc→H2O+Ac- 右移,抑制了 OH-浓度增大-HAc Ac-→ 抗酸成份; HAc → 抗碱成份,一对共轭酸碱 3.常见缓冲溶液 (简略讲) 5.4.3 缓冲溶液 pH 值的计算(重点) HA-A - : c(H3O+ )=Ka (HA)c(HA)/{c(A- )} pH= pKa (HA)-lgc(HA)/c(A- ) 10min 15min