正在加载图片...
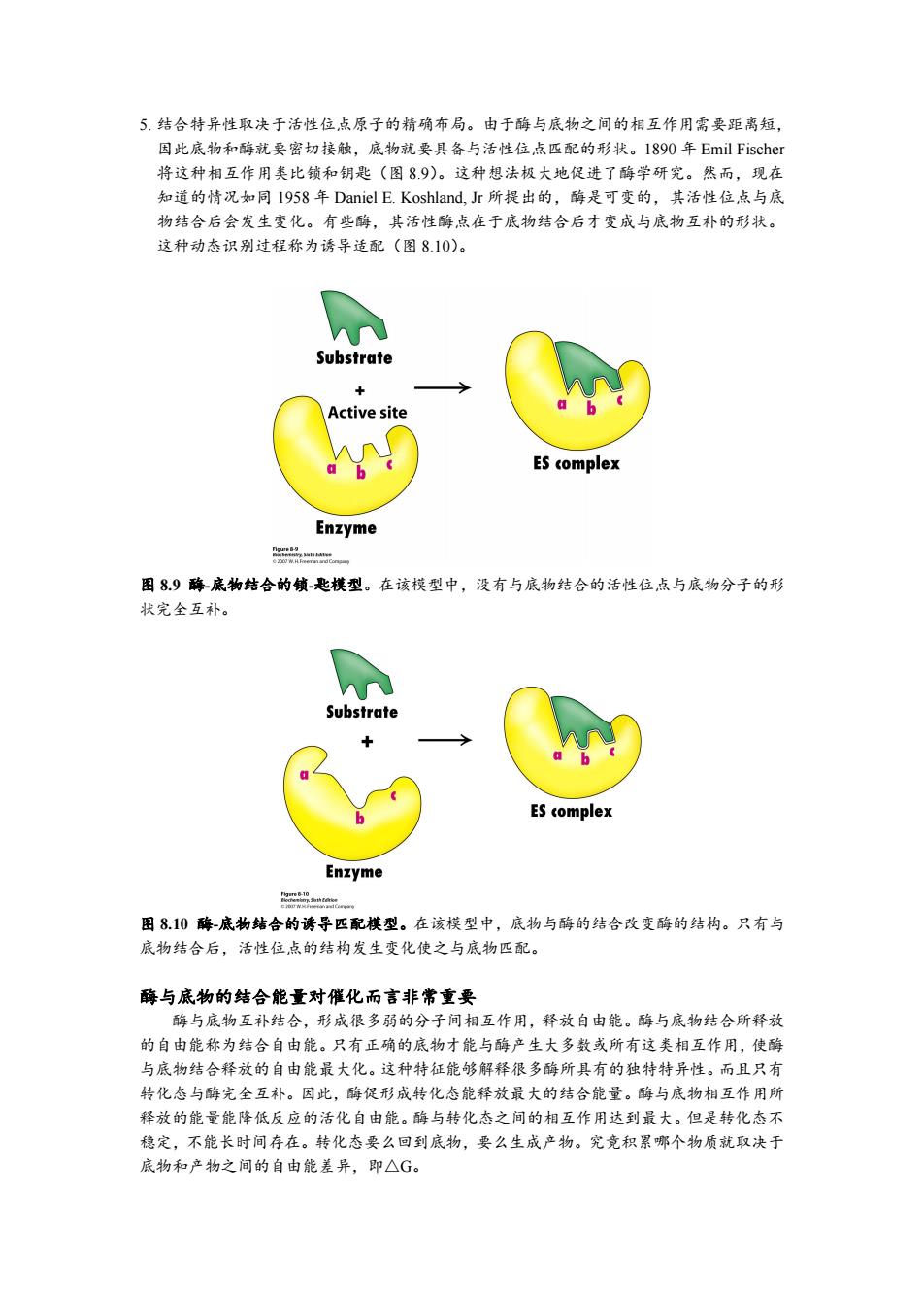
5.结合特异性取决于活性位,点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890年Emil Fischer 将这种相互作用类比锁和钥匙(图89)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同I958年Daniel E.Koshland,Jr所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图8.10)。 Substrate + Active site ES complex Enzyme 品 图89酶底物结合的饿-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 Substrate ES complex Enzyme 图810酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G。5. 结合特异性取决于活性位点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890 年 Emil Fischer 将这种相互作用类比锁和钥匙(图 8.9)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同 1958 年 Daniel E. Koshland, Jr 所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图 8.10)。 图 8.9 酶-底物结合的锁-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 图 8.10 酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G