正在加载图片...
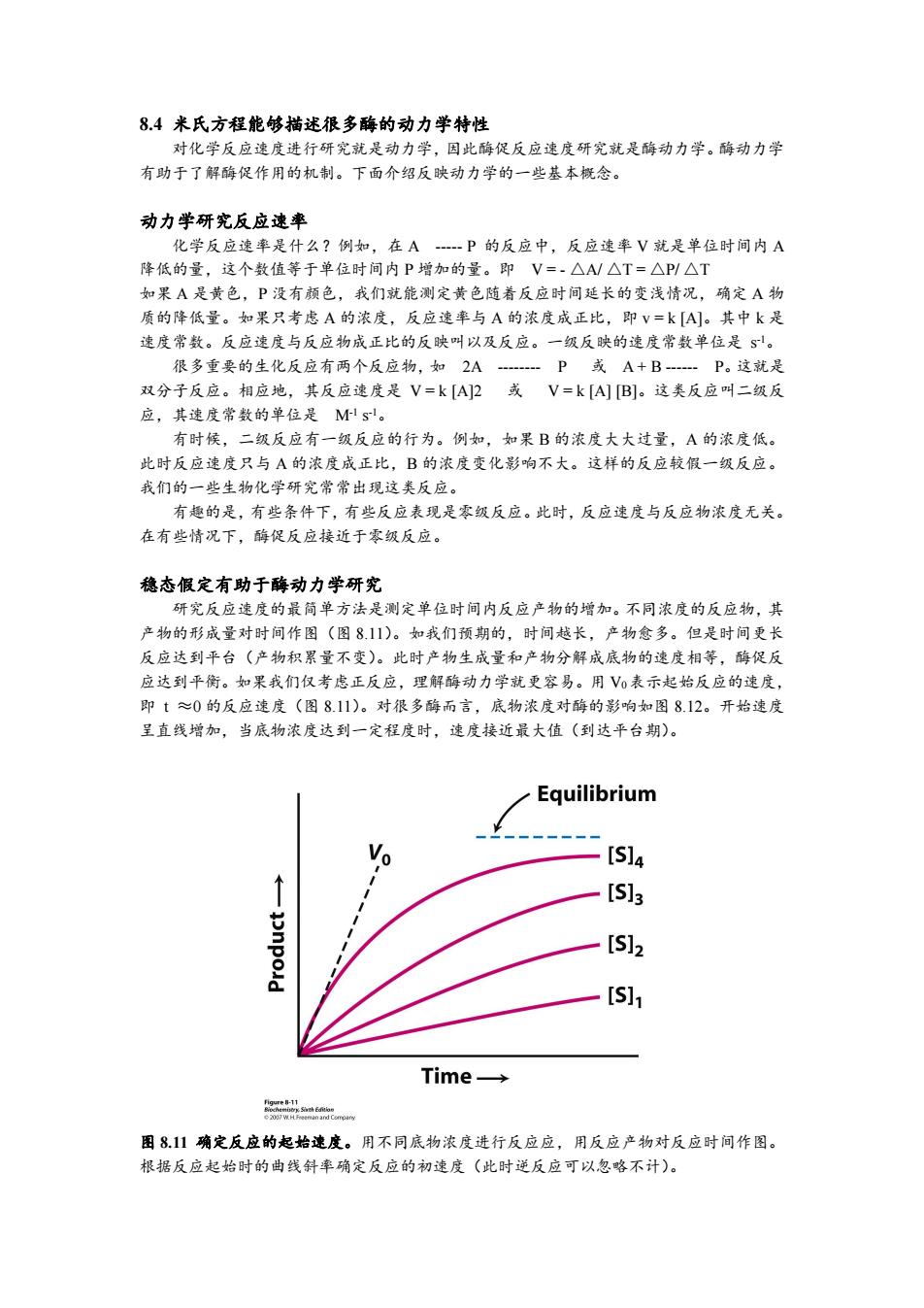
8.4米氏方程能够描述很多酶的动力学特性 对化学反应速度进行研究就是动力学,因此酶促反应速度研究就是酶动力学。酶动力学 有助于了解酶促作用的机制。下面介绍反映动力学的一些基本概念。 动力学研究反应速率 化学反应速率是什么?例如,在A-P的反应中,反应速率V就是单位时间内A 降低的量,这个数值等于单位时间内P增加的量。即V=-△A/△T=△P/△T 如果A是黄色,P没有颜色,我们就能测定黄色随着反应时间延长的变浅情况,确定A物 质的降低量。如果只考虑A的浓度,反应速率与A的浓度成正比,即V=k[A]。其中k是 速度常数。反应速度与反应物成正比的反映叫以及反应。一级反映的速度常数单位是S。 很多重要的生化反应有两个反应物,如2AP或A+B…P。这就是 双分子反应。相应地,其反应速度是V=k[A2或V=k[A][B]。这类反应叫二级反 应,其速度常数的单位是Ms。 有时候,二级反应有一级反应的行为。例如,如果B的浓度大大过量,A的浓度低。 此时反应速度只与A的浓度成正比,B的浓度变化影响不大。这样的反应较假一级反应。 我们的一些生物化学研究常常出现这类反应。 有趣的是,有些条件下,有些反应表现是零级反应。此时,反应速度与反应物浓度无关。 在有些情况下,酶促反应接近于零级反应。 稳态假定有助于酶动力学研究 研究反应速度的最简单方法是测定单位时间内反应产物的增加。不同浓度的反应物,其 产物的形成量对时间作图(图811)。如我们预期的,时间越长,产物愈多。但是时间更长 反应达到平台(产物积累量不变)。此时产物生成量和产物分解成底物的速度相等,酶促反 应达到平衡。如果我们仅考虑正反应,理解酶动力学就更容易。用V0表示起始反应的速度, 即t≈0的反应速度(图8.11)。对很多酶而言,底物浓度对酶的影响如图812。开始速度 呈直线增加,当底物浓度达到一定程度时,速度接近最大值(到达平台期)。 Equilibrium [S]4 [S]3 [S]2 [S]1 Time→ Bigure-11 图811确定反应的起始速度。用不同底物浓度进行反应应,用反应产物对反应时间作图。 根据反应起始时的曲线斜率确定反应的初速度(此时逆反应可以忽略不计)。8.4 米氏方程能够描述很多酶的动力学特性 对化学反应速度进行研究就是动力学,因此酶促反应速度研究就是酶动力学。酶动力学 有助于了解酶促作用的机制。下面介绍反映动力学的一些基本概念。 动力学研究反应速率 化学反应速率是什么?例如,在 A ----- P 的反应中,反应速率 V 就是单位时间内 A 降低的量,这个数值等于单位时间内 P 增加的量。即 V = - △A/ △T = △P/ △T 如果 A 是黄色,P 没有颜色,我们就能测定黄色随着反应时间延长的变浅情况,确定 A 物 质的降低量。如果只考虑 A 的浓度,反应速率与 A 的浓度成正比,即 v = k [A]。其中 k 是 速度常数。反应速度与反应物成正比的反映叫以及反应。一级反映的速度常数单位是 s -1。 很多重要的生化反应有两个反应物,如 2A -------- P 或 A + B ------ P。这就是 双分子反应。相应地,其反应速度是 V = k [A]2 或 V = k [A] [B]。这类反应叫二级反 应,其速度常数的单位是 M-1 s -1。 有时候,二级反应有一级反应的行为。例如,如果 B 的浓度大大过量,A 的浓度低。 此时反应速度只与 A 的浓度成正比,B 的浓度变化影响不大。这样的反应较假一级反应。 我们的一些生物化学研究常常出现这类反应。 有趣的是,有些条件下,有些反应表现是零级反应。此时,反应速度与反应物浓度无关。 在有些情况下,酶促反应接近于零级反应。 稳态假定有助于酶动力学研究 研究反应速度的最简单方法是测定单位时间内反应产物的增加。不同浓度的反应物,其 产物的形成量对时间作图(图 8.11)。如我们预期的,时间越长,产物愈多。但是时间更长 反应达到平台(产物积累量不变)。此时产物生成量和产物分解成底物的速度相等,酶促反 应达到平衡。如果我们仅考虑正反应,理解酶动力学就更容易。用 V0表示起始反应的速度, 即 t ≈0 的反应速度(图 8.11)。对很多酶而言,底物浓度对酶的影响如图 8.12。开始速度 呈直线增加,当底物浓度达到一定程度时,速度接近最大值(到达平台期)。 图 8.11 确定反应的起始速度。用不同底物浓度进行反应应,用反应产物对反应时间作图。 根据反应起始时的曲线斜率确定反应的初速度(此时逆反应可以忽略不计)