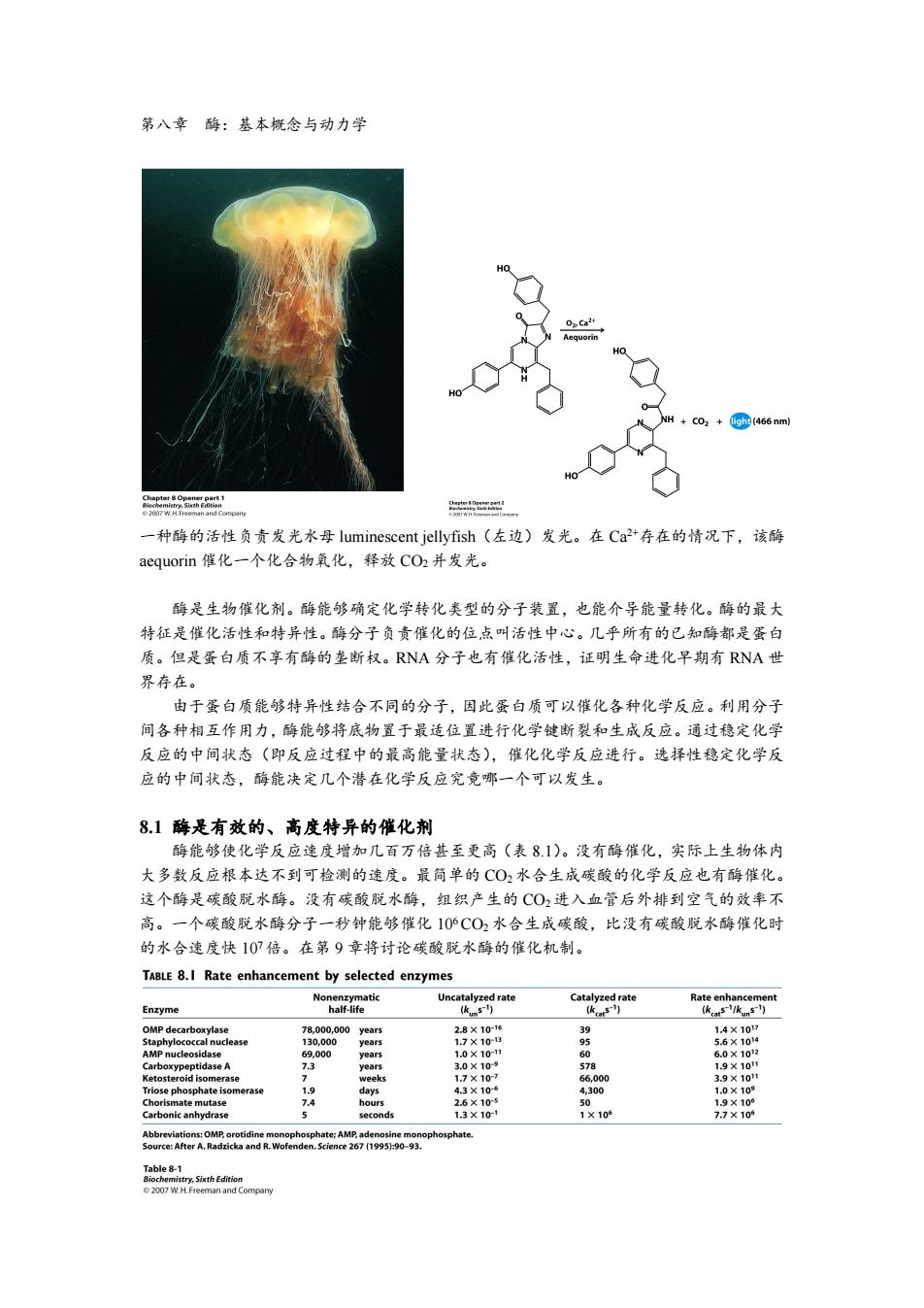
第八章酶:基本概念与动力学 0Ca24 equorin +CO2 (466 nm) 9 一种酶的活性负责发光水母luminescent jellyfish(左边)发光。在Ca2+存在的情况下,该酶 aequorin催化一个化合物氧化,释放CO2并发光。 酶是生物催化剂。酶能够确定化学转化类型的分子装置,也能介导能量转化。酶的最大 特征是催化活性和特异性。酶分子负贡催化的位点叫活性中心。几乎所有的已知酶都是蛋白 质。但是蛋白质不享有酶的垄断权。RNA分子也有催化活性,证明生命进化早期有RNA世 界存在。 由于蛋白质能够特异性结合不同的分子,因此蛋白质可以催化各种化学反应。利用分子 间各种相互作用力,酶能够将底物置于最适位置进行化学键断裂和生成反应。通过稳定化学 反应的中间状态(即反应过程中的最高能量状态),催化化学反应进行。选择性稳定化学反 应的中间状态,酶能决定几个潜在化学反应究竟哪一个可以发生。 8.1酶是有效的、高度特异的催化剂 酶能够使化学反应速度增加几百万倍甚至更高(表8.1)。没有酶催化,实际上生物体内 大多数反应根本达不到可检测的速度。最简单的CO2水合生成碳酸的化学反应也有酶催化。 这个酶是碳酸脱水酶。没有碳酸脱水酶,组织产生的CO2进入血管后外排到空气的效率不 高。一个碳酸脱水酶分子一秒钟能够催化106C02水合生成碳酸,比没有碳酸脱水酶催化时 的水合速度快107倍。在第9章将讨论碳酸脱水酶的催化机制。 TABLE 8.I Rate enhancement by selected enzymes Nonenzymatic Uncatalyzed rate Catalyzed rate Rate enhancement Enzyme half-life (km51) (ka5) (kcats-/kuns-) OMP decarboxylase 78,000,000year5 2.8×1016 39 1.4×107 Staphylococcal nuclease 130,000 years 1.7×10-13 9 5.6×1014 AMP nucleosidase 69.000 years 1.0×10-11 60 6.0×1012 Carboxypeptidase A 73 years 3.0×10- 578 1.9×10t Ketosteroid isomerase 2 weeks 1.7×10-7 66,000 3.9×101 Triose phosphate isomerase 1.9 days 4.3×106 4,300 1.0×109 Chorismate mutase 7.4 hours 2.6×10-5 50 1.9×105 Carbonic anhydrase seconds 13×10-1 1×10 7.7×10 Abbreviations:OMP,orotidine monophosphate:AMP,adenosine monophosphate. Source:After A.Radzicka and R.Wofenden.Science 267(1995):90-93. Table8-1 Biochemistry,Sixth Edition 2007 W.H.Freeman and Compary
第八章 酶:基本概念与动力学 一种酶的活性负责发光水母 luminescent jellyfish(左边)发光。在 Ca 2+存在的情况下,该酶 aequorin 催化一个化合物氧化,释放 CO2并发光。 酶是生物催化剂。酶能够确定化学转化类型的分子装置,也能介导能量转化。酶的最大 特征是催化活性和特异性。酶分子负责催化的位点叫活性中心。几乎所有的已知酶都是蛋白 质。但是蛋白质不享有酶的垄断权。RNA 分子也有催化活性,证明生命进化早期有 RNA 世 界存在。 由于蛋白质能够特异性结合不同的分子,因此蛋白质可以催化各种化学反应。利用分子 间各种相互作用力,酶能够将底物置于最适位置进行化学键断裂和生成反应。通过稳定化学 反应的中间状态(即反应过程中的最高能量状态),催化化学反应进行。选择性稳定化学反 应的中间状态,酶能决定几个潜在化学反应究竟哪一个可以发生。 8.1 酶是有效的、高度特异的催化剂 酶能够使化学反应速度增加几百万倍甚至更高(表 8.1)。没有酶催化,实际上生物体内 大多数反应根本达不到可检测的速度。最简单的 CO2水合生成碳酸的化学反应也有酶催化。 这个酶是碳酸脱水酶。没有碳酸脱水酶,组织产生的 CO2 进入血管后外排到空气的效率不 高。一个碳酸脱水酶分子一秒钟能够催化 10 6CO2水合生成碳酸,比没有碳酸脱水酶催化时 的水合速度快 10 7倍。在第 9 章将讨论碳酸脱水酶的催化机制
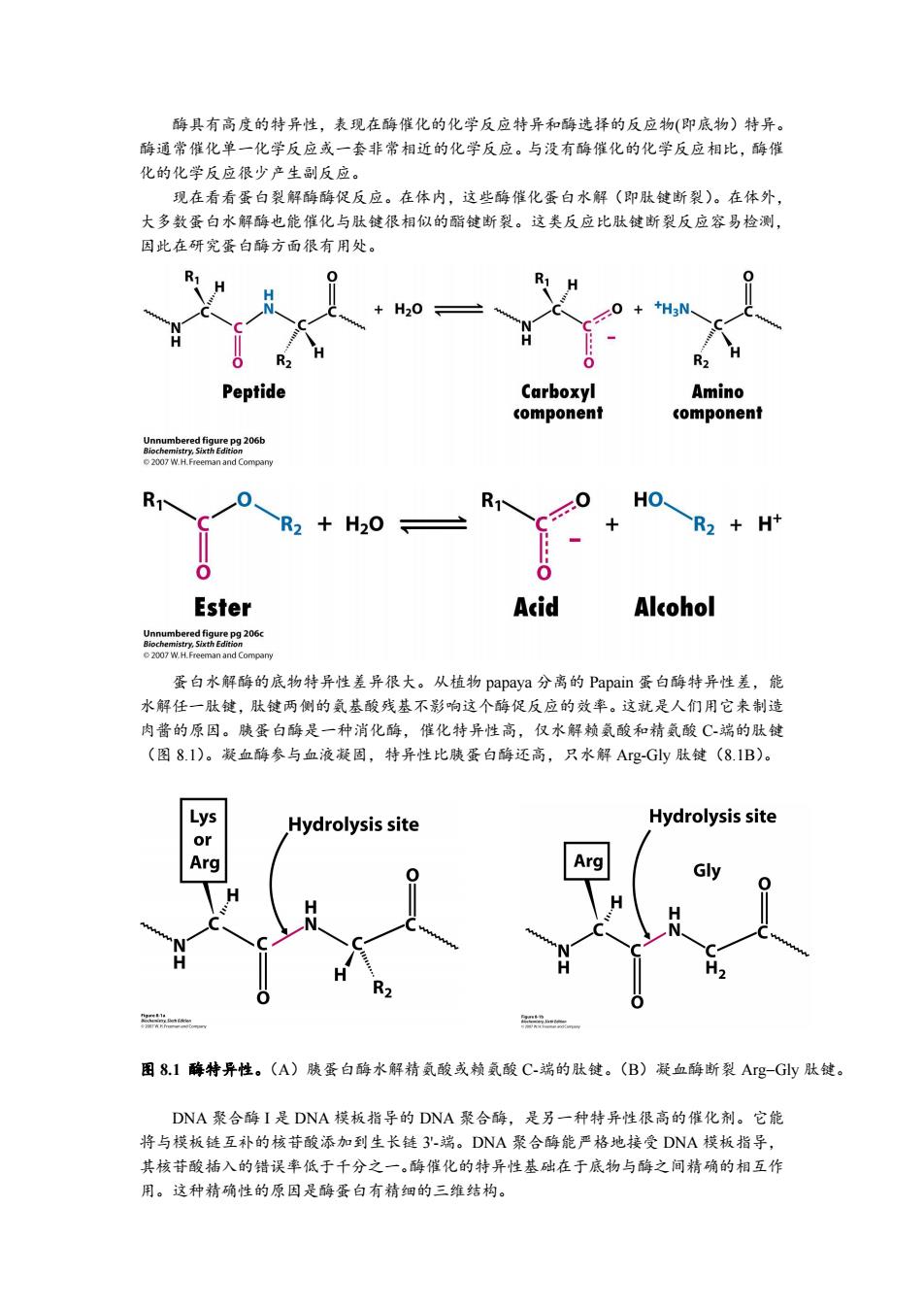
酶具有高度的特异性,表现在酶催化的化学反应特异和酶选择的反应物(即底物)特异。 酶通常催化单一化学反应或一套非常相近的化学反应。与没有酶催化的化学反应相比,酶催 化的化学反应很少产生副反应。 现在看看蛋白裂解酶酶促反应。在体内,这些酶催化蛋白水解(即肽键断裂)。在体外, 大多数蛋白水解酶也能催化与肽键很相似的酯键断裂。这类反应比肽键断裂反应容易检测, 因此在研究蛋白酶方面很有用处。 H20 Peptide Carboxyl Amino component component Unnumbered figure pg 206b 2007 W.H.Freeman and Compary R HO R2 +H20 R2 H+ Ester Acid Alcohol cm06 2007 W.H.Freeman and Company 蛋白水解酶的底物特异性差异很大。从植物papaya分离的Papain蛋白酶特异性差,能 水解任一肽键,肽键两侧的氨基酸残基不影响这个酶促反应的效率。这就是人们用它来制造 肉酱的原因。胰蛋白酶是一种消化酶,催化特异性高,仅水解赖氨酸和精氨酸C端的肽键 (图8.I)。凝血酶参与血液凝固,特异性比胰蛋白酶还高,只水解Ag-Gy肽键(8.1B)。 Hydrolysis site Hydrolysis site Arg 2n 图8.1酶特异性。(A)胰蛋白酶水解精氨酸或赖氨酸C-端的肽键。(B)凝血酶断裂Ag-Gly肽键。 DNA聚合酶I是DNA模板指导的DNA聚合酶,是另一种特异性很高的催化剂。它能 将与模板链互补的核苷酸添加到生长链3'-端。DNA聚合酶能严格地接受DNA模板指导, 其核苷酸插入的错误率低于千分之一。酶催化的特异性基础在于底物与酶之间精确的相互作 用。这种精确性的原因是酶蛋白有精细的三维结构
酶具有高度的特异性,表现在酶催化的化学反应特异和酶选择的反应物(即底物)特异。 酶通常催化单一化学反应或一套非常相近的化学反应。与没有酶催化的化学反应相比,酶催 化的化学反应很少产生副反应。 现在看看蛋白裂解酶酶促反应。在体内,这些酶催化蛋白水解(即肽键断裂)。在体外, 大多数蛋白水解酶也能催化与肽键很相似的酯键断裂。这类反应比肽键断裂反应容易检测, 因此在研究蛋白酶方面很有用处。 蛋白水解酶的底物特异性差异很大。从植物 papaya 分离的 Papain 蛋白酶特异性差,能 水解任一肽键,肽键两侧的氨基酸残基不影响这个酶促反应的效率。这就是人们用它来制造 肉酱的原因。胰蛋白酶是一种消化酶,催化特异性高,仅水解赖氨酸和精氨酸 C-端的肽键 (图 8.1)。凝血酶参与血液凝固,特异性比胰蛋白酶还高,只水解 Arg-Gly 肽键(8.1B)。 图 8.1 酶特异性。(A)胰蛋白酶水解精氨酸或赖氨酸 C-端的肽键。(B)凝血酶断裂 ArgGly 肽键。 DNA 聚合酶 I 是 DNA 模板指导的 DNA 聚合酶,是另一种特异性很高的催化剂。它能 将与模板链互补的核苷酸添加到生长链 3'-端。DNA 聚合酶能严格地接受 DNA 模板指导, 其核苷酸插入的错误率低于千分之一。酶催化的特异性基础在于底物与酶之间精确的相互作 用。这种精确性的原因是酶蛋白有精细的三维结构

很多酶其活性需要辅助因子 很多酶的催化活性依赖于被称为辅助因子的小分子(虽然辅助因子在不同酶的作用并不 相同)。通常这些辅助因子能够执行20种氨基酸不能执行的化学反应。没有辅助因子的酶叫 脱辅基酶(apoenzyme):全酶(holoenzyme)是具有催化活性的酶。 Apoenzyme cofactor =holoenzyme 辅助因子可以分为两类:(1)金属和(2)小的有机分子(称为辅酶)(表8.2)。辅酶 常常是维生素的衍生物,与酶结合有的松懈,有的紧密。紧密结合的辅酶叫辅基,结合松弛 的辅酶像协同底物(cosubstrate)。这些辅酶与酶的结合与解离类似酶促反应的第底物和产物。 不同的酶利用相同的辅酶,因此辅酶与正常的底物是不同的。利用同一辅酶的酶,虽然酶促 反应不同,但是这些酶催化的机理类似。在第9章,我们将讨论金属离子对酶活性的影响。 在整个生物化学教科书,我们会经常介绍辅酶与相应的酶蛋白之间的互作。后面我们会详细 介绍维生素知识。 TABLE 8.2 Enzyme cofactors Cofactor Enzyme Coenzyme Thiamine pyrophosphate Pyruvate dehydrogenase Flavin adenine nucleotide Monoamine oxidase Nicotinamide adenine dinucleotide Lactate dehydrogenase Pyridoxal phosphate Glycogen phosphorylase Coenzyme A(CoA) Acetyl CoA carboxylase Biotin Pyruvate carboxylase 5'-Deoxyadenosyl cobalamin Methylmalonyl mutase Tetrahydrofolate Thymidylate synthase Metal Zn2+ Carbonic anhydrase Zn2+ Carboxypeptidase Mg2+ EcoRV Mg2+ Hexokinase Ni2+ Urease Mo Nitrate reductase Se Glutathione peroxidase Mn Superoxide dismutase K+ Propionyl CoA carboxylase Table 8-2 try,Sixth Edition 2007 W.H.Freeman and Company 酶能够将一种形式的能量转化成另一种形式 很多生化反应中,反应物的能量能够高效转化成其他能量形式。例如,光合成反应能够 将光能转化成化学能。线粒体能够将食物小分子的自由能转化成离子梯度自由能,再转化成 ATP(一种通用的能量分子)。酶能够以很多方式利用ATP的化学键能。例如,肌球蛋白 (myosin)能够将ATP的能量转化成肌肉收缩的机械能(34章)膜上的泵是一种酶,能够 利用ATP的能量驱动分子和离子跨膜运输(第13章)。化学物质和离子不对称分布所形成 的浓度梯度也是一种能量形式,有不同的用途,如发射神经脉冲。 科学家正在阐明这些能量转导酶作用的分子机制。后面章节我们将介绍不同步骤(结合、 化学转化、和释放)是如何单向循环导致能量从一种形式转化成另一种形式的机制
很多酶其活性需要辅助因子 很多酶的催化活性依赖于被称为辅助因子的小分子(虽然辅助因子在不同酶的作用并不 相同)。通常这些辅助因子能够执行 20 种氨基酸不能执行的化学反应。没有辅助因子的酶叫 脱辅基酶(apoenzyme);全酶(holoenzyme)是具有催化活性的酶。 Apoenzyme + cofactor == holoenzyme 辅助因子可以分为两类:(1)金属和 (2)小的有机分子(称为辅酶)(表 8.2)。辅酶 常常是维生素的衍生物,与酶结合有的松懈,有的紧密。紧密结合的辅酶叫辅基,结合松弛 的辅酶像协同底物(cosubstrate)。这些辅酶与酶的结合与解离类似酶促反应的第底物和产物。 不同的酶利用相同的辅酶,因此辅酶与正常的底物是不同的。利用同一辅酶的酶,虽然酶促 反应不同,但是这些酶催化的机理类似。在第 9 章,我们将讨论金属离子对酶活性的影响。 在整个生物化学教科书,我们会经常介绍辅酶与相应的酶蛋白之间的互作。后面我们会详细 介绍维生素知识。 酶能够将一种形式的能量转化成另一种形式 很多生化反应中,反应物的能量能够高效转化成其他能量形式。例如,光合成反应能够 将光能转化成化学能。线粒体能够将食物小分子的自由能转化成离子梯度自由能,再转化成 ATP(一种通用的能量分子)。酶能够以很多方式利用 ATP 的化学键能。例如,肌球蛋白 (myosin)能够将 ATP 的能量转化成肌肉收缩的机械能(34 章)膜上的泵是一种酶,能够 利用 ATP 的能量驱动分子和离子跨膜运输(第 13 章)。化学物质和离子不对称分布所形成 的浓度梯度也是一种能量形式,有不同的用途,如发射神经脉冲。 科学家正在阐明这些能量转导酶作用的分子机制。后面章节我们将介绍不同步骤(结合、 化学转化、和释放)是如何单向循环导致能量从一种形式转化成另一种形式的机制

8.2自由能是理解酶的一个有用的热力学概念 第一章我们已经介绍了一些热力学原理。值得注意的概念是自由能(G)。为了了解酶 如何发挥作用,我们需要考虑化学反应的两个热力学性质:(1)产物和反应物之间的自由能 差异(△G):和(2)启动反应物生成产物需要的能量(即活化能△G*)。前者决定反应能否 进行,后者决定反应的速率。酶只改变后者。现在我们回顾一些能够用于酶的热力学原理。 自由能变化只提供反应能否进行的信息,不涉及反应速率 在前面我们曾经介绍,反映自由能变化△G能提供反应能否进行的信息。 1.△G小于零,反应可以发生,无需输送能量。 2.△G等于零,系统处于平衡状态。 3.△G大于零,反应不可能发生。必需输入能量驱动反应进行。因此是需能反应。 4.△G只取决于反应的终止状态(产物)和起始状态(反应物),与发生反应的路径(或 分子机理)无关。反应机理不影响反应的△G。例如氧化酶氧化葡萄糖产生CO2和H0 的自由能变化与葡萄糖直接燃烧产生CO2和H20的△G值相等。 5.△G值与反应速度没有关系。△G小于零只是表明反应能够自动发生,但是并不涉及反 应速度。反应速度取决于活化自由能(△G*)。活化自由能与△G没啥关系。 一个反应的标准自由能变化与平衡常数有关 很多反应的自由能变化可以计算,根据自由能变化确定反应是自主发生,还是需要输入 能量。为了确定这个重要的热力学参数,我们要考虑反应物和生成物的化学本质以及各个物 质的浓度。A+B==C+D △G=△G+RTn{[CD]I[AB]} (1) 其中,△G是标准自由能变化,R是气体常数,T是绝对温度,[A],B],[C],[D]是摩尔 浓度。△G是反应物和生成物浓度都是1摩尔的标准状态下自由能的变化值。因此△G取 决于反应物本质(方程式1的△G)和反应物浓度(方程式1的对数部分)。 传统上简化自由能计算。将标准状况的pH值定义为7.0。如果氢离子是反应物,其活 性(或浓度)定义为1,水的浓度(或活性)也定义为1。本书将pH7.0的自由能变化定义 为标准自由能变化(△G)。能量单位用千焦(KJ)或千卡(kcal)表示。1k=0.239kcal。 从方程1可以获得标准自由能和平衡常数之间的关系。在平衡状态,自由能变化是0, 方程1可以写成:0=△G0+RTIn{[C]D]/[AB]} (2) 那么,△G=-RTln{C]D]I[AB]} (3) 因为K'eq=[CDI/{AB]} (4) 所以△Go=-RT In K'eq (5) 即△G0=-2.303 RT log K'eq (6) 重新排列成Keq=10△G0D,303RT (7) 将R=8.315x103 kJ mol-1 deg和T=298K(相当于25℃)代入方程式7,得 K'eq=10-△G05.69 (8) 其中△G0的单位是ko1,因为必须与R的单位相匹配。因此标准自由能变化与反应的 平衡常数密切相关。例如平衡常数为10,25℃时标准自由能变化值是-5.69kJmo1(表8.3)。 注意平衡常数每变化10倍,△G0就变化5.69kJmo1
8.2 自由能是理解酶的一个有用的热力学概念 第一章我们已经介绍了一些热力学原理。值得注意的概念是自由能(G)。为了了解酶 如何发挥作用,我们需要考虑化学反应的两个热力学性质:(1)产物和反应物之间的自由能 差异(△G);和(2)启动反应物生成产物需要的能量(即活化能△G*)。前者决定反应能否 进行,后者决定反应的速率。酶只改变后者。现在我们回顾一些能够用于酶的热力学原理。 自由能变化只提供反应能否进行的信息,不涉及反应速率 在前面我们曾经介绍,反映自由能变化△G 能提供反应能否进行的信息。 1. △G 小于零,反应可以发生,无需输送能量。 2. △G 等于零,系统处于平衡状态。 3. △G 大于零,反应不可能发生。必需输入能量驱动反应进行。因此是需能反应。 4. △G 只取决于反应的终止状态(产物)和起始状态(反应物),与发生反应的路径(或 分子机理)无关。反应机理不影响反应的△G。例如氧化酶氧化葡萄糖产生 CO2和 H2O 的自由能变化与葡萄糖直接燃烧产生 CO2和 H2O 的△G 值相等。 5. △G 值与反应速度没有关系。△G 小于零只是表明反应能够自动发生,但是并不涉及反 应速度。反应速度取决于活化自由能(△G*)。活化自由能与△G 没啥关系。 一个反应的标准自由能变化与平衡常数有关 很多反应的自由能变化可以计算,根据自由能变化确定反应是自主发生,还是需要输入 能量。为了确定这个重要的热力学参数,我们要考虑反应物和生成物的化学本质以及各个物 质的浓度。 A + B ===== C + D △G = △G0 + RT ln {[C] [D] / [A] [B]} (1) 其中,△G0 是标准自由能变化,R 是气体常数,T 是绝对温度,[A],[B],[C],[D]是摩尔 浓度。△G0 是反应物和生成物浓度都是 1 摩尔的标准状态下自由能的变化值。因此△G 取 决于反应物本质(方程式 1 的△G0 )和反应物浓度(方程式 1 的对数部分)。 传统上简化自由能计算。将标准状况的 pH 值定义为 7.0。如果氢离子是反应物,其活 性(或浓度)定义为 1,水的浓度(或活性)也定义为 1。本书将 pH7.0 的自由能变化定义 为标准自由能变化(△G0 ')。能量单位用千焦(KJ)或千卡(kcal)表示。1kJ = 0.239 kcal。 从方程 1 可以获得标准自由能和平衡常数之间的关系。在平衡状态,自由能变化是 0, 方程 1 可以写成: 0 = △G0 ' + RT ln {[C] [D] / [A] [B]} (2) 那么,△G0 ' = RT ln {[C] [D] / [A] [B]} (3) 因为 K'eq = [C] [D] / {[A] [B]} (4) 所以 △G0 ' = RT ln K'eq (5) 即 △G0 ' = RT log K'eq (6) 重新排列成 K'eq = 10 △G0' /2.303 RT (7) 将 R=8.315 x 10 -3 kJ mol -1 deg -1 和 T = 298 K (相当于 25℃)代入方程式 7,得 K'eq = 10 △G0' /5.69 (8) 其中△G0 ' 的单位是 kJ mol -1,因为必须与 R 的单位相匹配。因此标准自由能变化与反应的 平衡常数密切相关。例如平衡常数为 10,25℃时标准自由能变化值是5.69 kJ mol -1(表 8.3)。 注意平衡常数每变化 10 倍,△G0 ' 就变化 5.69 kJ mol -1

TABLE 8.3 Relation between AG and K'eq (at 25C) △G Keq KJ mol- kcal mol- 10-5 28.53 6.82 104 22.84 5.46 10-3 17.11 4.09 10-2 11.42 2.73 101 5.69 1.36 1 0 0 10 -5.69 -1.36 102 -11.42 -2.73 103 -17.11 -4.09 104 -22.84 -5.46 105 -28.53 -6.82 Table 8-3 007W.H.Freemanand Compery 现在计算磷酸二羟基丙酮(DHAP)异构生成甘油醛3-磷酸(GAP)的△GO和△G。这个反 应发生在糖酵解过程中。在平衡状态,GAP与DHAP的比值是0.0475(298K,pH7.0)。 因此K'eq=0.0475。标准状态自由能变化是△G0=+7.53kJmo1 因此DHAP不能自发地生成GAP,必须输入能量才能发生。现在计算起始状态DHAP 有2x104M,GAP有3x106M的自由能变化值,△G=-2.89kmo1 结果显示DHAP能够异构生成GAP,不必输入能量。注意,尽管△GO大于零,但是 △G小于零,因此反应能够自发进行。无论△G比△G大、小、还是相等,反应能否自动 进行取决于△G,而不是△G。这,点必须记住。那些根据△G不能自发进行的反映可以 通过调节反应物和生成物的浓度使之能够发生。这一原则是偶联化学反应形成代谢途径的基 础(第15章)。 酶只改变化学反应速度,并不改变化学反应平衡 酶是超级催化剂,诱使人们觉得酶具有它们自身并不具有的能力。实际上,酶不能改变 热力学法则,因此不能改变反应平衡。考察一个酶将底物S转化成产物P,用产物形成量对 时间作图(图82)。有酶,化学反应几秒钟就产生了没有酶时需要几小时甚至几年才能形成 的产量。但是我们注意到产物的最终产量不受酶影响。 Enzyme onpold No enzyme Seconds Hours Time 品 图82酶加速化学反应。无论有没有酶,化学反应都能达到同一平衡点。但是酶能够加速反 应,迅速达到反应平衡
现在计算磷酸二羟基丙酮(DHAP)异构生成甘油醛 3-磷酸(GAP)的△G0 ' 和△G。这个反 应发生在糖酵解过程中。在平衡状态,GAP 与 DHAP 的比值是 0.0475 (298K, pH7.0)。 因此 K'eq = 0.0475。标准状态自由能变化是△G0 ' = + 7.53 kJ mol -1 因此 DHAP 不能自发地生成 GAP,必须输入能量才能发生。现在计算起始状态 DHAP 有 2 x 10 -4 M, GAP 有 3 x 10 -6 M 的自由能变化值,△G = - 2.89 kJ mo l-1 结果显示 DHAP 能够异构生成 GAP,不必输入能量。注意,尽管△G0 ' 大于零,但是 △G 小于零,因此反应能够自发进行。无论△G 比△G0 ' 大、小、还是相等,反应能否自动 进行取决于△G,而不是△G0 ' 。这点必须记住。那些根据△G0 ' 不能自发进行的反映可以 通过调节反应物和生成物的浓度使之能够发生。这一原则是偶联化学反应形成代谢途径的基 础(第 15 章)。 酶只改变化学反应速度,并不改变化学反应平衡 酶是超级催化剂,诱使人们觉得酶具有它们自身并不具有的能力。实际上,酶不能改变 热力学法则,因此不能改变反应平衡。考察一个酶将底物 S 转化成产物 P,用产物形成量对 时间作图(图 8.2)。有酶,化学反应几秒钟就产生了没有酶时需要几小时甚至几年才能形成 的产量。但是我们注意到产物的最终产量不受酶影响。 图 8.2 酶加速化学反应。无论有没有酶,化学反应都能达到同一平衡点。但是酶能够加速反 应,迅速达到反应平衡

为什么产物形成量会达到平台?这时化学反应达到平衡,底物S仍然被转化成产物P, 但是产物P又以同样的速度转化成底物S,使反应体系的总产物量没有变化。 现在定量考察化学反应平衡。没有酶催化的条件下,正反应速度常数是k是104s1, 逆反应速度常数kR是106s,平衡常数K是两个速度常数的比值: 104s1 P 106s1 K=[P]/IS]=k/kR=100。 不管有没有酶,化学反应平衡时产物P的量是底物S量的100倍。有酶存在,化学反 应能够很快达到平衡(表8.1)。因此酶只能加速化学反应达到平衡,但是不能改变化学平衡 位点。平衡位点只是反应物和产物之间自由能差异。 83酶协助反应形成转化态加速化学反应 反应物和产物之间自由能差异只能解释化学反应的平衡位,点,不能解释酶促反应速度。 如何用热力学理论解释酶对化学反应的促进?这样,我们除了考虑反应的底物和产物之外, 还要考虑反应的化学途径。 化学反应将底物S转化成产物P的过程中经过转化中间态X*,其自由能比底物和产物 都高。SP* S。星号表示转化状态。转化态是处于转化结构分 子,其结构既不同于底物,也不同于产物,转化态稳定性很差,因此不被看作反应途径的一 种稳态物质,是反应过程中自由能最高的结构状态。转化态自由能与反应物自由能的差值是 活化自由能,用△G表示(图8.3)。△G=Gx-Gs Transition state,X+ △G(uncatalyzed) (catalyzed) Substrate aua AG for the reaction Product Reaction progress→ 图83酶能降低反应的活化自由能。酶通过降低活化自由能,促进化学反应。 注意活化自由能△G对化学反应的自由能改变△G没有贡献。因为将底物转化成转化态 输入的能量在转化态转化成产物时释放。活化自由能障碍首先提示酶不改变△G、促进反应 速度的机理:酶能降低反应的活化自由能,换句话说,酶有助于转化态形成。 了解酶促进反应速度,我们假定底物转化成转化态有一个平衡,即 K* S =X*------P K*是形成X*的平衡常数,V是X*形成产物的速度,与X*浓度成正比,即V∝[X*], 因为只有X*才能转化成产物。而X*浓度取决于活化自由能△G*。活化自由能愈大,X*浓 度愈低。因此反应的总速度V依赖于△G*
为什么产物形成量会达到平台?这时化学反应达到平衡,底物 S 仍然被转化成产物 P, 但是产物 P 又以同样的速度转化成底物 S,使反应体系的总产物量没有变化。 现在定量考察化学反应平衡。没有酶催化的条件下,正反应速度常数是 kF 是 10 - 4 s -1, 逆反应速度常数 kR是 10 -6 s -1,平衡常数 K 是两个速度常数的比值: 10 -4 s -1 S ============ P 10 -6 s -1 K = [P]/[S] = kF/kR = 100。 不管有没有酶,化学反应平衡时产物 P 的量是底物 S 量的 100 倍。有酶存在,化学反 应能够很快达到平衡(表 8.1)。因此酶只能加速化学反应达到平衡,但是不能改变化学平衡 位点。平衡位点只是反应物和产物之间自由能差异。 8.3 酶协助反应形成转化态加速化学反应 反应物和产物之间自由能差异只能解释化学反应的平衡位点,不能解释酶促反应速度。 如何用热力学理论解释酶对化学反应的促进?这样,我们除了考虑反应的底物和产物之外, 还要考虑反应的化学途径。 化学反应将底物 S 转化成产物 P 的过程中经过转化中间态 X*,其自由能比底物和产物 都高。 S -------- P* ----------- S。星号表示转化状态。转化态是处于转化结构分 子,其结构既不同于底物,也不同于产物,转化态稳定性很差,因此不被看作反应途径的一 种稳态物质,是反应过程中自由能最高的结构状态。转化态自由能与反应物自由能的差值是 活化自由能,用△G*表示(图 8.3)。△G* = Gx*- Gs 图 8.3 酶能降低反应的活化自由能。酶通过降低活化自由能,促进化学反应。 注意活化自由能△G*对化学反应的自由能改变△G 没有贡献。因为将底物转化成转化态 输入的能量在转化态转化成产物时释放。活化自由能障碍首先提示酶不改变△G、促进反应 速度的机理:酶能降低反应的活化自由能,换句话说,酶有助于转化态形成。 了解酶促进反应速度,我们假定底物转化成转化态有一个平衡,即 K* v S ===== X* -------- P K*是形成 X*的平衡常数,v 是 X*形成产物的速度,与 X*浓度成正比,即 v ∝ [X*], 因为只有 X*才能转化成产物。而 X*浓度取决于活化自由能△G*。活化自由能愈大,X*浓 度愈低。因此反应的总速度 V 依赖于△G*
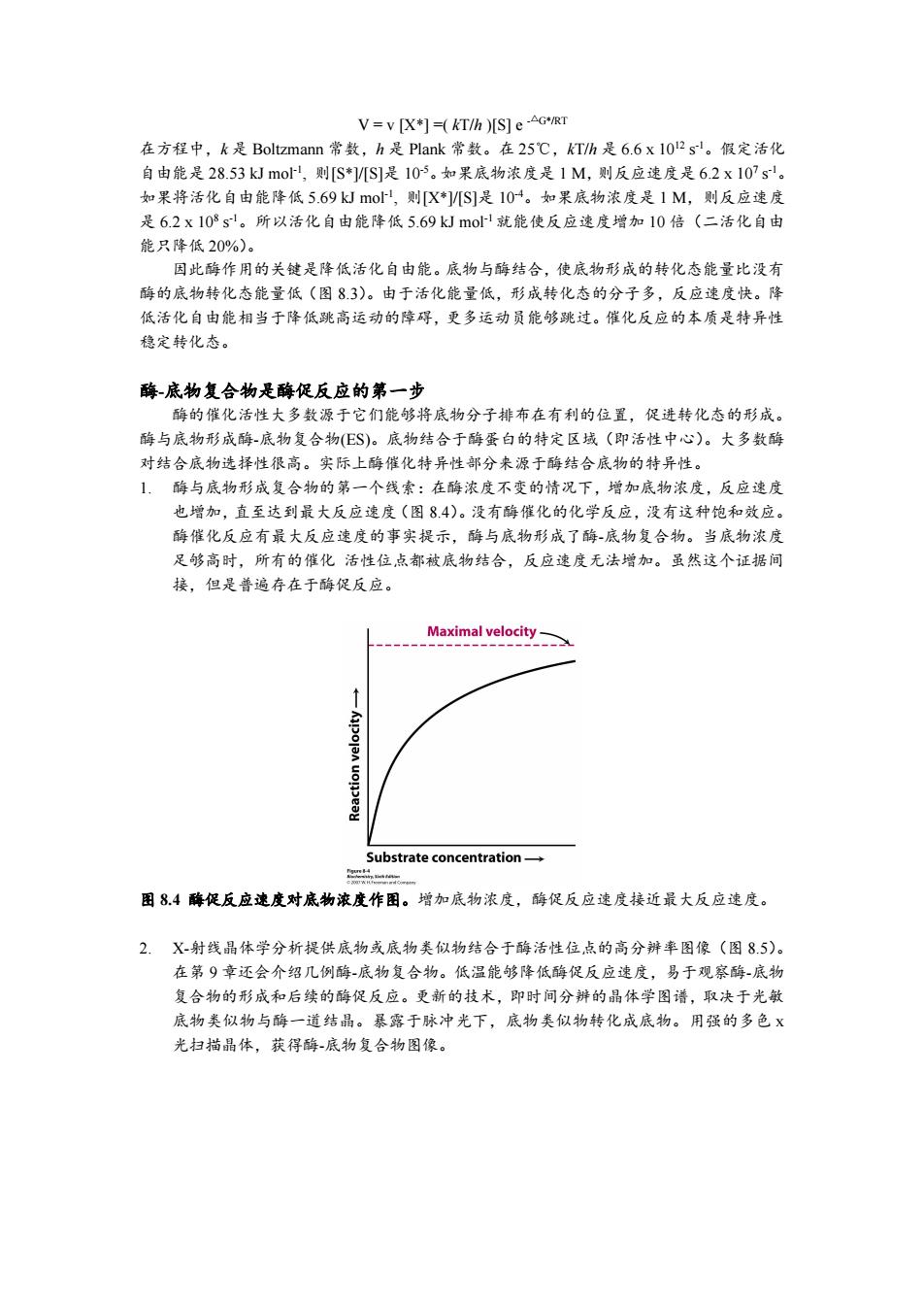
V=v [X+]=(KT/h )[s]e-AG*/RT 在方程中,k是Boltzmann常数,h是Plank常数。在25℃,kT/h是6.6x1012sl。假定活化 自由能是28.53kJmo,则[S*]/[S]是105。如果底物浓度是1M,则反应速度是6.2x107s'。 如果将活化自由能降低5.69kmo,则[X*/[S]是104。如果底物浓度是1M,则反应速度 是6.2x108s。所以活化自由能降低5.69 kJ mol-1就能使反应速度增加10倍(二活化自由 能只降低20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图83)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(E$)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1,酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 Maximal velocity- Substrate concentration- g点= 困8.4酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2.X-射线晶体学分析提供底物或底物类似物结合于酶活性位,点的高分辨率图像(图8.5)。 在第9章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色X 光扫描晶体,获得酶-底物复合物图像
V = v [X*] =( kT/h )[S] e -△G*/RT 在方程中,k 是 Boltzmann 常数,h 是 Plank 常数。在 25℃,kT/h 是 6.6 x 10 12 s -1。假定活化 自由能是 28.53 kJ mol -1 , 则[S*]/[S]是 10 -5。如果底物浓度是 1 M,则反应速度是 6.2 x 10 7 s -1。 如果将活化自由能降低 5.69 kJ mol -1 , 则[X*]/[S]是 10 -4。如果底物浓度是 1 M,则反应速度 是 6.2 x 10 8 s -1。所以活化自由能降低 5.69 kJ mol -1 就能使反应速度增加 10 倍(二活化自由 能只降低 20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图 8.3)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶-底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(ES)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1. 酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图 8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化 活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 图 8.4 酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2. X-射线晶体学分析提供底物或底物类似物结合于酶活性位点的高分辨率图像(图 8.5)。 在第 9 章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色 x 光扫描晶体,获得酶-底物复合物图像
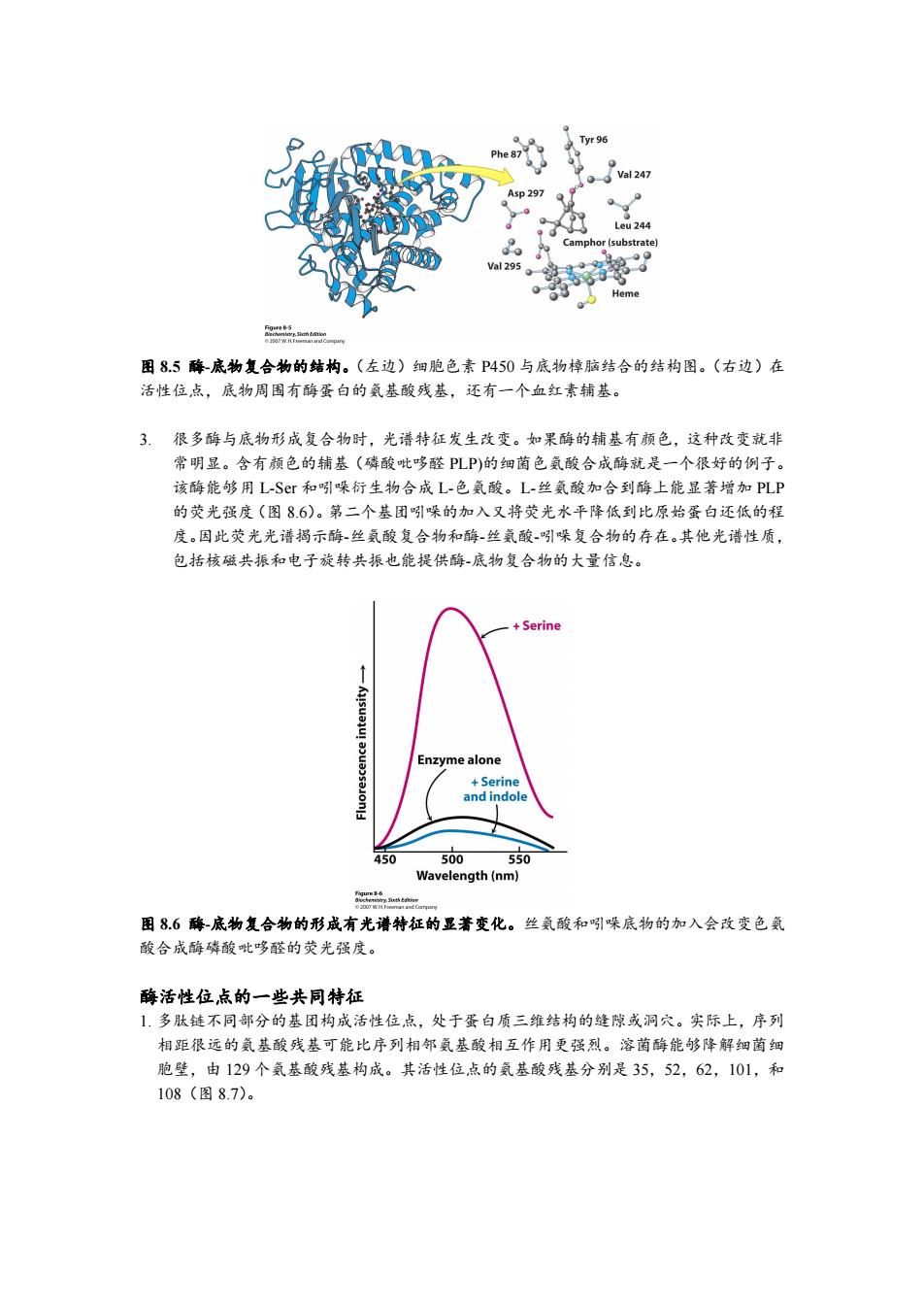
al247 sp297 eu244 phor(substrate) val295. 0 Heme 点 图8.5酶-底物复合物的结构。(左边)细胞色素P450与底物樟脑结合的结构图。(右边)在 活性位点,底物周围有酶蛋白的氨基酸残基,还有一个血红素辅基。 3.很多酶与底物形成复合物时,光谱特征发生改变。如果酶的辅基有颜色,这种改变就非 常明显。含有颜色的辅基(磷酸吡哆醛PLP)的细菌色氨酸合成酶就是一个很好的例子。 该酶能够用L-Sr和吲哚衍生物合成L-色氨酸。L-丝氨酸加合到酶上能显著增加PLP 的荧光强度(图8.6)。第二个基团吲引哚的加入又将荧光水平降低到比原始蛋白还低的程 度。因此荧光光谱揭示酶-丝氨酸复合物和酶-丝氨酸吲引哚复合物的存在。其他光谱性质, 包括核磁共振和电子旋转共振也能提供酶-底物复合物的大量信息。 +Serine Enzyme alone +Serine and indole 450 500 550 Wavelength(nm) btm 国86酶-底物复合物的形成有光谱特征的显著变化。丝氨酸和吲哚底物的加入会改变色氨 酸合成酶磷酸吡哆醛的荧光强度。 酶活性位,点的一些共同特征 1.多肽链不同部分的基团构成活性位点,处于蛋白质三维结构的缝隙或洞穴。实际上,序列 相距很远的氨基酸残基可能比序列相邻氨基酸相互作用更强烈。溶菌酶能够降解细菌细 胞壁,由129个氨基酸残基构成。其活性位点的氨基酸残基分别是35,52,62,101,和 108(图8.7)
图 8.5 酶-底物复合物的结构。(左边)细胞色素 P450 与底物樟脑结合的结构图。(右边)在 活性位点,底物周围有酶蛋白的氨基酸残基,还有一个血红素辅基。 3. 很多酶与底物形成复合物时,光谱特征发生改变。如果酶的辅基有颜色,这种改变就非 常明显。含有颜色的辅基(磷酸吡哆醛 PLP)的细菌色氨酸合成酶就是一个很好的例子。 该酶能够用 L-Ser 和吲哚衍生物合成 L-色氨酸。L-丝氨酸加合到酶上能显著增加 PLP 的荧光强度(图 8.6)。第二个基团吲哚的加入又将荧光水平降低到比原始蛋白还低的程 度。因此荧光光谱揭示酶-丝氨酸复合物和酶-丝氨酸-吲哚复合物的存在。其他光谱性质, 包括核磁共振和电子旋转共振也能提供酶-底物复合物的大量信息。 图 8.6 酶-底物复合物的形成有光谱特征的显著变化。丝氨酸和吲哚底物的加入会改变色氨 酸合成酶磷酸吡哆醛的荧光强度。 酶活性位点的一些共同特征 1. 多肽链不同部分的基团构成活性位点,处于蛋白质三维结构的缝隙或洞穴。实际上,序列 相距很远的氨基酸残基可能比序列相邻氨基酸相互作用更强烈。溶菌酶能够降解细菌细 胞壁,由 129 个氨基酸残基构成。其活性位点的氨基酸残基分别是 35,52,62,101,和 108(图 8.7)

(A) (B)N 355262,63101108129 图8.7活性位点包括氯基酸序列相差很远的氯基酸残基。(A)溶菌酶的绸缎结构示意图。 活性位,点的几个组分用颜色标出。(B)溶菌酶一级结构示意图显示,活性位点的氨基酸残 基处于多肽链不同区域。 2.活性位点只占酶分子体积的很小一部分。酶分子的大多数氨基酸残基不与底物接触,那么 酶为什么要做成这么大?几乎所有酶的长度都超过100个氨基酸残基,其质量超过10kD, 直径超过25A。活性位点之外的“额外”氨基酸充当分子骨架,使一级结构上差距很远的氨 基酸能够在一块购建成活性位点。而一级结构上相邻的氨基酸因空间障碍,无法构建出 活性位点必须的空间排列。很多蛋白质中,余下的氨基酸还构建酶分子的调节位点、与 其他蛋白质相互作用位点、或者将底物分子带入活性位,点的通道。 3.活性位点有独特的微环境。在结构已知的所有酶分子中,底物分子结合于酶分子的缝隙或 洞穴。除非水是反应物,这些缝隙或洞穴没有水分子。这些缝隙非极性的微环境促进底 物与酶分子之间的结合,有利于催化。然而,缝隙也可能含有极性残基。在活性位点所 处于的非极性微环境中,一些极性残基具有特别的性质,这些性质对底物结合或催化化 学反应是必需的。极性残基在分子内部的位置并不遵循暴露于水的极性氨基酸残基排布 的通用原则。 4.多种弱相互作用使底物与酶结合。ES复合物中分子间的非共价相互作用比共价键弱得多。 共价键能量介于-210至-460kmol之间。相反,ES复合物的解离常数是10-2至10-8M 之间,自由能只有-13至-50kJmo。如同1.3节所介绍的,这些弱的、可逆的相互作 用包括静电相互作用、氢镀、van der Waals力、和疏水力。当大量底物原子同时与酶分子 的很多原子同时接触,van der Waals力就是很显著的酶-底物复合物的结合力。因此,酶 与底物得有互补的外形。酶与底物分子间形成的氢键具有方向性,这个特征常常能够强 化酶促作用特异性,如降解RNA的核糖核酸酶(图8.8)。 Uracil (from substrate) Threo side chain Serine side chain 图88酶和底物之间形成的直健。核糖核酸酶与核酸底物的尿嘧啶之间形成氢键
图 8.7 活性位点包括氨基酸序列相差很远的氨基酸残基。(A)溶菌酶的绸缎结构示意图。 活性位点的几个组分用颜色标出。(B)溶菌酶一级结构示意图显示,活性位点的氨基酸残 基处于多肽链不同区域。 2. 活性位点只占酶分子体积的很小一部分。酶分子的大多数氨基酸残基不与底物接触,那么 酶为什么要做成这么大?几乎所有酶的长度都超过 100 个氨基酸残基,其质量超过 10kD, 直径超过 25A。活性位点之外的“额外”氨基酸充当分子骨架,使一级结构上差距很远的氨 基酸能够在一块购建成活性位点。而一级结构上相邻的氨基酸因空间障碍,无法构建出 活性位点必须的空间排列。很多蛋白质中,余下的氨基酸还构建酶分子的调节位点、与 其他蛋白质相互作用位点、或者将底物分子带入活性位点的通道。 3. 活性位点有独特的微环境。在结构已知的所有酶分子中,底物分子结合于酶分子的缝隙或 洞穴。除非水是反应物,这些缝隙或洞穴没有水分子。这些缝隙非极性的微环境促进底 物与酶分子之间的结合,有利于催化。然而,缝隙也可能含有极性残基。在活性位点所 处于的非极性微环境中,一些极性残基具有特别的性质,这些性质对底物结合或催化化 学反应是必需的。极性残基在分子内部的位置并不遵循暴露于水的极性氨基酸残基排布 的通用原则。 4. 多种弱相互作用使底物与酶结合。ES 复合物中分子间的非共价相互作用比共价键弱得多。 共价键能量介于-210 至 -460 kJ mol -1 之间。相反,ES 复合物的解离常数是 10 -2至 10 -8M 之间,自由能只有-13 至 -50 kJ mol -1。如同 1.3 节所介绍的,这些弱的、可逆的相互作 用包括静电相互作用、氢键、van der Waals 力、和疏水力。当大量底物原子同时与酶分子 的很多原子同时接触,van der Waals 力就是很显著的酶-底物复合物的结合力。因此,酶 与底物得有互补的外形。酶与底物分子间形成的氢键具有方向性,这个特征常常能够强 化酶促作用特异性,如降解 RNA 的核糖核酸酶(图 8.8)。 图 8.8 酶和底物之间形成的氢键。核糖核酸酶与核酸底物的尿嘧啶之间形成氢键
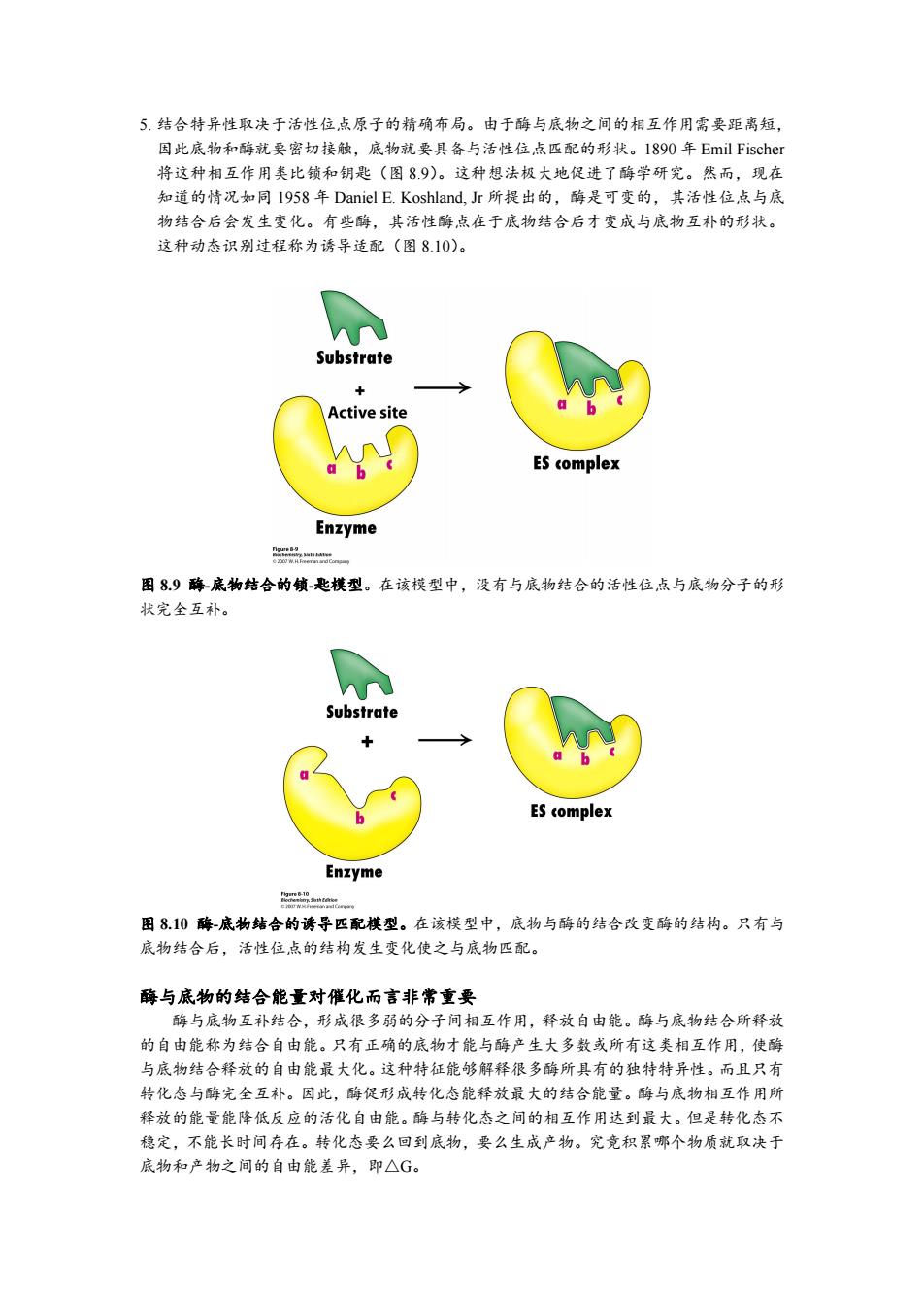
5.结合特异性取决于活性位,点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890年Emil Fischer 将这种相互作用类比锁和钥匙(图89)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同I958年Daniel E.Koshland,Jr所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图8.10)。 Substrate + Active site ES complex Enzyme 品 图89酶底物结合的饿-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 Substrate ES complex Enzyme 图810酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G
5. 结合特异性取决于活性位点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890 年 Emil Fischer 将这种相互作用类比锁和钥匙(图 8.9)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同 1958 年 Daniel E. Koshland, Jr 所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图 8.10)。 图 8.9 酶-底物结合的锁-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 图 8.10 酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G