
第9章催化机制 国际象棋和酶都使用策略,国际象棋通过比赛来发展策略,而酶是通过进化来建立酶促反应 机制。右边是能够酶切肽键的活性位点,由三个氨基酸残基(化学键是白色)构成。用黑色 化学键表示的底物分子如同左边象棋比赛中已经落入圈套的国王,面临被裂解的命运。 酶催化效率和特异性的基础是什么?本章介绍四类酶促反应的机制,包括丝氨酸蛋白 酶、碳酸脱水酶、限制性核酸内切酶、和核苷单磷酸激酶。前三类酶催化的化学反应将水分 子加成到底物分子上,第四类酶要避免水分子的加成。经过大量的实验研究(包括蛋白质结 构测定、定点突变),这些酶的催化机制已经清楚。这些酶的催化机制阐述了很多重要的催 化原理。我们将看到,酶采用结合能、诱导匹配、和一些特殊的催化策略,协助底物形成转 化态。 每类酶采用的机制就是要解决各种化学反应所面临的问题。丝氨酸蛋白酶的例子是胰凝 乳蛋白酶,就是要将缺乏催化剂和pH7.0几乎不发生的反应(蛋白质水解)进行下去。碳酸 脱水酶需要将化学反应加速到能够与其他快速生理过程融合的水平。而限制性内切酶如 EcoRV要解决的问题是实现酶切反应的高度特异性。最后一类酶如NMP激酶,要解决的问 题是在转移磷酸的过程中,磷酸基团从ATP转移给另一个核苷酸(而不会转移到水分子)。 选来讲解的酶是各自酶家族的代表性成员。酶家族成员之间比较揭示如何进化产生、如何优 化酶活性位点。酶作用的结构和酶促机理比较能够了解酶的进化史。此外,催化机制知识有 实际应用价值,包括开发特异性强的有效抑制剂用作药物。最后,虽然我们没有特别介绍催 化RNA分子,但是蛋白质酶所采用的催化原则同样适用于RNA催化剂。 很多酶采用的几个基本的催化原则 在第8章我们知道底物与酶结合启动催化。结合能是酶和底物之间形成大量弱相互作用 所释放的自由能。这种结合能既可建立底物特异性,又能增加酶促效率。只有正确的底物才 能与酶形成大多数甚至全部酶-底物相互作用,使结合能最大化。这点能够解释很多酶的底 物特异性。而且,当底物转化成转化态,底物与酶之间完全互补。因此酶和底物之间的相互 作用稳定转化态,从而降低反应的活化自由能。结合能对酶分子和底物的结构变化都有促进 作用,使它们相互间匹配度更高(诱导匹配),有助于催化反应。酶通常采用下列一种或几 种策略催化特定化学反应。 1.共价催化。共价催化的活性位点有活泼基团,通常是很强的亲核基团。在酶促过程中亲 核基团能暂时性共价连接底物。胰凝乳蛋白酶就采用这种策略。 2.酸碱催化。酸碱催化中,水分子之外的物质提供质子或接受质子。胰凝乳蛋白酶使用一
第 9 章 催化机制 国际象棋和酶都使用策略,国际象棋通过比赛来发展策略,而酶是通过进化来建立酶促反应 机制。右边是能够酶切肽键的活性位点,由三个氨基酸残基(化学键是白色)构成。用黑色 化学键表示的底物分子如同左边象棋比赛中已经落入圈套的国王,面临被裂解的命运。 酶催化效率和特异性的基础是什么?本章介绍四类酶促反应的机制,包括丝氨酸蛋白 酶、碳酸脱水酶、限制性核酸内切酶、和核苷单磷酸激酶。前三类酶催化的化学反应将水分 子加成到底物分子上,第四类酶要避免水分子的加成。经过大量的实验研究(包括蛋白质结 构测定、定点突变),这些酶的催化机制已经清楚。这些酶的催化机制阐述了很多重要的催 化原理。我们将看到,酶采用结合能、诱导匹配、和一些特殊的催化策略,协助底物形成转 化态。 每类酶采用的机制就是要解决各种化学反应所面临的问题。丝氨酸蛋白酶的例子是胰凝 乳蛋白酶,就是要将缺乏催化剂和 pH 7.0 几乎不发生的反应(蛋白质水解)进行下去。碳酸 脱水酶需要将化学反应加速到能够与其他快速生理过程融合的水平。而限制性内切酶如 EcoRV 要解决的问题是实现酶切反应的高度特异性。最后一类酶如 NMP 激酶,要解决的问 题是在转移磷酸的过程中,磷酸基团从 ATP 转移给另一个核苷酸(而不会转移到水分子)。 选来讲解的酶是各自酶家族的代表性成员。酶家族成员之间比较揭示如何进化产生、如何优 化酶活性位点。酶作用的结构和酶促机理比较能够了解酶的进化史。此外,催化机制知识有 实际应用价值,包括开发特异性强的有效抑制剂用作药物。最后,虽然我们没有特别介绍催 化 RNA 分子,但是蛋白质酶所采用的催化原则同样适用于 RNA 催化剂。 很多酶采用的几个基本的催化原则 在第 8 章我们知道底物与酶结合启动催化。结合能是酶和底物之间形成大量弱相互作用 所释放的自由能。这种结合能既可建立底物特异性,又能增加酶促效率。只有正确的底物才 能与酶形成大多数甚至全部酶-底物相互作用,使结合能最大化。这点能够解释很多酶的底 物特异性。而且,当底物转化成转化态,底物与酶之间完全互补。因此酶和底物之间的相互 作用稳定转化态,从而降低反应的活化自由能。结合能对酶分子和底物的结构变化都有促进 作用,使它们相互间匹配度更高(诱导匹配),有助于催化反应。酶通常采用下列一种或几 种策略催化特定化学反应。 1. 共价催化。共价催化的活性位点有活泼基团,通常是很强的亲核基团。在酶促过程中亲 核基团能暂时性共价连接底物。胰凝乳蛋白酶就采用这种策略。 2. 酸碱催化。酸碱催化中,水分子之外的物质提供质子或接受质子。胰凝乳蛋白酶使用一
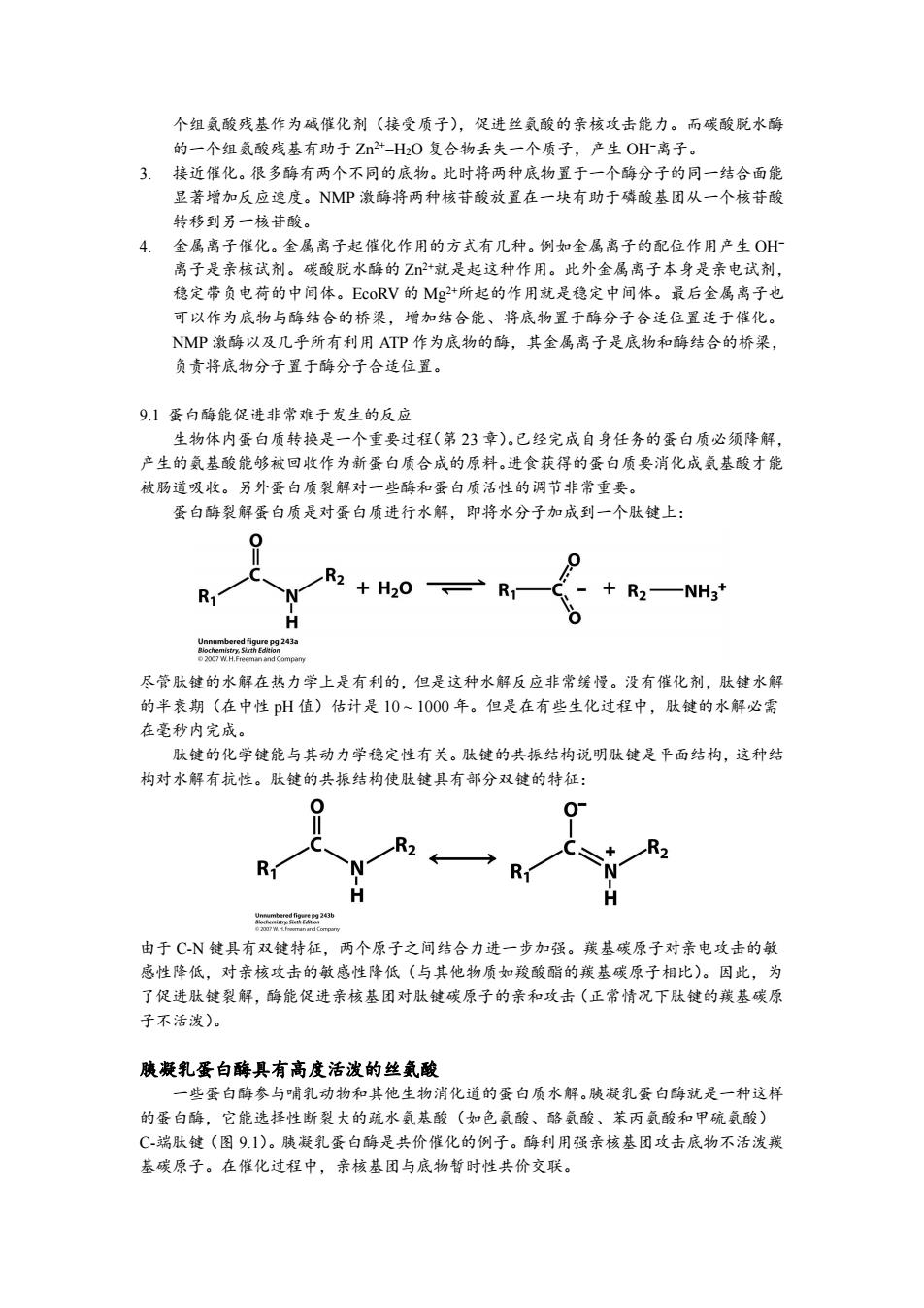
个组氨酸残基作为碱催化剂(接受质子),促进丝氨酸的亲核攻击能力。而碳酸脱水酶 的一个组氨酸残基有助于Z+-H20复合物丢失一个质子,产生OH离子。 3.接近催化。很多酶有两个不同的底物。此时将两种底物置于一个酶分子的同一结合面能 显著增加反应速度。NMP激酶将两种核苷酸放置在一块有助于磷酸基团从一个核苷酸 转移到另一核苷酸。 4.金属离子催化。金属离子起催化作用的方式有几种。例如金属离子的配位作用产生OH 离子是亲核试剂。碳酸脱水酶的Z+就是起这种作用。此外金属离子本身是亲电试剂, 稳定带负电荷的中间体。EcoRV的Mg+所起的作用就是稳定中间体。最后金属离子也 可以作为底物与酶结合的桥梁,增加结合能、将底物置于酶分子合适位置适于催化。 NMP激酶以及几乎所有利用ATP作为底物的酶,其金属离子是底物和酶结合的桥梁, 负责将底物分子置于酶分子合适位置。 9.1蛋白酶能促进非常难于发生的反应 生物体内蛋白质转换是一个重要过程(第23章)。已经完成自身任务的蛋白质必须降解, 产生的氨基酸能够被回收作为新蛋白质合成的原料。进食获得的蛋白质要消化成氨基酸才能 被肠道吸收。另外蛋白质裂解对一些酶和蛋白质活性的调节非常重要。 蛋白酶裂解蛋白质是对蛋白质进行水解,即将水分子加成到一个肽键上: R R2+H2O R2—NH3* ochem 2007 W.H.Freeman and Compamy 尽管肽键的水解在热力学上是有利的,但是这种水解反应非常缓慢。没有催化剂,肽键水解 的半衰期(在中性pH值)估计是10~1000年。但是在有些生化过程中,肽键的水解必需 在毫秒内完成。 肽键的化学键能与其动力学稳定性有关。肽键的共振结构说明肽键是平面结构,这种结 构对水解有抗性。肽键的共振结构使肽键具有部分双键的特征: R2 R R 由于C-N键具有双键特征,两个原子之间结合力进一步加强。羰基碳原子对亲电攻击的敏 感性降低,对亲核攻击的敏感性降低(与其他物质如羧酸酯的羰基碳原子相比)。因此,为 了促进肽键裂解,酶能促进亲核基团对肽镀碳原子的亲和攻击(正常情况下肽键的羰基碳原 子不活泼)。 胰凝乳蛋白酶具有高度活泼的丝氨酸 一些蛋白酶参与哺乳动物和其他生物消化道的蛋白质水解。腋凝乳蛋白酶就是一种这样 的蛋白酶,它能选择性断裂大的疏水氨基酸(如色氨酸、酪氨酸、苯丙氨酸和甲硫氨酸) C-端肽键(图91)。胰凝乳蛋白酶是共价催化的例子。酶利用强亲核基团攻击底物不活泼羰 基碳原子。在催化过程中,亲核基团与底物暂时性共价交联
个组氨酸残基作为碱催化剂(接受质子),促进丝氨酸的亲核攻击能力。而碳酸脱水酶 的一个组氨酸残基有助于 Zn 2+H2O 复合物丢失一个质子,产生 OH离子。 3. 接近催化。很多酶有两个不同的底物。此时将两种底物置于一个酶分子的同一结合面能 显著增加反应速度。NMP 激酶将两种核苷酸放置在一块有助于磷酸基团从一个核苷酸 转移到另一核苷酸。 4. 金属离子催化。金属离子起催化作用的方式有几种。例如金属离子的配位作用产生 OH 离子是亲核试剂。碳酸脱水酶的 Zn 2+就是起这种作用。此外金属离子本身是亲电试剂, 稳定带负电荷的中间体。EcoRV 的 Mg 2+所起的作用就是稳定中间体。最后金属离子也 可以作为底物与酶结合的桥梁,增加结合能、将底物置于酶分子合适位置适于催化。 NMP 激酶以及几乎所有利用 ATP 作为底物的酶,其金属离子是底物和酶结合的桥梁, 负责将底物分子置于酶分子合适位置。 9.1 蛋白酶能促进非常难于发生的反应 生物体内蛋白质转换是一个重要过程(第 23 章)。已经完成自身任务的蛋白质必须降解, 产生的氨基酸能够被回收作为新蛋白质合成的原料。进食获得的蛋白质要消化成氨基酸才能 被肠道吸收。另外蛋白质裂解对一些酶和蛋白质活性的调节非常重要。 蛋白酶裂解蛋白质是对蛋白质进行水解,即将水分子加成到一个肽键上: 尽管肽键的水解在热力学上是有利的,但是这种水解反应非常缓慢。没有催化剂,肽键水解 的半衰期(在中性 pH 值)估计是 10 ~ 1000 年。但是在有些生化过程中,肽键的水解必需 在毫秒内完成。 肽键的化学键能与其动力学稳定性有关。肽键的共振结构说明肽键是平面结构,这种结 构对水解有抗性。肽键的共振结构使肽键具有部分双键的特征: 由于 C-N 键具有双键特征,两个原子之间结合力进一步加强。羰基碳原子对亲电攻击的敏 感性降低,对亲核攻击的敏感性降低(与其他物质如羧酸酯的羰基碳原子相比)。因此,为 了促进肽键裂解,酶能促进亲核基团对肽键碳原子的亲和攻击(正常情况下肽键的羰基碳原 子不活泼)。 胰凝乳蛋白酶具有高度活泼的丝氨酸 一些蛋白酶参与哺乳动物和其他生物消化道的蛋白质水解。胰凝乳蛋白酶就是一种这样 的蛋白酶,它能选择性断裂大的疏水氨基酸(如色氨酸、酪氨酸、苯丙氨酸和甲硫氨酸) C-端肽键(图 9.1)。胰凝乳蛋白酶是共价催化的例子。酶利用强亲核基团攻击底物不活泼羰 基碳原子。在催化过程中,亲核基团与底物暂时性共价交联
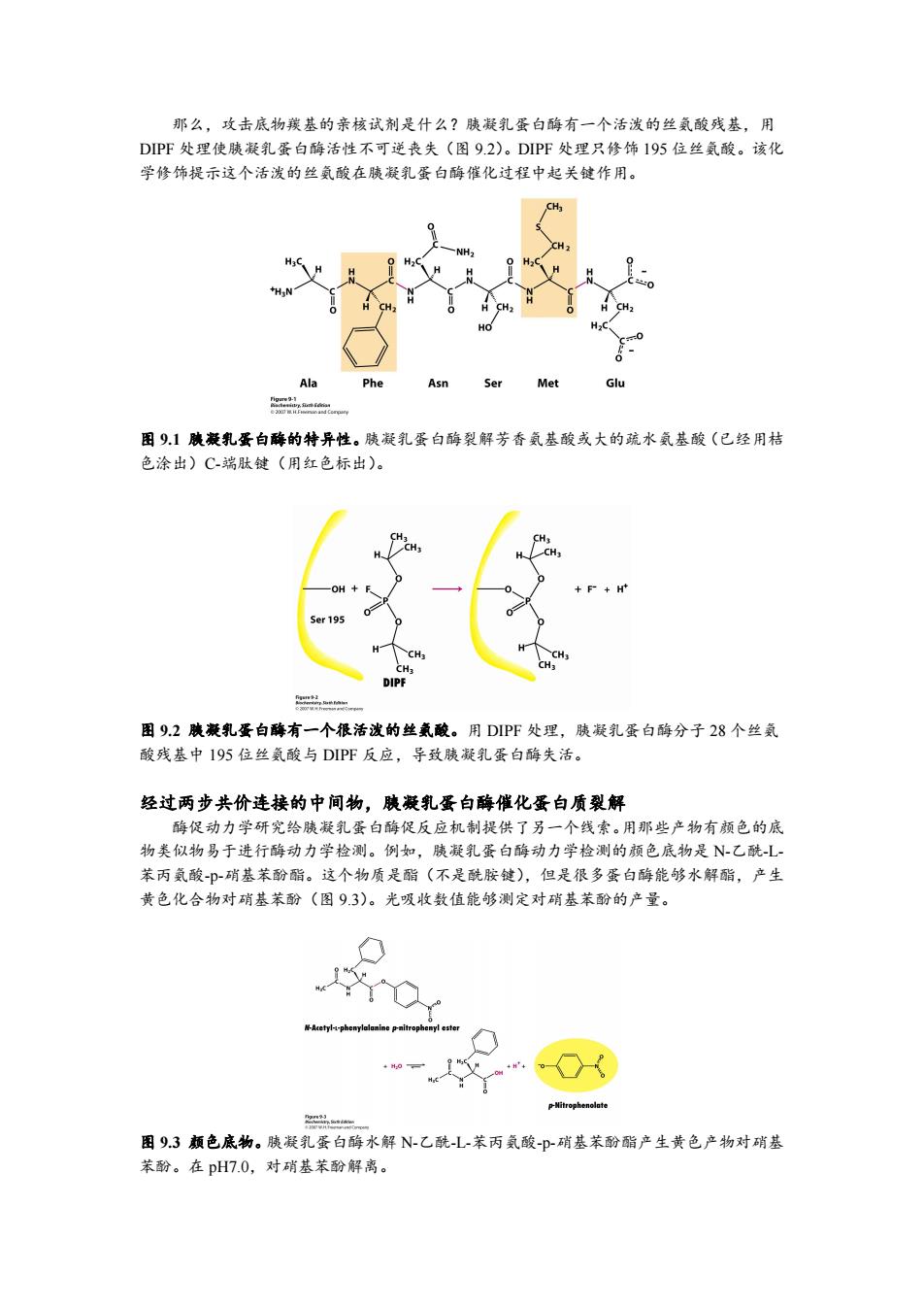
那么,攻击底物羰基的亲核试剂是什么?胰凝乳蛋白酶有一个活泼的丝氨酸残基,用 DPF处理使胰凝乳蛋白酶活性不可逆丧失(图9.2)。DIPF处理只修饰195位丝氨酸。该化 学修饰提示这个活泼的丝氨酸在胰凝乳蛋白酶催化过程中起关键作用。 Ala Phe Asn Ser Met Glu 图91胰凝乳蛋白酶的特异性。胰凝乳蛋白酶裂解芳香氨基酸或大的疏水氨基酸(已经用桔 色涂出)C-端肽键(用红色标出)。 CHs CH3 +F-+H+ 5er195 H CH3 CH3 CH: CH3 DIPF 图9.2胰藏乳蛋白酶有一个很活泼的丝氨酸。用DIP℉处理,胰凝乳蛋白酶分子28个丝氨 酸残基中195位丝氨酸与DIPF反应,导致胰凝乳蛋白酶失活。 经过两步共价连接的中间物,胰凝乳蛋白酶催化蛋白质裂解 酶促动力学研究给胰凝乳蛋白酶促反应机制提供了另一个线索。用那些产物有颜色的底 物类似物易于进行酶动力学检测。例如,胰凝乳蛋白酶动力学检测的颜色底物是N-乙酰L~ 苯丙氨酸-P-硝基苯酚酯。这个物质是酯(不是酰胺键),但是很多蛋白酶能够水解酯,产生 黄色化合物对硝基苯酚(图9.3)。光吸收数值能够测定对硝基苯酚的产量。 子Acetyl-- p-Mitrophenolate 2品 图9.3颠色底物。胰凝乳蛋白酶水解N-乙酰L-苯丙氨酸-p-硝基苯酚酯产生黄色产物对硝基 苯酚。在pH7.0,对硝基苯酚解离
那么,攻击底物羰基的亲核试剂是什么?胰凝乳蛋白酶有一个活泼的丝氨酸残基,用 DIPF 处理使胰凝乳蛋白酶活性不可逆丧失(图 9.2)。DIPF 处理只修饰 195 位丝氨酸。该化 学修饰提示这个活泼的丝氨酸在胰凝乳蛋白酶催化过程中起关键作用。 图 9.1 胰凝乳蛋白酶的特异性。胰凝乳蛋白酶裂解芳香氨基酸或大的疏水氨基酸(已经用桔 色涂出)C-端肽键(用红色标出)。 图 9.2 胰凝乳蛋白酶有一个很活泼的丝氨酸。用 DIPF 处理,胰凝乳蛋白酶分子 28 个丝氨 酸残基中 195 位丝氨酸与 DIPF 反应,导致胰凝乳蛋白酶失活。 经过两步共价连接的中间物,胰凝乳蛋白酶催化蛋白质裂解 酶促动力学研究给胰凝乳蛋白酶促反应机制提供了另一个线索。用那些产物有颜色的底 物类似物易于进行酶动力学检测。例如,胰凝乳蛋白酶动力学检测的颜色底物是 N-乙酰-L- 苯丙氨酸-p-硝基苯酚酯。这个物质是酯(不是酰胺键),但是很多蛋白酶能够水解酯,产生 黄色化合物对硝基苯酚(图 9.3)。光吸收数值能够测定对硝基苯酚的产量。 图 9.3 颜色底物。胰凝乳蛋白酶水解 N-乙酰-L-苯丙氨酸-p-硝基苯酚酯产生黄色产物对硝基 苯酚。在 pH7.0,对硝基苯酚解离
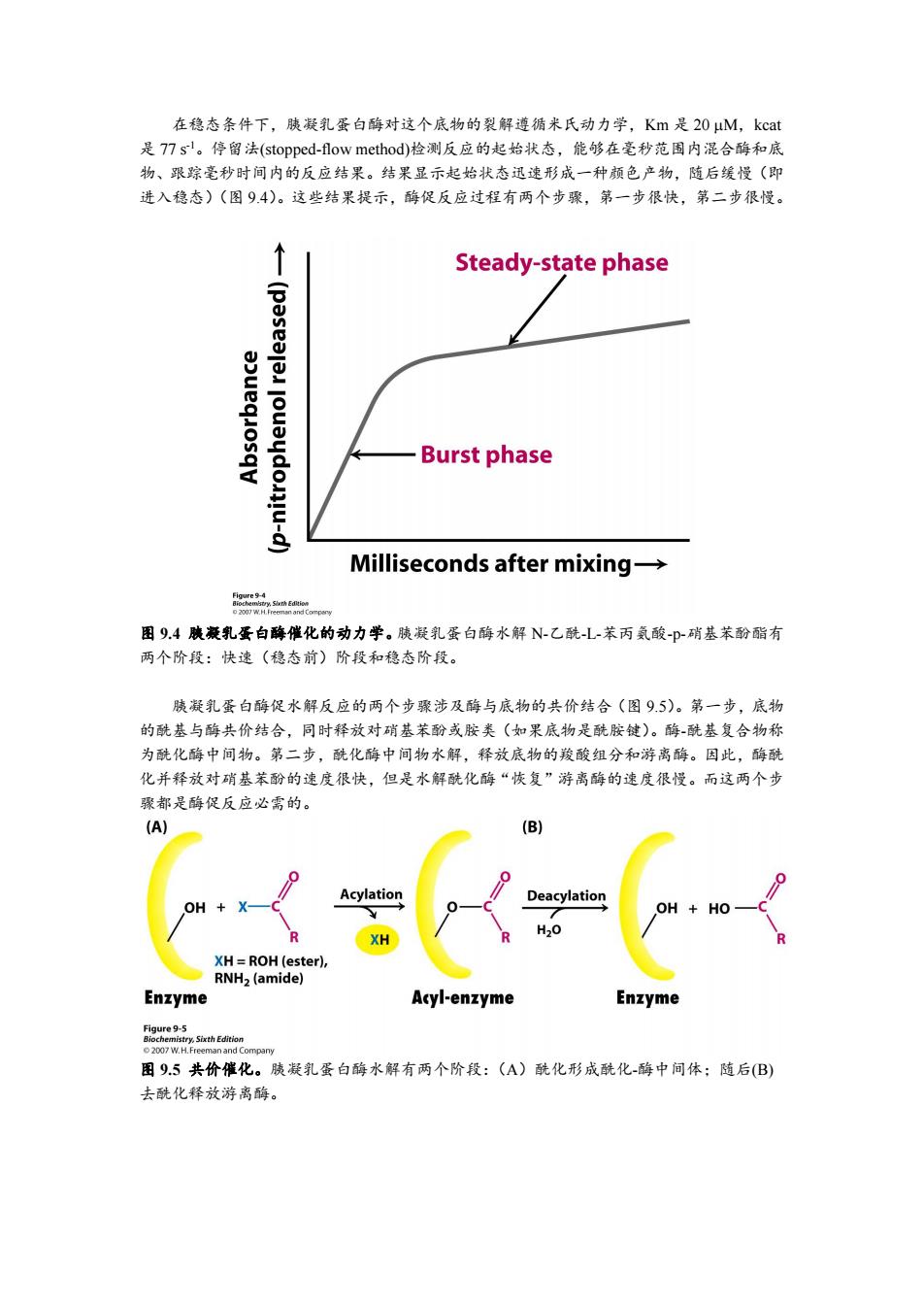
在稳态条件下,胰凝乳蛋白酶对这个底物的裂解遵循米氏动力学,Km是20uM,kcat 是T7sl。停留法(stopped-flow method)检测反应的起始状态,能够在毫秒范围内混合酶和底 物、跟踪毫秒时间内的反应结果。结果显示起始状态迅速形成一种颜色产物,随后缓慢(即 进入稳态)(图9.4)。这些结果提示,酶促反应过程有两个步骤,第一步很快,第二步很慢。 Steady-state phase Burst phase Milliseconds after mixing- 图9.4胰兼乳蛋白酶催化的动力学。胰凝乳蛋白酶水解N-乙酰L-苯丙氨酸-p-硝基苯酚酯有 两个阶段:快速(稳态前)阶段和稳态阶段。 胰凝乳蛋白酶促水解反应的两个步骤涉及酶与底物的共价结合(图9.5)。第一步,底物 的酰基与酶共价结合,同时释放对硝基苯酚或胺类(如果底物是酰胺键)。酶-酰基复合物称 为酰化酶中间物。第二步,酰化酶中间物水解,释放底物的羧酸组分和游离酶。因此,酶酰 化并释放对硝基苯酚的速度很快,但是水解酰化酶“恢复”游离酶的速度很慢。而这两个步 骤都是酶促反应必需的。 (A) (B) Acylation Deacylation OH XH XH=ROH(ester), RNH2(amide) Enzyme Acyl-enzyme Enzyme Figure 9-5 图95共价催化。胰凝乳蛋白酶水解有两个阶段:(A)酰化形成酰化-酶中间体;随后(B) 去酰化释放游离酶
在稳态条件下,胰凝乳蛋白酶对这个底物的裂解遵循米氏动力学,Km 是 20 M,kcat 是 77 s -1。停留法(stopped-flow method)检测反应的起始状态,能够在毫秒范围内混合酶和底 物、跟踪毫秒时间内的反应结果。结果显示起始状态迅速形成一种颜色产物,随后缓慢(即 进入稳态)(图 9.4)。这些结果提示,酶促反应过程有两个步骤,第一步很快,第二步很慢。 图 9.4 胰凝乳蛋白酶催化的动力学。胰凝乳蛋白酶水解 N-乙酰-L-苯丙氨酸-p-硝基苯酚酯有 两个阶段:快速(稳态前)阶段和稳态阶段。 胰凝乳蛋白酶促水解反应的两个步骤涉及酶与底物的共价结合(图 9.5)。第一步,底物 的酰基与酶共价结合,同时释放对硝基苯酚或胺类(如果底物是酰胺键)。酶-酰基复合物称 为酰化酶中间物。第二步,酰化酶中间物水解,释放底物的羧酸组分和游离酶。因此,酶酰 化并释放对硝基苯酚的速度很快,但是水解酰化酶“恢复”游离酶的速度很慢。而这两个步 骤都是酶促反应必需的。 图 9.5 共价催化。胰凝乳蛋白酶水解有两个阶段:(A)酰化形成酰化-酶中间体;随后(B) 去酰化释放游离酶
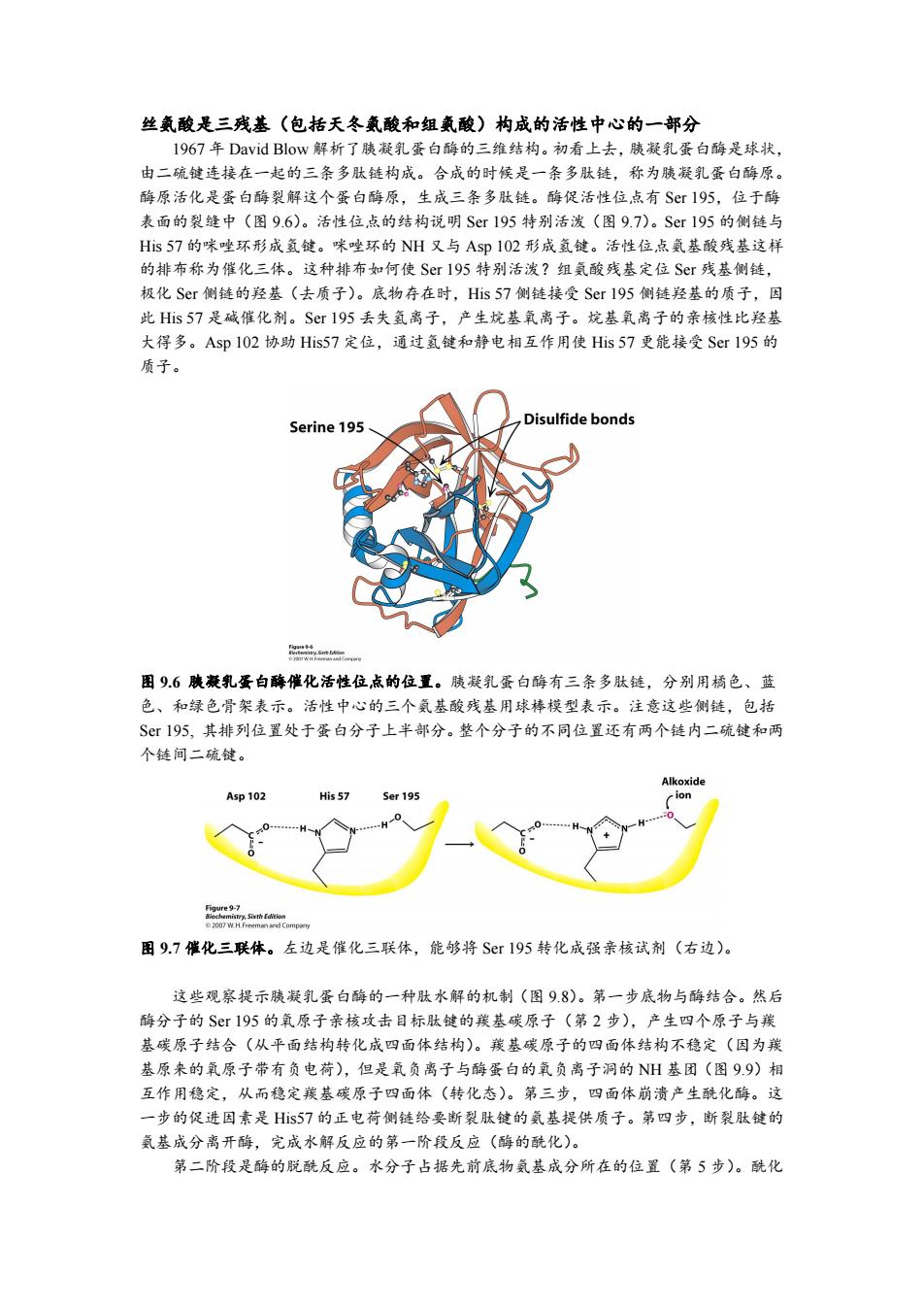
丝氨酸是三残基(包括天冬氨酸和组氦酸)构成的活性中心的一部分 1967年David Blow解析了胰凝乳蛋白酶的三维结构。初看上去,胰凝乳蛋白酶是球状, 由二硫键连接在一起的三条多肽链构成。合成的时候是一条多肽链,称为胰凝乳蛋白酶原。 酶原活化是蛋白酶裂解这个蛋白酶原,生成三条多肽链。酶促活性位点有Sr195,位于酶 表面的裂缝中(图9.6)。活性位点的结构说明Sr195特别活泼(图9.7)。Sr195的侧链与 Hs57的咪唑环形成氢键。咪唑环的NH又与Asp102形成氢键。活性位点氨基酸残基这样 的排布称为催化三体。这种排布如何使SrI95特别活泼?组氨酸残基定位Ser残基侧链, 极化Sr侧链的羟基(去质子)。底物存在时,His57侧链接受Ser195侧链羟基的质子,因 此His57是碱催化剂。Sr195丢失氢离子,产生烷基氧离子。烷基氧离子的亲核性比羟基 大得多。Asp102协助His57定位,通过氢键和静电相互作用使His57更能接受Sr195的 质子。 Serine 195 Disulfide bonds m2 图96胰兼乳蛋白酶催化活性位点的位置。胰凝乳蛋白酶有三条多肽链,分别用橘色、蓝 色、和绿色骨架表示。活性中心的三个氨基酸残基用球棒模型表示。注意这些侧链,包括 Sr195,其排列位置处于蛋白分子上半部分。整个分子的不同位置还有两个链内二硫键和两 个链间二硫键。 Alkoxide Asp 102 His 57 5er195 ion 0 ae9e 2007W.H.Freeman and 图9.7催化三联体。左边是催化三联体,能够将Sr195转化成强亲核试剂(右边)。 这些观察提示胰凝乳蛋白酶的一种肽水解的机制(图9.8)。第一步底物与酶结合。然后 酶分子的Sr195的氧原子亲核攻击目标肽键的羰基碳原子(第2步),产生四个原子与羰 基碳原子结合(从平面结构转化成四面体结构)。羰基碳原子的四面体结构不稳定(因为羰 基原来的氧原子带有负电荷),但是氧负离子与酶蛋白的氧负离子洞的NH基团(图99)相 互作用稳定,从而稳定羰基碳原子四面体(转化态)。第三步,四面体崩溃产生酰化酶。这 一步的促进因素是Hs57的正电荷侧链给要断裂肽键的氨基提供质子。第四步,断裂肽键的 氨基成分离开酶,完成水解反应的第一阶段反应(酶的酰化)。 第二阶段是酶的脱酰反应。水分子占据先前底物氨基成分所在的位置(第5步)。酰化
丝氨酸是三残基(包括天冬氨酸和组氨酸)构成的活性中心的一部分 1967 年 David Blow 解析了胰凝乳蛋白酶的三维结构。初看上去,胰凝乳蛋白酶是球状, 由二硫键连接在一起的三条多肽链构成。合成的时候是一条多肽链,称为胰凝乳蛋白酶原。 酶原活化是蛋白酶裂解这个蛋白酶原,生成三条多肽链。酶促活性位点有 Ser 195,位于酶 表面的裂缝中(图 9.6)。活性位点的结构说明 Ser 195 特别活泼(图 9.7)。Ser 195 的侧链与 His 57 的咪唑环形成氢键。咪唑环的 NH 又与 Asp 102 形成氢键。活性位点氨基酸残基这样 的排布称为催化三体。这种排布如何使 Ser 195 特别活泼?组氨酸残基定位 Ser 残基侧链, 极化 Ser 侧链的羟基(去质子)。底物存在时,His 57 侧链接受 Ser 195 侧链羟基的质子,因 此 His 57 是碱催化剂。Ser 195 丢失氢离子,产生烷基氧离子。烷基氧离子的亲核性比羟基 大得多。Asp 102 协助 His57 定位,通过氢键和静电相互作用使 His 57 更能接受 Ser 195 的 质子。 图 9.6 胰凝乳蛋白酶催化活性位点的位置。胰凝乳蛋白酶有三条多肽链,分别用橘色、蓝 色、和绿色骨架表示。活性中心的三个氨基酸残基用球棒模型表示。注意这些侧链,包括 Ser 195, 其排列位置处于蛋白分子上半部分。整个分子的不同位置还有两个链内二硫键和两 个链间二硫键。 图 9.7 催化三联体。左边是催化三联体,能够将 Ser 195 转化成强亲核试剂(右边)。 这些观察提示胰凝乳蛋白酶的一种肽水解的机制(图 9.8)。第一步底物与酶结合。然后 酶分子的 Ser 195 的氧原子亲核攻击目标肽键的羰基碳原子(第 2 步),产生四个原子与羰 基碳原子结合(从平面结构转化成四面体结构)。羰基碳原子的四面体结构不稳定(因为羰 基原来的氧原子带有负电荷),但是氧负离子与酶蛋白的氧负离子洞的 NH 基团(图 9.9)相 互作用稳定,从而稳定羰基碳原子四面体(转化态)。第三步,四面体崩溃产生酰化酶。这 一步的促进因素是 His57 的正电荷侧链给要断裂肽键的氨基提供质子。第四步,断裂肽键的 氨基成分离开酶,完成水解反应的第一阶段反应(酶的酰化)。 第二阶段是酶的脱酰反应。水分子占据先前底物氨基成分所在的位置(第 5 步)。酰化
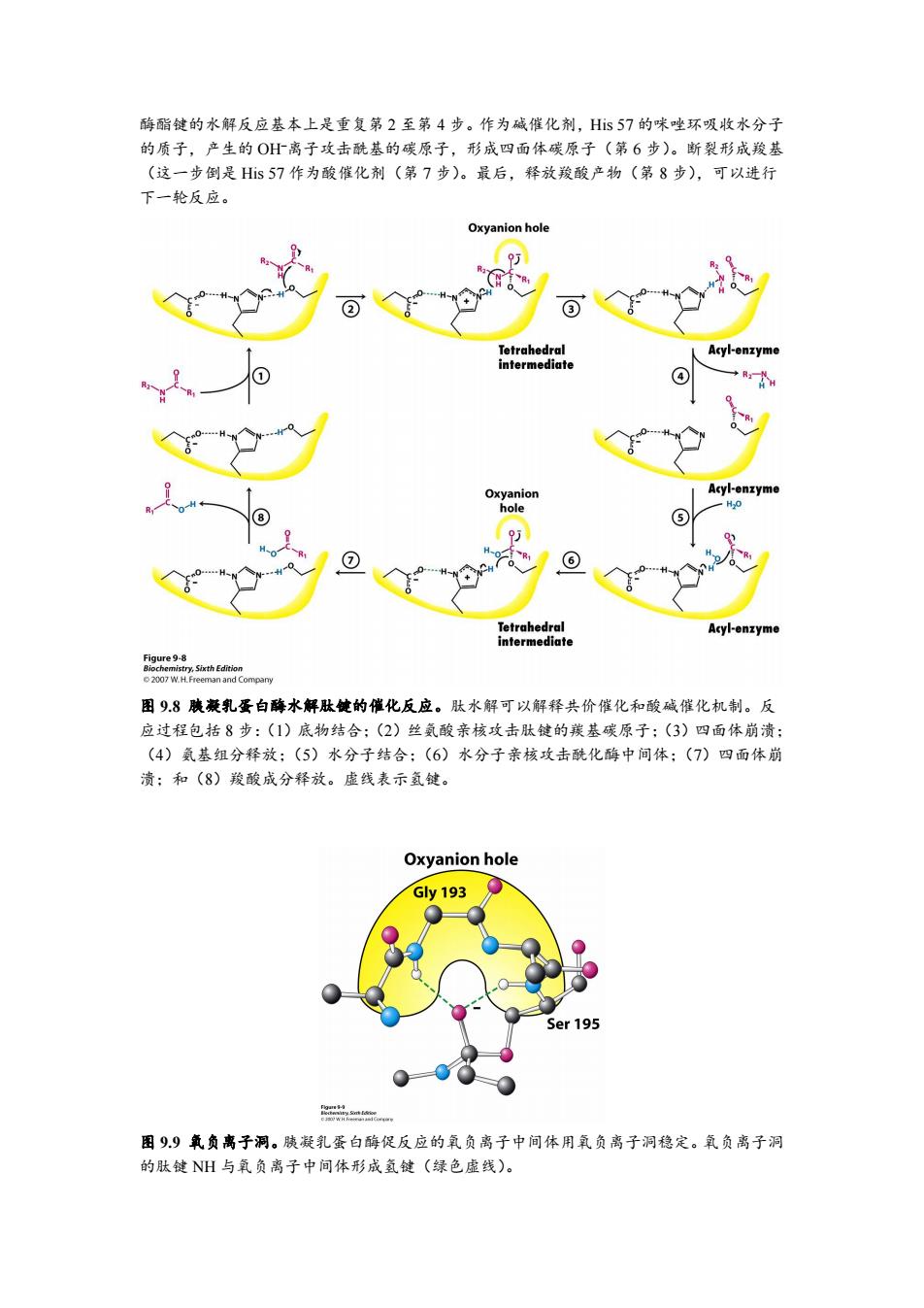
酶酯键的水解反应基本上是重复第2至第4步。作为碱催化剂,Hs57的咪唑环吸收水分子 的质子,产生的OH离子攻击酰基的碳原子,形成四面体碳原子(第6步)。断裂形成羧基 (这一步倒是Hs57作为酸催化剂(第7步)。最后,释放羧酸产物(第8步),可以进行 下一轮反应。 Oxyanion hole ② ③ Tetrahedral Acyl-enzyme intermediate Oxyanion Acyl-enzyme hole 5 ⑦ 6) Tetrahedral Acyl-enzyme intermediate Pigure 图98胰兼乳蛋白酶水解肽健的催化反应。肽水解可以解释共价催化和酸碱催化机制。反 应过程包括8步:(1)底物结合:(2)丝氨酸亲核攻击肽键的羰基碳原子:(3)四面体崩溃: (4)氨基组分释放:(5)水分子结合:(6)水分子亲核攻击酰化酶中间体:(7)四面体崩 溃:和(8)羧酸成分释放。虚线表示氢键。 Oxyanion hole Gy193 Ser 195 图99氧负离子洞。胰凝乳蛋白酶促反应的氧负离子中间体用氧负离子洞稳定。氧负离子洞 的肽键NH与氧负离子中间体形成氢键(绿色虚线)
酶酯键的水解反应基本上是重复第 2 至第 4 步。作为碱催化剂,His 57 的咪唑环吸收水分子 的质子,产生的 OH离子攻击酰基的碳原子,形成四面体碳原子(第 6 步)。断裂形成羧基 (这一步倒是 His 57 作为酸催化剂(第 7 步)。最后,释放羧酸产物(第 8 步),可以进行 下一轮反应。 图 9.8 胰凝乳蛋白酶水解肽键的催化反应。肽水解可以解释共价催化和酸碱催化机制。反 应过程包括 8 步:(1)底物结合;(2)丝氨酸亲核攻击肽键的羰基碳原子;(3)四面体崩溃; (4)氨基组分释放;(5)水分子结合;(6)水分子亲核攻击酰化酶中间体;(7)四面体崩 溃;和(8)羧酸成分释放。虚线表示氢键。 图 9.9 氧负离子洞。胰凝乳蛋白酶促反应的氧负离子中间体用氧负离子洞稳定。氧负离子洞 的肽键 NH 与氧负离子中间体形成氢键(绿色虚线)
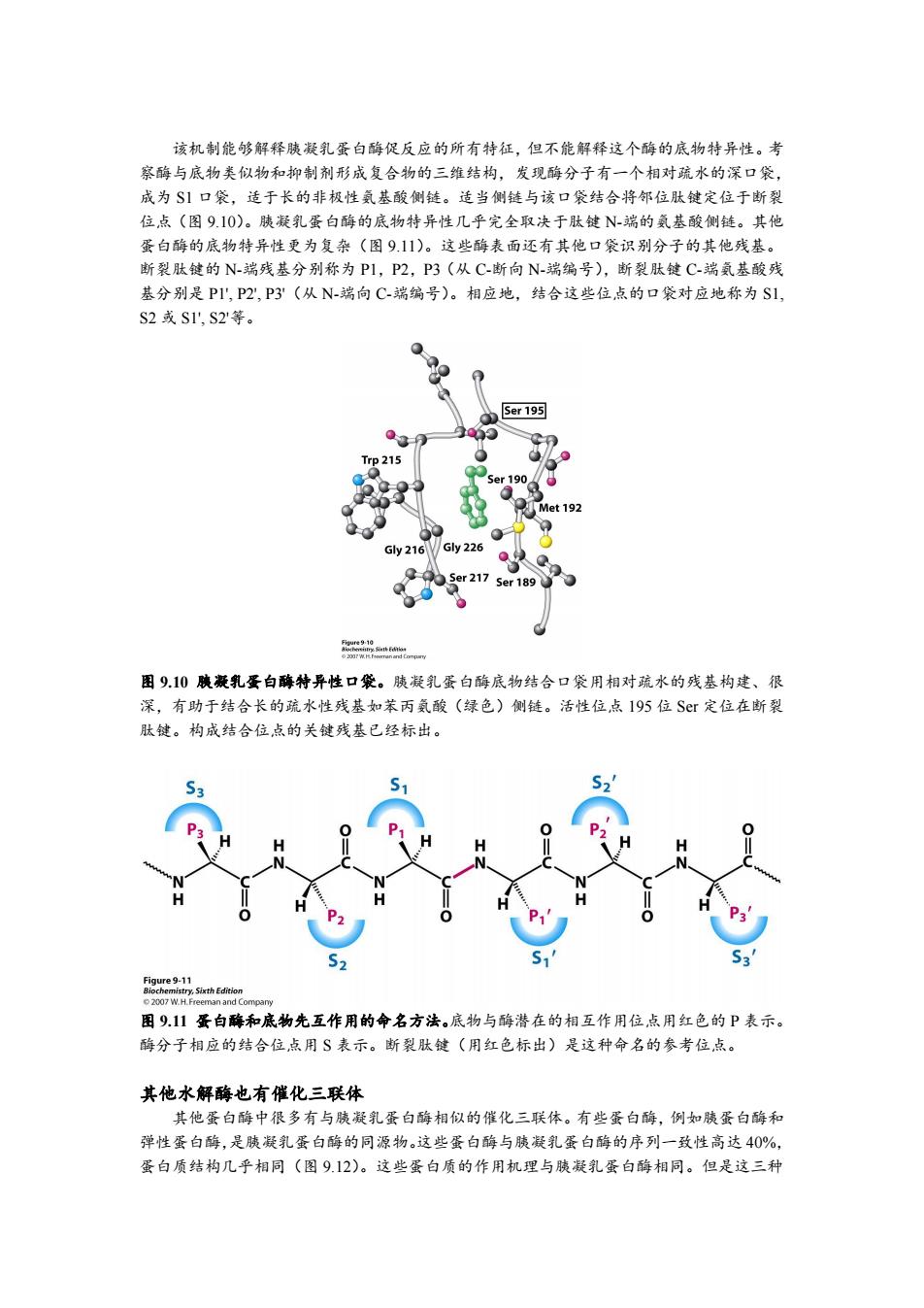
该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为S1口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的N-端残基分别称为P1,P2,P3(从C-断向N-端编号),断裂肽C-端氨基酸残 基分别是P1',P2,P3'(从N-端向C-端编号)。相应地,结合这些位点的口袋对应地称为S1, S2或S1',S2等。 0 Ser 195 ●3 Trp215 Ser 190 Q Met 192 Gy216 Gly 226 Ser 217 Ser 189 图9.10胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位,点I95位Sr定位在断裂 肽键。构成结合位点的关键残基已经标出。 0 H ● 51 2007 W.H.Freeman and Company 图911蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的P表示。 酶分子相应的结合位,点用S表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达40%, 蛋白质结构几乎相同(图9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种
该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为 S1 口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图 9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键 N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图 9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的 N-端残基分别称为 P1,P2,P3(从 C-断向 N-端编号),断裂肽键 C-端氨基酸残 基分别是 P1', P2', P3'(从 N-端向 C-端编号)。相应地,结合这些位点的口袋对应地称为 S1, S2 或 S1', S2'等。 图 9.10 胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位点 195 位 Ser 定位在断裂 肽键。构成结合位点的关键残基已经标出。 图 9.11 蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的 P 表示。 酶分子相应的结合位点用 S 表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达 40%, 蛋白质结构几乎相同(图 9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种

蛋白酶的底物特异性差异很大。胰凝乳蛋白酶断裂芳香氨基酸或很长的疏水性氨基酸C端 肽键,胰蛋白酶断裂长的带正电荷氨基酸(即精氨酸和赖氨酸)C-端肽键,弹性蛋白酶断裂 侧链小的氨基酸(如甘氨酸、丝氨酸)C端肽键。比较它们的S1口袋,发现底物特异性差 异的原因在于S1口袋结构的细小差异。胰蛋白酶的S1口袋大,底部有一个Aspl89酸性氨 基酸,而胰凝乳蛋白酶同样位,点是丝氨酸。天冬氨酸能够吸引,稳定底物分子带正电荷的精 氨酸、赖氨酸残基与酶分子结合。弹性蛋白酶的口袋两边有两个Val,分别是Vall90和Val 216。这两个氨基酸残基的侧链挤占口袋空间,使之只能容纳小侧链的氨基酸残基(图9.13)。 图9.12胰蛋白酶和胰装乳蛋白酶的结构类似性。将胰凝乳蛋白酶(红色)置于胰蛋白酶(蓝 色)之上,显示两者相似度很高。此处仅显示-碳原子骨架。两种蛋白质分子之间-碳原 子误差是1.7A。 Asp 189. Val190 Val 216 Val 216 Val 190 Asp 189 Chymotrypsin Trypsin Elastase 图99胰凝乳蛋白酶、胰蛋白酶、和弹性蛋白酶的S1口袋。有些氨基酸残基在决定这些酶 的特异性方面起关键作用。用颜色标出了这些残基的侧链和活性位点的丝氨酸。 胰凝乳蛋白酶家族的其他成员包括参与血液凝固的蛋白酶(在第10章讨论),以及肿瘤 标记蛋白前列腺特异抗原(PSA)。此外,在细菌、病毒和植物中发现的很多蛋白酶也属于 这一家族。 还有些蛋白酶与胰凝乳蛋白酶不同源,但是也具有非常相似的活性位点。在第6章我们 曾经介绍,同一进化使来源不同的蛋白质有相似的活性位,点。枯草杆菌蛋白酶就是一个非常 明显的例子。枯草杆菌蛋白酶也有催化三联体活性位,点和氧离子洞,但是这个酶的氧离子洞
蛋白酶的底物特异性差异很大。胰凝乳蛋白酶断裂芳香氨基酸或很长的疏水性氨基酸 C 端 肽键,胰蛋白酶断裂长的带正电荷氨基酸(即精氨酸和赖氨酸)C-端肽键,弹性蛋白酶断裂 侧链小的氨基酸(如甘氨酸、丝氨酸)C-端肽键。比较它们的 S1 口袋,发现底物特异性差 异的原因在于 S1 口袋结构的细小差异。胰蛋白酶的 S1 口袋大,底部有一个 Asp189 酸性氨 基酸,而胰凝乳蛋白酶同样位点是丝氨酸。天冬氨酸能够吸引,稳定底物分子带正电荷的精 氨酸、赖氨酸残基与酶分子结合。弹性蛋白酶的口袋两边有两个 Val,分别是 Val 190 和 Val 216。这两个氨基酸残基的侧链挤占口袋空间,使之只能容纳小侧链的氨基酸残基(图 9.13)。 图 9.12 胰蛋白酶和胰凝乳蛋白酶的结构类似性。将胰凝乳蛋白酶(红色)置于胰蛋白酶(蓝 色)之上,显示两者相似度很高。此处仅显示碳原子骨架。两种蛋白质分子之间碳原 子误差是 1.7A。 图 9.9 胰凝乳蛋白酶、胰蛋白酶、和弹性蛋白酶的 S1 口袋。有些氨基酸残基在决定这些酶 的特异性方面起关键作用。用颜色标出了这些残基的侧链和活性位点的丝氨酸。 胰凝乳蛋白酶家族的其他成员包括参与血液凝固的蛋白酶(在第 10 章讨论),以及肿瘤 标记蛋白前列腺特异抗原(PSA)。此外,在细菌、病毒和植物中发现的很多蛋白酶也属于 这一家族。 还有些蛋白酶与胰凝乳蛋白酶不同源,但是也具有非常相似的活性位点。在第 6 章我们 曾经介绍,同一进化使来源不同的蛋白质有相似的活性位点。枯草杆菌蛋白酶就是一个非常 明显的例子。枯草杆菌蛋白酶也有催化三联体活性位点和氧离子洞,但是这个酶的氧离子洞
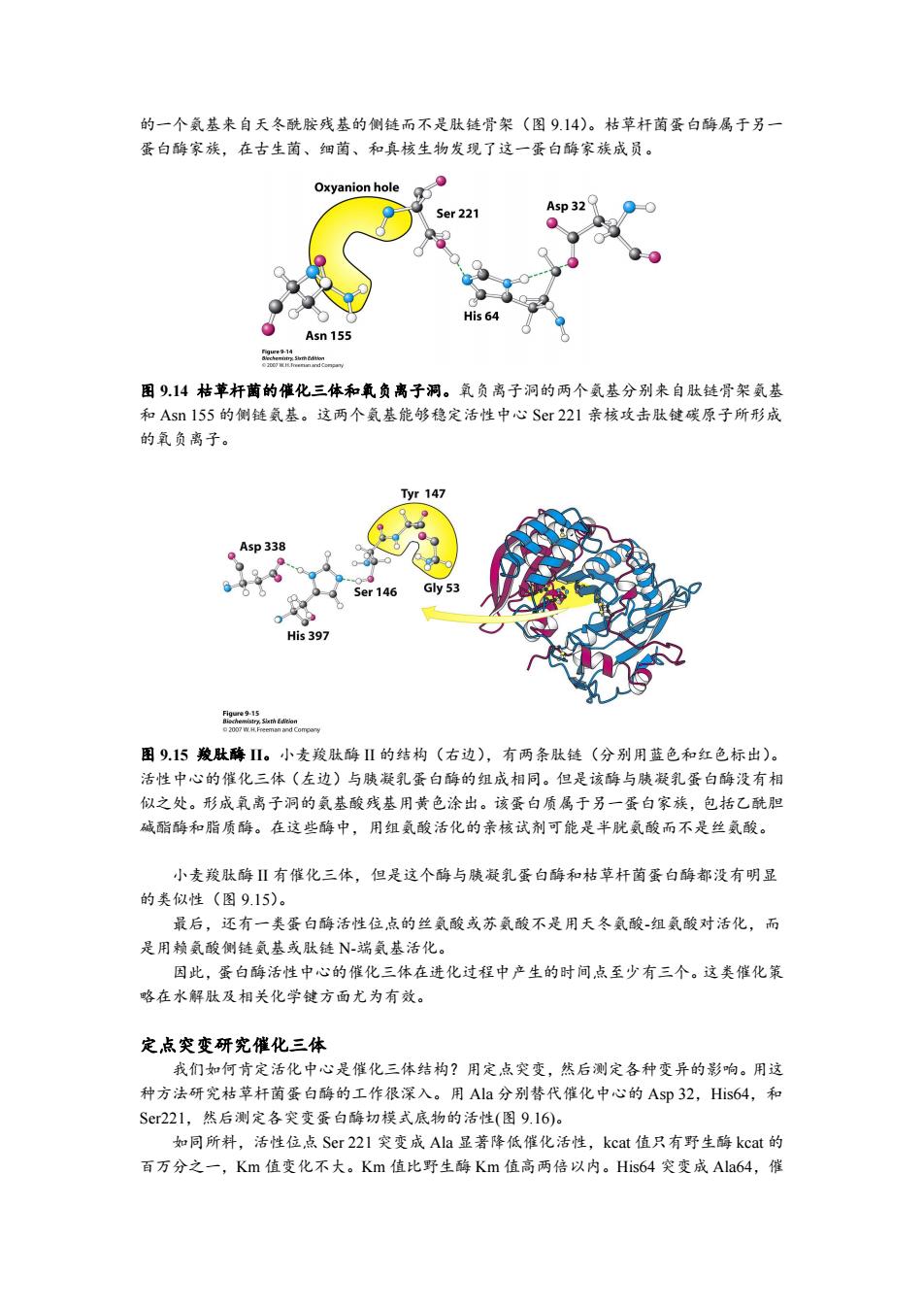
的一个氨基来自天冬酰胺残基的侧链而不是肽链骨架(图9.14)。枯草杆菌蛋白酶属于另一 蛋白酶家族,在古生菌、细菌、和真核生物发现了这一蛋白酶家族成员。 Oxyanion hole Ser 221 Asp 32 His 64 Asn 155 图914枯苹杆菌的催化三体和氧负离子洞。氧负离子洞的两个气基分别来自肽链骨架氨基 和Asn155的侧链氦基。这两个氨基能够稳定活性中心Sr221亲核攻击肽键碳原子所形成 的氧负离子。 yr147 Asp 338 Ser 146 Gly 53 0 His 397 feca5shEon 图9.15羧肽酶Ⅱ。小麦羧肽酶Ⅱ的结构(右边),有两条肽链(分别用蓝色和红色标出)。 活性中心的催化三体(左边)与胰凝乳蛋白酶的组成相同。但是该酶与胰凝乳蛋白酶没有相 似之处。形成氧离子洞的氨基酸残基用黄色涂出。该蛋白质属于另一蛋白家族,包括乙酰胆 碱酯酶和脂质酶。在这些酶中,用组气酸活化的亲核试剂可能是半胱氨酸而不是丝氨酸。 小麦羧肽酶Ⅱ有催化三体,但是这个酶与胰凝乳蛋白酶和枯草杆菌蛋白酶都没有明显 的类似性(图9.15)。 最后,还有一类蛋白酶活性位点的丝氨酸或苏氨酸不是用天冬氨酸-组氨酸对活化,而 是用赖氨酸侧链氨基或肽链N-瑞氦基活化。 因此,蛋白酶活性中心的催化三体在进化过程中产生的时间点至少有三个。这类催化策 略在水解肽及相关化学键方面尤为有效。 定,点突变研究催化三体 我们如何肯定活化中心是催化三体结构?用定点突变,然后测定各种变异的影响。用这 种方法研究枯草杆菌蛋白酶的工作很深入。用Ala分别替代催化中心的Asp32,His64,和 Sr221,然后测定各突变蛋白酶切模式底物的活性(图9.16)。 如同所料,活性位点Ser221突变成Ala显著降低催化活性,kcat值只有野生酶kcat的 百万分之一,Km值变化不大。Km值比野生酶Km值高两倍以内。His64突变成Ala64,催
的一个氨基来自天冬酰胺残基的侧链而不是肽链骨架(图 9.14)。枯草杆菌蛋白酶属于另一 蛋白酶家族,在古生菌、细菌、和真核生物发现了这一蛋白酶家族成员。 图 9.14 枯草杆菌的催化三体和氧负离子洞。氧负离子洞的两个氨基分别来自肽链骨架氨基 和 Asn 155 的侧链氨基。这两个氨基能够稳定活性中心 Ser 221 亲核攻击肽键碳原子所形成 的氧负离子。 图 9.15 羧肽酶 II。小麦羧肽酶 II 的结构(右边),有两条肽链(分别用蓝色和红色标出)。 活性中心的催化三体(左边)与胰凝乳蛋白酶的组成相同。但是该酶与胰凝乳蛋白酶没有相 似之处。形成氧离子洞的氨基酸残基用黄色涂出。该蛋白质属于另一蛋白家族,包括乙酰胆 碱酯酶和脂质酶。在这些酶中,用组氨酸活化的亲核试剂可能是半胱氨酸而不是丝氨酸。 小麦羧肽酶 II 有催化三体,但是这个酶与胰凝乳蛋白酶和枯草杆菌蛋白酶都没有明显 的类似性(图 9.15)。 最后,还有一类蛋白酶活性位点的丝氨酸或苏氨酸不是用天冬氨酸-组氨酸对活化,而 是用赖氨酸侧链氨基或肽链 N-端氨基活化。 因此,蛋白酶活性中心的催化三体在进化过程中产生的时间点至少有三个。这类催化策 略在水解肽及相关化学键方面尤为有效。 定点突变研究催化三体 我们如何肯定活化中心是催化三体结构?用定点突变,然后测定各种变异的影响。用这 种方法研究枯草杆菌蛋白酶的工作很深入。用 Ala 分别替代催化中心的 Asp 32,His64,和 Ser221,然后测定各突变蛋白酶切模式底物的活性(图 9.16)。 如同所料,活性位点 Ser 221 突变成 Ala 显著降低催化活性,kcat 值只有野生酶 kcat 的 百万分之一,Km 值变化不大。Km 值比野生酶 Km 值高两倍以内。His64 突变成 Ala64,催

化活性的降低与Ser22lAla突变相当,Asp32突变成Ala32队酶活性的影响幅度稍微小些, 但酶促活性也只有野生酶的万分之零点五。将这三个位点的氨基酸都变成丙氨酸,突变效果 与His64或Sr221单位,点突变的效果相当。这些结果支持“活性中心是催化三体,尤其是 组氨酸-丝氨酸对联合作用产生活性足够的亲核试剂攻击肽键羰基碳原子”的观,点。尽管这 些位点突变会大大降低酶促反应活性,但是在缓冲液pH值为86时,这些突变体的催化蛋 白水解的速度仍然比没有酶催化的蛋白水解速度快1000倍。 Wild type D32A S221A H64A S221A H64A D32A Uncat. =10 图916枯草杆菌蛋白酶定点突变。催化三体的残基突变成丙氨酸后,测定酶促活性。任一 残基突变都显著降低酶促活性。注意,纵轴是对数轴。突变体命名,第一个字母是野生型酶 的氨基酸缩写,后面的数字表示这个氨基酸所在的氨基酸序列位置,后面一个字母表示该位 点的突变氨基酸。Uncat是没有催化剂的反应效率(估计值)。 定点突变也能研究氧离子洞对催化反应的重要性。AsI55突变成甘氨酸能消除枯草杆 菌氧负离子洞的一个氨基,kcat值降至野生型酶的0.2%,Km值增加两倍。这些结果显示天 冬酰胺的NH基团在稳定羰基碳四面体中间物以及形成该四面体的转化态方面起重要作用。 其他种类的肽水解酶是半胱氨酸、天冬氪酸、和金属蛋白酶 并非所有的蛋白水解酶都使用活化丝氨酸残基,还有其它活活残基水解肽键(图9.17)。 这些蛋白水解酶分别是(1)半胱氨酸蛋白水解酶,(2)天冬氨酸蛋白水解酶,和(3)金 属蛋白水解酶。各种蛋白酶都产生一种亲核试剂,攻击肽键羰基碳原子(图918)。 半胱氨酸蛋白酶的酶促机理与胰凝乳蛋白酶酶促机理最相似。半胱氨酸蛋白酶组氨酸 残基活化的半胱氨酸亲核攻击肽键(图9.18)的方式与丝氨酸蛋白酶丝氨酸颇为相似。研究最 深入的半胱氨酸蛋白酶是木瓜蛋白酶(papain)。这个酶是从木瓜分离的。与木瓜蛋白酶同源 的哺乳动物蛋白酶是组织蛋白酶(cathepsins)。组织蛋白酶在免疫系统和其他系统起作用。在 进化过程中,半胱氨酸蛋白酶至少独立出现两次。Caspases也是半胱氨酸蛋白酶,负责细胞 凋亡,但是它们的结构与木瓜蛋白酶没有关系。 天冬氨酸蛋白酶活性位点中心有一对天冬氨酸,它们联合作用活化水分子,后者攻击 肽键。一个天冬氨酸是去质子状态(即解离状态,属于碱催化剂),它攻击水分子使之脱去质 子。另一个天冬氨酸是结合质子的状态(没有解离),使肽键极化导致肽键对亲核攻击敏感 (图9.18)。这类蛋白酶包括肾素。肾素能调解血压和胃蛋白酶(pepsin)活性。天冬氨酸蛋白 酶结构近似二重对称。可能的情况是基因重复产生两考贝基因发生融合,变成编码单一多 肽链的酶。每个考贝基因给活性位点提供一个天冬氨酸。在人免疫缺陷病毒(HV)及其它反 转录病毒中,这两个考贝基因已经融合成编码一条多肽链的基因(图919)。这些结果与酶 早先可能是两个独立亚基的想法一致
化活性的降低与 Ser 221Ala 突变相当,Asp32 突变成 Ala32 队酶活性的影响幅度稍微小些, 但酶促活性也只有野生酶的万分之零点五。将这三个位点的氨基酸都变成丙氨酸,突变效果 与 His64 或 Ser 221 单位点突变的效果相当。这些结果支持“活性中心是催化三体,尤其是 组氨酸-丝氨酸对联合作用产生活性足够的亲核试剂攻击肽键羰基碳原子”的观点。尽管这 些位点突变会大大降低酶促反应活性,但是在缓冲液 pH 值为 8.6 时,这些突变体的催化蛋 白水解的速度仍然比没有酶催化的蛋白水解速度快 1000 倍。 图 9.16 枯草杆菌蛋白酶定点突变。催化三体的残基突变成丙氨酸后,测定酶促活性。任一 残基突变都显著降低酶促活性。注意,纵轴是对数轴。突变体命名,第一个字母是野生型酶 的氨基酸缩写,后面的数字表示这个氨基酸所在的氨基酸序列位置,后面一个字母表示该位 点的突变氨基酸。Uncat 是没有催化剂的反应效率(估计值)。 定点突变也能研究氧离子洞对催化反应的重要性。Asn 155 突变成甘氨酸能消除枯草杆 菌氧负离子洞的一个氨基,kcat 值降至野生型酶的 0.2%,Km 值增加两倍。这些结果显示天 冬酰胺的 NH 基团在稳定羰基碳四面体中间物以及形成该四面体的转化态方面起重要作用。 其他种类的肽水解酶是半胱氨酸、天冬氨酸、和金属蛋白酶 并非所有的蛋白水解酶都使用活化丝氨酸残基,还有其它活活残基水解肽键(图 9.17)。 这些蛋白水解酶分别是(1)半胱氨酸蛋白水解酶,(2)天冬氨酸蛋白水解酶,和(3)金 属蛋白水解酶。各种蛋白酶都产生一种亲核试剂,攻击肽键羰基碳原子(图 9.18)。 半胱氨酸蛋白酶的酶促机理与胰凝乳蛋白酶酶促机理最相似。半胱氨酸蛋白酶组氨酸 残基活化的半胱氨酸亲核攻击肽键(图 9.18)的方式与丝氨酸蛋白酶丝氨酸颇为相似。研究最 深入的半胱氨酸蛋白酶是木瓜蛋白酶(papain)。这个酶是从木瓜分离的。与木瓜蛋白酶同源 的哺乳动物蛋白酶是组织蛋白酶(cathepsins)。组织蛋白酶在免疫系统和其他系统起作用。在 进化过程中,半胱氨酸蛋白酶至少独立出现两次。Caspases 也是半胱氨酸蛋白酶,负责细胞 凋亡,但是它们的结构与木瓜蛋白酶没有关系。 天冬氨酸蛋白酶活性位点中心有一对天冬氨酸,它们联合作用活化水分子,后者攻击 肽键。一个天冬氨酸是去质子状态(即解离状态,属于碱催化剂),它攻击水分子使之脱去质 子。另一个天冬氨酸是结合质子的状态(没有解离),使肽键极化导致肽键对亲核攻击敏感 (图 9.18)。这类蛋白酶包括肾素。肾素能调解血压和胃蛋白酶(pepsin)活性。天冬氨酸蛋白 酶结构近似二重对称。可能的情况是基因重复产生两考贝基因发生融合,变成编码单一多 肽链的酶。每个考贝基因给活性位点提供一个天冬氨酸。在人免疫缺陷病毒(HIV)及其它反 转录病毒中,这两个考贝基因已经融合成编码一条多肽链的基因(图 9.19)。这些结果与酶 早先可能是两个独立亚基的想法一致