
第十四章信号传导途径 0 GTP "ON" position position GTP 生物系统的信号传导通路是分子开关的接通和关闭。如同计算机芯片(左边),处于“接通” 状态就能传递信息。这些通路的共同点一些蛋白质(包括G蛋白,右边),与GTP结合的 能够传递信号,与GDP结合就处于沉默状态。 细胞对环境特异化学物质应答程度很高。在感知环境有这种化学物质是,细胞的应答也 许改变细胞的代谢,也许改变细胞的基因表达模式。在多细胞生物,这些化学信号是协调生 物应答的关键(图14.1)。刺激生理应答的三个分子信号的实例分别是肾上腺素、胰岛素、 和表皮生长因子。当生物个体受到威胁,处于肾脏上面的肾上腺释放肾上腺素。肾上腺素能 促进能源转化,改进心脏功能。进食后,胰岛的阝-细胞释放胰岛素。胰岛素刺激机体从血 液摄取葡萄糖,产生其它生理变化。应答损伤时,机体释放表皮生长因子刺激特异细胞生长 和分裂。上述的各种情况,细胞都是接受到一种信息,即环境中某种分子的浓度已经超过阙 值,启动生物的一系列事件将“环境中这种分子的浓度超过阈值”的信息转化成生理应答, 这个过程叫信号传导(signal transduction)。 Epinephrine Insulin Epidermal growth factor(EGF) B-Adrenergic receptor Insulin receptor EGF receptor Energy-store Increased glucose Expression of mobilization uptake growth-promoting genes 图14.1三种信号传导途径。信号分子与受体结合启动相应的生物过程,使机体产生重要的 生理应答。 根据信号传导途径的组分及其分支情况,对信号传导途径进行定义。这些信号传导途径 非常复杂,易于混淆。然而,很多信号传导途径所采用的策略和分子的种类又不乏有很多共 性。这些共同特性所遵循的原则能揭示信号传导途径的逻辑。由于信号传导途径影响本书其 余章节将要介绍的代谢途径的各个方面,我们在此介绍信号传导途径的这些原理
第十四章 信号传导途径 生物系统的信号传导通路是分子开关的接通和关闭。如同计算机芯片(左边),处于“接通” 状态就能传递信息。这些通路的共同点一些蛋白质(包括 G 蛋白,右边),与 GTP 结合的 能够传递信号,与 GDP 结合就处于沉默状态。 细胞对环境特异化学物质应答程度很高。在感知环境有这种化学物质是,细胞的应答也 许改变细胞的代谢,也许改变细胞的基因表达模式。在多细胞生物,这些化学信号是协调生 物应答的关键(图 14.1)。刺激生理应答的三个分子信号的实例分别是肾上腺素、胰岛素、 和表皮生长因子。当生物个体受到威胁,处于肾脏上面的肾上腺释放肾上腺素。肾上腺素能 促进能源转化,改进心脏功能。进食后,胰岛的 细胞释放胰岛素。胰岛素刺激机体从血 液摄取葡萄糖,产生其它生理变化。应答损伤时,机体释放表皮生长因子刺激特异细胞生长 和分裂。上述的各种情况,细胞都是接受到一种信息,即环境中某种分子的浓度已经超过阈 值,启动生物的一系列事件将“环境中这种分子的浓度超过阈值”的信息转化成生理应答, 这个过程叫信号传导(signal transduction)。 图 14.1 三种信号传导途径。信号分子与受体结合启动相应的生物过程,使机体产生重要的 生理应答。 根据信号传导途径的组分及其分支情况,对信号传导途径进行定义。这些信号传导途径 非常复杂,易于混淆。然而,很多信号传导途径所采用的策略和分子的种类又不乏有很多共 性。这些共同特性所遵循的原则能揭示信号传导途径的逻辑。由于信号传导途径影响本书其 余章节将要介绍的代谢途径的各个方面,我们在此介绍信号传导途径的这些原理

信号传导以来分子通路 Signal V Reception Amplification Transduction Response(s) 图142信号传导原则。一个细胞组分首先与环境信号结合。这个细胞组分常常是细胞表面 受体。然后将信号已经到达的信息转化成其他化学形式,或转导。转导过程常常有很多步骤 构成。在发生最后应答前,这些步骤常常依次扩增反馈途径调节整个信号途径。 信号传导途径可以看作是一种分子通路(图14.2)。所有这些分子通路都含有一些关键 步骤: 1.第一信使的释放。一个刺激(如损伤或消化食物)启动信号分子释放。这些信号分子叫 第一信使。 2.第一信使的接收。大多数信号分子不进入细胞。细胞表面的蛋白质充当受体,能够与信 号分子结合,然后将它们已经与信号分子结合的“信息”传递到细胞内。受体跨过细胞 膜,因此既有胞内组分又有胞外组分。特异识别信号分子(也称为陪体)的结合位点就 在胞外。这种结合位点与酶的活性位点相似,只是没有在此处发生催化作用。配体与受 体之间的相互作用改变了受体蛋白的三级或四级结构,包括受体蛋白在细胞内组分的空 间结构。 3.在细胞内用第二信使传递信息。被称为第二信使的另外一些小分子用来接着将受体-配 体复合物的信息向下传递。第二信使是胞内分子,其浓度是应答环境信号的。这些浓度 变化构成分子通路的下一环节。特别重要的第二信使是cAMP和cGMP,Ca+,肌醇 -1,3,5-三磷酸(IP3),和二酰基甘油(DAG,图14.3)。 24 H20 OH OPO,2- +o;Po OH H20 <AMP,(GMP Calcium ion Inositol 1,4,5-trisphosphate (IPa) OH Diacylglycerol(DAG 图14.3常用的第二信使。第二信使是胞内分子,其浓度在应答环境信号时发生改变,在细 胞内传送信息
信号传导以来分子通路 图 14.2 信号传导原则。一个细胞组分首先与环境信号结合。这个细胞组分常常是细胞表面 受体。然后将信号已经到达的信息转化成其他化学形式,或转导。转导过程常常有很多步骤 构成。在发生最后应答前,这些步骤常常依次扩增反馈途径调节整个信号途径。 信号传导途径可以看作是一种分子通路(图 14.2)。所有这些分子通路都含有一些关键 步骤: 1. 第一信使的释放。一个刺激(如损伤或消化食物)启动信号分子释放。这些信号分子叫 第一信使。 2. 第一信使的接收。大多数信号分子不进入细胞。细胞表面的蛋白质充当受体,能够与信 号分子结合,然后将它们已经与信号分子结合的“信息”传递到细胞内。受体跨过细胞 膜,因此既有胞内组分又有胞外组分。特异识别信号分子(也称为陪体)的结合位点就 在胞外。这种结合位点与酶的活性位点相似,只是没有在此处发生催化作用。配体与受 体之间的相互作用改变了受体蛋白的三级或四级结构,包括受体蛋白在细胞内组分的空 间结构。 3. 在细胞内用第二信使传递信息。被称为第二信使的另外一些小分子用来接着将受体-配 体复合物的信息向下传递。第二信使是胞内分子,其浓度是应答环境信号的。这些浓度 变化构成分子通路的下一环节。特别重要的第二信使是 cAMP 和 cGMP,Ca 2+ , 肌醇 -1,3,5-三磷酸(IP3),和二酰基甘油(DAG; 图 14.3)。 图 14.3 常用的第二信使。第二信使是胞内分子,其浓度在应答环境信号时发生改变,在细 胞内传送信息

采用第二信使产生了几种结果。首先,在产生第二信使之前信号可能已被放大。信号分 子与受体结合可能只活化了少量受体分子,但是每个活化的受体分子能产生很多第二信使。 因此,低浓度的环境信号分子,即使少到只有一个信号分子,也能产生大量的胞内信号和应 答。其次,第二信使分子能自由扩散到细胞其他区域,因此能够影响整个细胞。第三,在多 个信号途径采用相同的第二信使既造就了一些机会,也产生了一些问题。从几个信号途径输 入信号(常常称为Cross-talk),会玫变共同第二信使的浓度。与单独途径作用相比,Cross talk 可以精细调节细胞活性。但是,不当的cross talk导致的第二信使浓度改变可能被细胞误读。 4.直接改变生理应答的效应器活化。信号途径的基本效应是活化(或抑制)泵、酶、和直 接控制代谢途径的基因转录因子,基因活化,以及神经信号传递。 5.信号终止。在细胞已经完成了对信号的应答之后,必须终止信号途径或者不再对新的信 号实施应答。不能适当终止信号应答的细胞会导致非常严重的后果。我们将看到,很多 肿瘤细胞与它们不能适当地终止信号途径有关,尤其是控制细胞生长的生物过程。 本章我们介绍图14.1提到的三种信号途径的各个组分。在介绍过程中,我们会看到信 号转导蛋白的几类接头(adaptor)结构域。这些结构域通常能识别特定分子,有助于将信息 从一种蛋白质传递到另一种蛋白质。这三种信号传递途径的组分也出现于其他信号传导途 径。记住,这三个信号传导途径也是很多其他信号传导途径的代表。 14.1异源三聚体G蛋白传递信号、重置自身 B-肾上腺素受体(B-AR)与肾上腺素配体结合,起始肾上腺素信号途径。B-肾上腺素 受体属于细胞表面受体家族的成员。这个家族是TTM受体家族(seven transmembrane-helix receptors)。该家族成员负贡传递不同信号启动的信息。这些信号包括激素、神经递质、气味 (odorants)、味觉物质、甚至质子(表l4.1)。已经知道的7TM受体家族成员有几千种。约 有50%的治疗药物靶向这类受体。该家族蛋白有7个α-螺旋跨过膜脂质双层。由于是单一 多肽链如同蛇形跨膜7次,也有人称这类受体为“蛇形卷曲受体”(serpentine receptors)(图 14.4A)。最先被确定三维结构的7TM受体是视紫质(图14.4B),在视觉系统其关键作用。 其他很多TTM受体家族成员的结构域视紫质蛋白结构很相似,有些7TM受体家族成员保 外结构域较大。 表14.17TM受体介导的生物功能 TABLE 14.I Biological functions mediated by 7TM receptors ◆Hormone action Hormone secretion Neurotransmission Chemotaxis ·Exocytosis Control of blood pressure ·Embryogenesis Cell growth and differentiation Development ●Smell ●Taste 。Vision .Viral infection Source:After J.S.Gutkind,J.Biol.Chem.273(1998): 1839-1842
采用第二信使产生了几种结果。首先,在产生第二信使之前信号可能已被放大。信号分 子与受体结合可能只活化了少量受体分子,但是每个活化的受体分子能产生很多第二信使。 因此,低浓度的环境信号分子,即使少到只有一个信号分子,也能产生大量的胞内信号和应 答。其次,第二信使分子能自由扩散到细胞其他区域,因此能够影响整个细胞。第三,在多 个信号途径采用相同的第二信使既造就了一些机会,也产生了一些问题。从几个信号途径输 入信号(常常称为 Cross-talk),会改变共同第二信使的浓度。与单独途径作用相比,Cross talk 可以精细调节细胞活性。但是,不当的 cross talk 导致的第二信使浓度改变可能被细胞误读。 4. 直接改变生理应答的效应器活化。信号途径的基本效应是活化(或抑制)泵、酶、和直 接控制代谢途径的基因转录因子,基因活化,以及神经信号传递。 5. 信号终止。在细胞已经完成了对信号的应答之后,必须终止信号途径或者不再对新的信 号实施应答。不能适当终止信号应答的细胞会导致非常严重的后果。我们将看到,很多 肿瘤细胞与它们不能适当地终止信号途径有关,尤其是控制细胞生长的生物过程。 本章我们介绍图 14.1 提到的三种信号途径的各个组分。在介绍过程中,我们会看到信 号转导蛋白的几类接头(adaptor)结构域。这些结构域通常能识别特定分子,有助于将信息 从一种蛋白质传递到另一种蛋白质。这三种信号传递途径的组分也出现于其他信号传导途 径。记住,这三个信号传导途径也是很多其他信号传导途径的代表。 14.1 异源三聚体 G 蛋白传递信号、重置自身 肾上腺素受体(AR)与肾上腺素配体结合,起始肾上腺素信号途径。肾上腺素 受体属于细胞表面受体家族的成员。这个家族是 7TM 受体家族(seven transmembrane-helix receptors)。该家族成员负责传递不同信号启动的信息。这些信号包括激素、神经递质、气味 (odorants)、味觉物质、甚至质子(表 14.1)。已经知道的 7TM 受体家族成员有几千种。约 有 50%的治疗药物靶向这类受体。该家族蛋白有 7 个 螺旋跨过膜脂质双层。由于是单一 多肽链如同蛇形跨膜 7 次,也有人称这类受体为“蛇形卷曲受体”(serpentine receptors)(图 14.4A)。最先被确定三维结构的 7TM 受体是视紫质(图 14.4B),在视觉系统其关键作用。 其他很多 7TM 受体家族成员的结构域视紫质蛋白结构很相似,有些 7TM 受体家族成员保 外结构域较大。 表 14.1 7TM 受体介导的生物功能
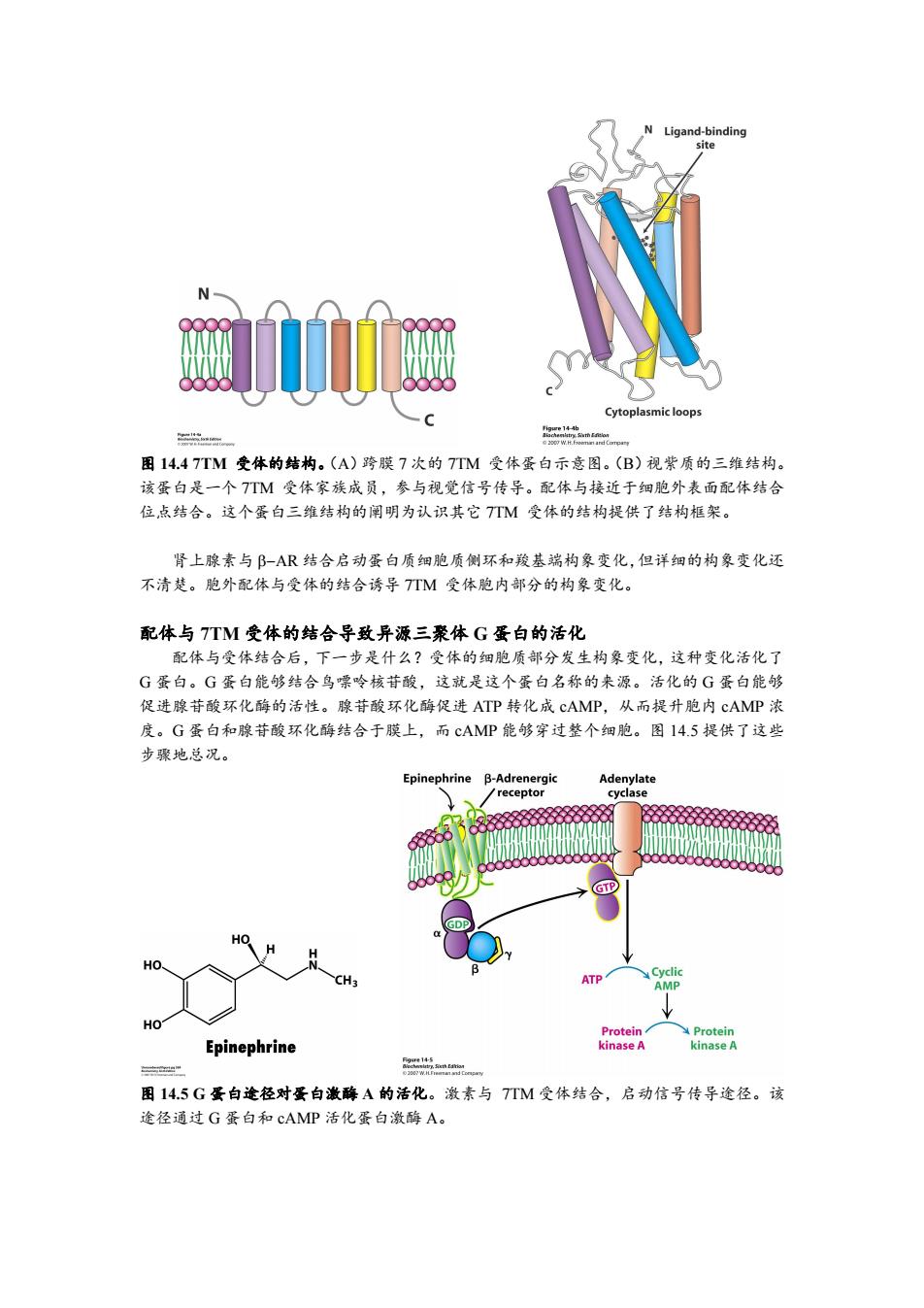
Ligand-binding site Cytoplasmic loops 图14.47TM受体的结构。(A)跨膜7次的7TM受体蛋白示意图。(B)视紫质的三维结构。 该蛋白是一个TTM受体家族成员,参与视觉信号传导。配体与接近于细胞外表面配体结合 位,点结合。这个蛋白三维结构的阐明为认识其它7TM受体的结构提供了结构框架。 肾上腺素与阝-AR结合启动蛋白质细胞质侧环和羧基端构象变化,但详细的构象变化还 不清楚。胞外配体与受体的结合诱导TTM受体胞内部分的构象变化。 配体与7TM受体的结合导致异源三聚体G蛋白的活化 配体与受体结合后,下一步是什么?受体的细胞质部分发生构象变化,这种变化活化了 G蛋白。G蛋白能够结合鸟嘌呤核苷酸,这就是这个蛋白名称的来源。活化的G蛋白能够 促进腺苷酸环化酶的活性。腺苷酸环化酶促进ATP转化成cAMP,从而提升胞内cAMP浓 度。G蛋白和腺苷酸环化酶结合于膜上,而cAMP能够穿过整个细胞。图14.5提供了这些 步骤地总况。 Epinephrine B-Adrenergic Adenylate receptor cyclase GTP 0 HO HO. CH3 ATP Cyclic AMP HO Protein Protein Epinephrine kinase A kinase A " 图14.5G蛋白途径对蛋白激酶A的活化。激素与7TM受体结合,启动信号传导途径。该 途径通过G蛋白和cAMP活化蛋白激酶A
图 14.4 7TM 受体的结构。(A)跨膜 7 次的 7TM 受体蛋白示意图。(B)视紫质的三维结构。 该蛋白是一个 7TM 受体家族成员,参与视觉信号传导。配体与接近于细胞外表面配体结合 位点结合。这个蛋白三维结构的阐明为认识其它 7TM 受体的结构提供了结构框架。 肾上腺素与 AR 结合启动蛋白质细胞质侧环和羧基端构象变化,但详细的构象变化还 不清楚。胞外配体与受体的结合诱导 7TM 受体胞内部分的构象变化。 配体与 7TM 受体的结合导致异源三聚体 G 蛋白的活化 配体与受体结合后,下一步是什么?受体的细胞质部分发生构象变化,这种变化活化了 G 蛋白。G 蛋白能够结合鸟嘌呤核苷酸,这就是这个蛋白名称的来源。活化的 G 蛋白能够 促进腺苷酸环化酶的活性。腺苷酸环化酶促进 ATP 转化成 cAMP,从而提升胞内 cAMP 浓 度。G 蛋白和腺苷酸环化酶结合于膜上,而 cAMP 能够穿过整个细胞。图 14.5 提供了这些 步骤地总况。 图 14.5 G 蛋白途径对蛋白激酶 A 的活化。激素与 7TM 受体结合,启动信号传导途径。该 途径通过 G 蛋白和 cAMP 活化蛋白激酶 A
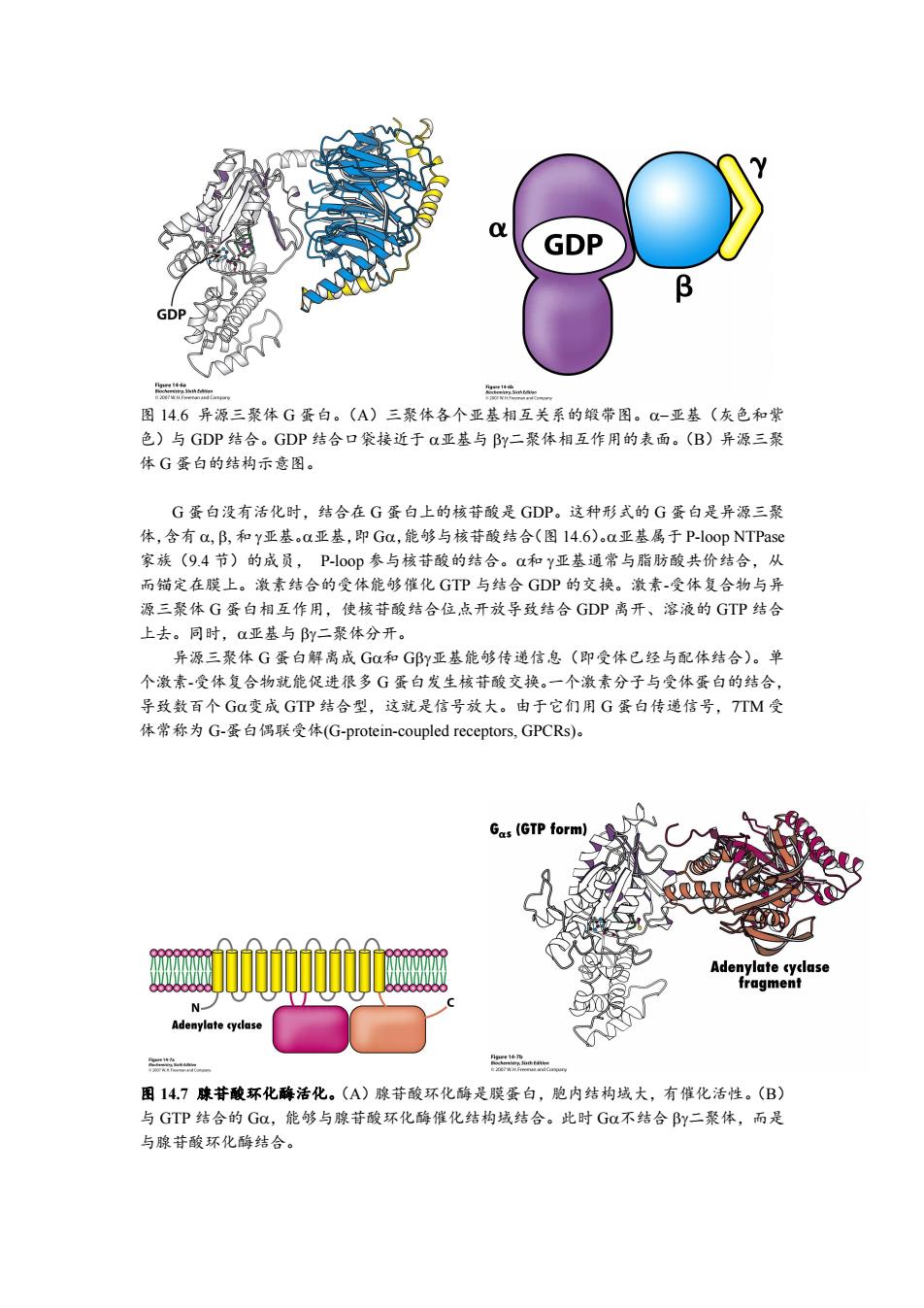
GDP B GD 图14.6异源三聚体G蛋白。(A)三聚体各个亚基相互关系的缎带图。-亚基(灰色和紫 色)与GDP结合。GDP结合口袋接近于a亚基与By二聚体相互作用的表面。(B)异源三聚 体G蛋白的结构示意图。 G蛋白没有活化时,结合在G蛋白上的核苷酸是GDP。这种形式的G蛋白是异源三聚 体,含有a,B,和Y亚基。a亚基,即Ga,能够与核苷酸结合(图14.6)a亚基属于P--loop NTPase 家族(9.4节)的成员,P-00p参与核苷酸的结合。Q和Y亚基通常与脂肪酸共价结合,从 而锚定在膜上。激素结合的受体能够催化GTP与结合GDP的交换。激素-受体复合物与异 源三聚体G蛋白相互作用,使核苷酸结合位,点开放导致结合GDP离开、溶液的GTP结合 上去。同时,亚基与By二聚体分开。 异源三聚体G蛋白解离成G和G邱y亚基能够传递信息(即受体已经与配体结合)。单 个激素-受体复合物就能促进很多G蛋白发生核苷酸交换。一个激素分子与受体蛋白的结合, 导致数百个Ga变成GTP结合型,这就是信号放大。由于它们用G蛋白传递信号,TTM受 体常称为G-蛋白偶联受体(G-protein-coupled receptors,GPCRs)。 Gas(GTP form) Adenylate cyclase fragment N- Adenylate cyclase 一 二- 图14.7腺苷酸环化酶活化。(A)腺苷酸环化酶是膜蛋白,胞内结构域大,有催化活性。(B) 与GTP结合的GC,能够与腺苷酸环化酶催化结构域结合。此时G不结合By二聚体,而是 与腺苷酸环化酶结合
图 14.6 异源三聚体 G 蛋白。(A)三聚体各个亚基相互关系的缎带图。亚基(灰色和紫 色)与 GDP 结合。GDP 结合口袋接近于 亚基与 二聚体相互作用的表面。(B)异源三聚 体 G 蛋白的结构示意图。 G 蛋白没有活化时,结合在 G 蛋白上的核苷酸是 GDP。这种形式的 G 蛋白是异源三聚 体,含有 和 亚基。亚基,即 G,能够与核苷酸结合(图 14.6)。亚基属于 P-loop NTPase 家族(9.4 节)的成员, P-loop 参与核苷酸的结合。和 亚基通常与脂肪酸共价结合,从 而锚定在膜上。激素结合的受体能够催化 GTP 与结合 GDP 的交换。激素-受体复合物与异 源三聚体 G 蛋白相互作用,使核苷酸结合位点开放导致结合 GDP 离开、溶液的 GTP 结合 上去。同时,亚基与 二聚体分开。 异源三聚体 G 蛋白解离成 G和 G亚基能够传递信息(即受体已经与配体结合)。单 个激素-受体复合物就能促进很多 G 蛋白发生核苷酸交换。一个激素分子与受体蛋白的结合, 导致数百个 G变成 GTP 结合型,这就是信号放大。由于它们用 G 蛋白传递信号,7TM 受 体常称为 G-蛋白偶联受体(G-protein-coupled receptors, GPCRs)。 图 14.7 腺苷酸环化酶活化。(A)腺苷酸环化酶是膜蛋白,胞内结构域大,有催化活性。(B) 与 GTP 结合的 G,能够与腺苷酸环化酶催化结构域结合。此时 G不结合 二聚体,而是 与腺苷酸环化酶结合

活化G蛋白与其他蛋白质结合传递信号 GTP结合后,G蛋白与By亚基相互作用的表面发生变化,G蛋白对By二聚体的亲和性 大大降低。但是G蛋白所采用的新结构与其他蛋白质有亲和性。在阝-AR途径,与G蛋白 发生结合的新蛋白是腺苷酸环化酶(adenylate cyclase)。腺苷酸环化酶是含有l2个跨膜螺旋 的膜蛋白,能够将ATP转化成CAMP。环化酶两个大的细胞质结构域形成酶的催化区。GCs 与腺苷酸环化酶相互作用有利于环化酶的催化活性,促进cAMP的产出(图14.7)。实际上, 参与B-AR途径的G蛋白亚基是GS(s表示具有促进作用)。肾上腺素与细胞表面接合的 净结果是增加了胞内cAMP合成速率。腺苷酸环化酶催化合成的CAMP为信号放大提供了 第二水平,因为每个腺苷酸环化酶能够将很多ATP分子转化成cAMP。 CAMP活化蛋白激酶A,后者催化很多目标蛋白磷酸化 我们继续跟踪信号传导途径的信息流动。CAMP浓度的增加能影响不同的细胞过程。在 肌肉组织的肾上腺素途径,CAMP刺激肌肉细胞合成ATP以利于肌肉收缩。在其他细胞, CAMP促进储存燃料的降解、增加胃粘膜分泌酸,导致黑素颗粒的分散,消除血小板凝聚, 诱导氯离子通道的开放。cAMP如何影响如此之多的细胞过程?实际上,真核细胞cAMP 的大多数效应是由于一种蛋白激酶的活化所致。这个蛋白质是蛋白激酶A(PKA)。 如同早先介绍的,PKA有两个调节亚基(R)和两个催化亚基(C)。没有cAMP,R2C2 复合物没有催化活性。CAMP与调节亚基结合,就能释放出具有催化亚基。催化亚基催化自 身磷酸化。活化的PKA能够将很多目标蛋白特定位点的丝氨酸和酸酸磷酸化。例如,PKA 磷酸化两种酶(这两种酶促经糖原降解,抑制糖原合成)(21.3节)。PKA磷酸化一些转录 因子(这些转录因子称为cAMP应答因子结合蛋白,即CREB,cAMP-response element binding protein),从而刺激特定基因的表达。PKA的这种活性显示信号转导途径能够将胞外信息传 递到细胞核,改变基因的转录。 图14.8总结了肾上腺素启动的信号转导途径。 Epinephrine B-Adrenergic receptor Binding Activated receptor GTP for GDP exchange Amplification Activated G protein Activated adenylate cyclase Enzymatic reaction Amplification Increased [cAMP] Activated protein kinase A and other effectors Figure 14-8 2007 W.H.Freeman and Compary 图14.8肾上腺素信号传递途径。肾上腺素与肾上腺素受体结合,启动信号传导途径。每步 反应的特性在箭头左侧的黑色文字标出。箭头右侧绿色文字标出能进行信号放大的步骤
活化 G 蛋白与其他蛋白质结合传递信号 GTP 结合后,G 蛋白与 亚基相互作用的表面发生变化,G 蛋白对 二聚体的亲和性 大大降低。但是 G 蛋白所采用的新结构与其他蛋白质有亲和性。在 AR 途径,与 G 蛋白 发生结合的新蛋白是腺苷酸环化酶(adenylate cyclase)。腺苷酸环化酶是含有 12 个跨膜螺旋 的膜蛋白,能够将 ATP 转化成 cAMP。环化酶两个大的细胞质结构域形成酶的催化区。Gs 与腺苷酸环化酶相互作用有利于环化酶的催化活性,促进 cAMP 的产出(图 14.7)。实际上, 参与 -AR 途径的 G 蛋白亚基是 Gs(s 表示具有促进作用)。肾上腺素与细胞表面接合的 净结果是增加了胞内 cAMP 合成速率。腺苷酸环化酶催化合成的 cAMP 为信号放大提供了 第二水平,因为每个腺苷酸环化酶能够将很多 ATP 分子转化成 cAMP。 cAMP 活化蛋白激酶 A,后者催化很多目标蛋白磷酸化 我们继续跟踪信号传导途径的信息流动。cAMP 浓度的增加能影响不同的细胞过程。在 肌肉组织的肾上腺素途径,cAMP 刺激肌肉细胞合成 ATP 以利于肌肉收缩。在其他细胞, cAMP 促进储存燃料的降解、增加胃粘膜分泌酸,导致黑素颗粒的分散,消除血小板凝聚, 诱导氯离子通道的开放。cAMP 如何影响如此之多的细胞过程?实际上,真核细胞 cAMP 的大多数效应是由于一种蛋白激酶的活化所致。这个蛋白质是蛋白激酶 A (PKA)。 如同早先介绍的,PKA 有两个调节亚基(R)和两个催化亚基(C)。没有 cAMP, R2C2 复合物没有催化活性。cAMP 与调节亚基结合,就能释放出具有催化亚基。催化亚基催化自 身磷酸化。活化的 PKA 能够将很多目标蛋白特定位点的丝氨酸和酸酸磷酸化。例如,PKA 磷酸化两种酶(这两种酶促经糖原降解,抑制糖原合成)(21.3 节)。PKA 磷酸化一些转录 因子(这些转录因子称为 cAMP 应答因子结合蛋白,即 CREB, cAMP-response element binding protein),从而刺激特定基因的表达。PKA 的这种活性显示信号转导途径能够将胞外信息传 递到细胞核,改变基因的转录。 图 14.8 总结了肾上腺素启动的信号转导途径。 图 14.8 肾上腺素信号传递途径。肾上腺素与肾上腺素受体结合,启动信号传导途径。每步 反应的特性在箭头左侧的黑色文字标出。箭头右侧绿色文字标出能进行信号放大的步骤
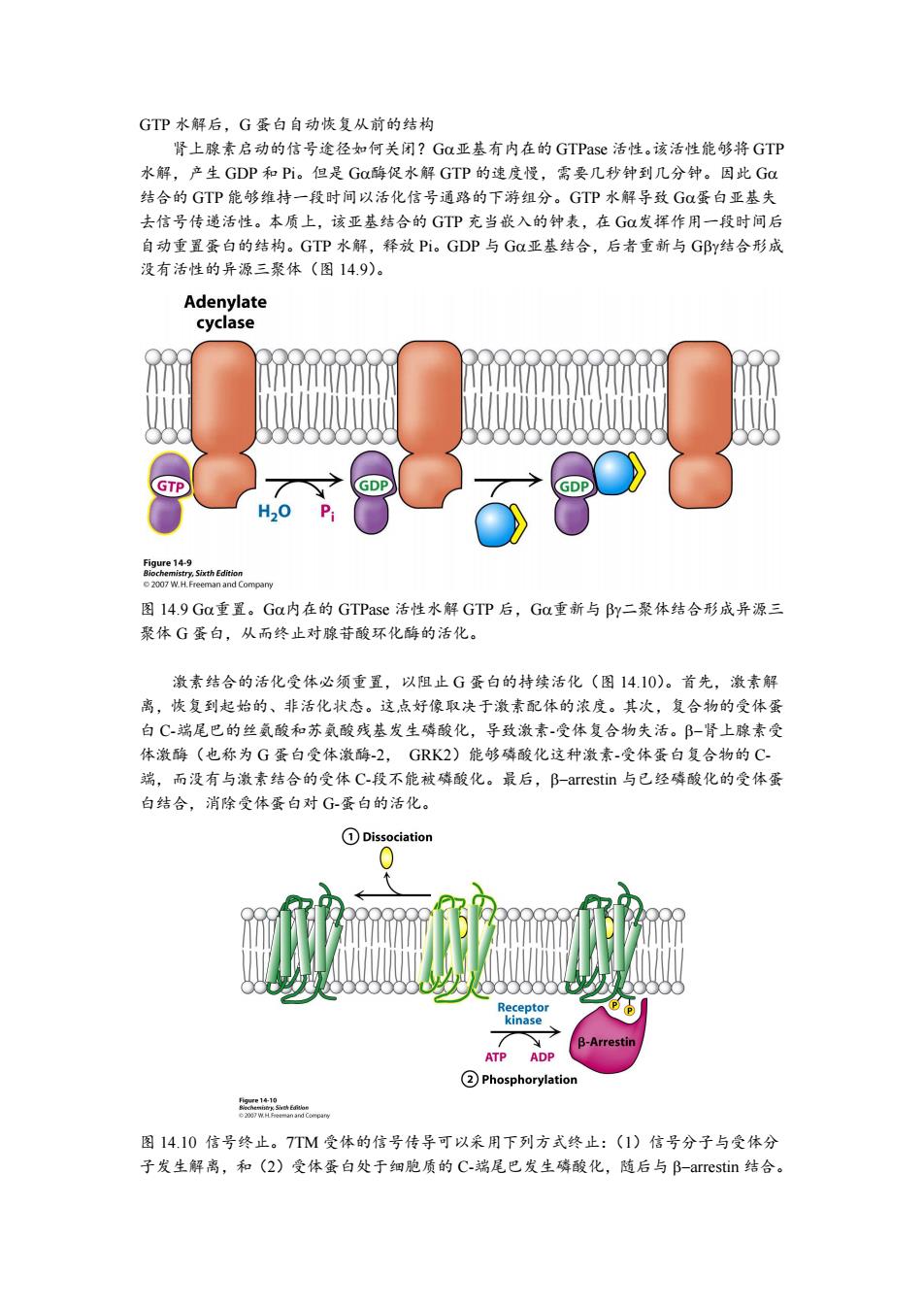
GTP水解后,G蛋白自动恢复从前的结构 肾上腺素启动的信号途径如何关闭?G0亚基有内在的GTPase活性。该活性能够将GTP 水解,产生GDP和Pi。但是Ga酶促水解GTP的速度慢,需要几秒钟到几分钟。因此GC 结合的GTP能够维持一段时间以活化信号通路的下游组分。GTP水解导致G蛋白亚基失 去信号传递活性。本质上,该亚基结合的GTP充当嵌入的钟表,在G发挥作用一段时间后 自动重置蛋白的结构。GTP水解,释放Pi。GDP与GC亚基结合,后者重新与GBy结合形成 没有活性的异源三聚体(图14.9)。 Adenylate cyclase GTP GDP H2O Pi Oee135hEn 2007 W.H.Freeman and Compary 图l4.9Ga重置。Ga内在的GTPase活性水解GTP后,Ga重新与By二聚体结合形成异源三 聚体G蛋白,从而终止对腺苷酸环化酶的活化。 激素结合的活化受体必须重置,以阻止G蛋白的持续活化(图14.10)。首先,激素解 离,恢复到起始的、非活化状态。这点好像取决于激素配体的浓度。其次,复合物的受体蛋 白C-端尾巴的丝氨酸和苏氨酸残基发生磷酸化,导致激素-受体复合物失活。B-肾上腺素受 体激酶(也称为G蛋白受体激酶-2,GK2)能够磷酸化这种激素-受体蛋白复合物的C 端,而没有与激素结合的受体C-段不能被磷酸化。最后,B-arrestin与已经磷酸化的受体蛋 白结合,消除受体蛋白对G-蛋白的活化。 ①Dissociation Receptor kinase y B-Arrestin ATP ADP ②Phosphorylation 图14.10信号终止。7TM受体的信号传导可以采用下列方式终止:(1)信号分子与受体分 子发生解离,和(2)受体蛋白处于细胞质的C-端尾巴发生磷酸化,随后与B-arrestin结合
GTP 水解后,G 蛋白自动恢复从前的结构 肾上腺素启动的信号途径如何关闭?G亚基有内在的 GTPase 活性。该活性能够将 GTP 水解,产生 GDP 和 Pi。但是 G酶促水解 GTP 的速度慢,需要几秒钟到几分钟。因此 G 结合的 GTP 能够维持一段时间以活化信号通路的下游组分。GTP 水解导致 G蛋白亚基失 去信号传递活性。本质上,该亚基结合的 GTP 充当嵌入的钟表,在 G发挥作用一段时间后 自动重置蛋白的结构。GTP 水解,释放 Pi。GDP 与 G亚基结合,后者重新与 G结合形成 没有活性的异源三聚体(图 14.9)。 图 14.9 G重置。G内在的 GTPase 活性水解 GTP 后,G重新与 二聚体结合形成异源三 聚体 G 蛋白,从而终止对腺苷酸环化酶的活化。 激素结合的活化受体必须重置,以阻止 G 蛋白的持续活化(图 14.10)。首先,激素解 离,恢复到起始的、非活化状态。这点好像取决于激素配体的浓度。其次,复合物的受体蛋 白 C-端尾巴的丝氨酸和苏氨酸残基发生磷酸化,导致激素-受体复合物失活。肾上腺素受 体激酶(也称为 G 蛋白受体激酶-2, GRK2)能够磷酸化这种激素-受体蛋白复合物的 C- 端,而没有与激素结合的受体 C-段不能被磷酸化。最后,arrestin 与已经磷酸化的受体蛋 白结合,消除受体蛋白对 G-蛋白的活化。 图 14.10 信号终止。7TM 受体的信号传导可以采用下列方式终止:(1)信号分子与受体分 子发生解离,和(2)受体蛋白处于细胞质的 C-端尾巴发生磷酸化,随后与 arrestin 结合

一些7TM受体能够活化磷酸肌醇级联反应 现在看另一个常见的第二信使级联反应。很多激素的受体也是TTM受体。磷酸肌醇级 联反应与cAMP级联反应一样,将细胞外的信息转化成细胞内信号分子。磷脂酰肌醇-4,5- 二磷酸(PP2)是细胞膜上的一种磷脂分子。信号转导途径导致该磷脂分子水解产生第二信 使。血管紧张素Ⅱ受体与控制血压的激素结合,启动的信号途径就产生这样的第二信使就 是这样的实例。 每类TTM受体所结合的G蛋白不同。肾上腺素与受体结合将G蛋白活化成G0S,血管 紧张素Ⅱ与受体结合所活化的G蛋白叫G0q。与GTP结合时,GCq能结合并活化B类磷脂 酶C。后者催化PIP2断裂形成两种第二信使,即肌酸1,4,5-三磷酸(IP3)和二酯酰甘油(DAG: 图14.11)。 Phospholipase C Phosphatidylinositol 4,5-bisphosphate(PIP,) OH OPO o, Diacylglycerol (DAG) Inositol 1,4,5-trisphosphate(IP3) Rigure 14-11 图14.11磷脂酶C酶促反应。磷脂酶C断裂膜磷脂成分磷脂酰肌醇-4,5-二磷酸,产生二酯 酰甘油(仍在膜上)和肌醇-1,4,5-三磷酸(水溶分子,在细胞质扩散)。 P3是可溶性分子,从生物膜离开进入进入细胞质溶液扩散。这个第二信使作用于C+ 库内质网膜的转移器(如Ca2+-ATPase),导致Ca2+在胞内迅速释放。P3与内质网Ca2+通道 的特异结合,通道开放使Ca+从内质网流入细胞质。Ca+本身也是第二信使:它能结合很多 蛋白质,包括普遍存在的信号传递蛋白即钙调蛋白(calmodulin)和酶(如蛋白激酶C)。采用 这些方式,C+浓度的提升能启动很多生理过程,包括平滑肌收缩、糖原分解、和囊泡释放。 DAG仍然停留在细胞膜上,但是它能够活化蛋白激酶C。蛋白激酶C能够使很多目标 蛋白的丝氨酸和苏氨酸发生磷酸化。蛋白激酶C的DAG结合域需要Ca2+才能与DAG结合。 二酰基甘油和IP3联合作用:IP3增加Ca2+浓度,Ca2+浓度提高有助于蛋白激酶C活化。图 14.12总结了磷酸肌醇级联反应。由于IP3和DAG已经通过磷酸化或其他生物过程转化成 信息,这两种第二信使的作用时间很短
一些 7TM 受体能够活化磷酸肌醇级联反应 现在看另一个常见的第二信使级联反应。很多激素的受体也是 7TM 受体。磷酸肌醇级 联反应与 cAMP 级联反应一样,将细胞外的信息转化成细胞内信号分子。磷脂酰肌醇-4,5- 二磷酸(PIP2)是细胞膜上的一种磷脂分子。信号转导途径导致该磷脂分子水解产生第二信 使。血管紧张素-II 受体与控制血压的激素结合,启动的信号途径就产生这样的第二信使就 是这样的实例。 每类 7TM 受体所结合的 G 蛋白不同。肾上腺素与受体结合将 G 蛋白活化成 Gs,血管 紧张素 II 与受体结合所活化的 G 蛋白叫 Gq。与 GTP 结合时,Gq 能结合并活化 类磷脂 酶 C。后者催化 PIP2 断裂形成两种第二信使,即肌酸 1,4,5-三磷酸(IP3)和二酯酰甘油(DAG; 图 14.11)。 图 14.11 磷脂酶 C 酶促反应。磷脂酶 C 断裂膜磷脂成分磷脂酰肌醇-4,5-二磷酸,产生二酯 酰甘油(仍在膜上)和肌醇-1,4,5-三磷酸(水溶分子,在细胞质扩散)。 IP3 是可溶性分子,从生物膜离开进入进入细胞质溶液扩散。这个第二信使作用于 Ca 2+ 库内质网膜的转移器(如 Ca 2+ -ATPase),导致 Ca 2+在胞内迅速释放。IP3 与内质网 Ca 2+通道 的特异结合,通道开放使 Ca 2+从内质网流入细胞质。Ca 2+本身也是第二信使:它能结合很多 蛋白质,包括普遍存在的信号传递蛋白即钙调蛋白(calmodulin)和酶(如蛋白激酶 C)。采用 这些方式,Ca 2+浓度的提升能启动很多生理过程,包括平滑肌收缩、糖原分解、和囊泡释放。 DAG 仍然停留在细胞膜上,但是它能够活化蛋白激酶 C。蛋白激酶 C 能够使很多目标 蛋白的丝氨酸和苏氨酸发生磷酸化。蛋白激酶 C 的 DAG 结合域需要 Ca 2+才能与 DAG 结合。 二酰基甘油和 IP3 联合作用:IP3 增加 Ca 2+浓度,Ca 2+浓度提高有助于蛋白激酶 C 活化。图 14.12 总结了磷酸肌醇级联反应。由于 IP3 和 DAG 已经通过磷酸化或其他生物过程转化成 信息,这两种第二信使的作用时间很短

Diacylglycerol(DAG) Cell membrane DAG PIP2 Phospholipase C cleavage Calcium ion Protein kinase C Cytoplasm receptor ER membrane Calciumo 00 ion 0 0 00 2007 W.H.Freeman and Company 图14.12磷脂酰肌醇级联反应。磷脂酰肌醇4,5-二磷酸(PIP2)断裂形成二脂酰甘油(DAG) 和肌醇1,4,5-三磷酸(IP3),导致Ca+释放(P3受体的离子通道开放)、活化蛋白激酶C(因 蛋白激酶C与膜上游离的DAG结合)。C+与蛋白激酶C结合有助于蛋白激酶C的活化。 Ca2+是广泛使用的第二信使 除了磷脂酰肌醇级联途径外,C+参与了很多信号传递过程。这个离子有几种特性是指 能够在细胞内广泛充当第二信使。首先,胞内Ca+浓度波动较大。在稳定状态,胞内C+ 浓度水平低,阻止生物分子的羧基或磷酸基团与Ca+结合形成沉淀。将Ca+外排,维持胞 内低浓度Ca2+。由于有这种外排作用,细胞质的Ca+浓度维持在100nM左右,比细胞外的 Ca2+浓度低几个数量级。由于稳态时Ca+浓度低,易于感知信号传递造成的Ca+浓度上升。 第二个特性是它与蛋白质结合紧密并能诱导结合蛋白发生构象变化(图14.13)。Ca2+ 与带负电荷的氧原子(由谷氨酸和天冬氨酸侧链提供)和不带电荷的氧原子(主链我基及谷 氨酰胺和天冬酰胺提供)结合牢。C+与六至八个氧原子形成配位键,将蛋白质不同区域交 联在一起,诱导蛋白质发生构象变化。 探测胞内Ca2+浓度变化(甚至是进行即时检测)方法的建立极大地促进了人们对Ca+ 在胞内生物作用的认识。这个方法有赖于人们设计的染料分子如Fura-2。Fura-2能结合Ca+, 与Ca2+结合后,Fura-2的荧光性质发生改变
图 14.12 磷脂酰肌醇级联反应。磷脂酰肌醇 4,5 - 二磷酸(PIP2)断裂形成二脂酰甘油(DAG) 和肌醇 1,4,5-三磷酸(IP3),导致 Ca 2+释放(IP3受体的离子通道开放)、活化蛋白激酶 C(因 蛋白激酶 C 与膜上游离的 DAG 结合)。Ca 2+与蛋白激酶 C 结合有助于蛋白激酶 C 的活化。 Ca 2+是广泛使用的第二信使 除了磷脂酰肌醇级联途径外,Ca 2+参与了很多信号传递过程。这个离子有几种特性是指 能够在细胞内广泛充当第二信使。首先,胞内 Ca 2+浓度波动较大。在稳定状态,胞内 Ca 2+ 浓度水平低,阻止生物分子的羧基或磷酸基团与 Ca 2+结合形成沉淀。将 Ca 2+外排,维持胞 内低浓度 Ca 2+。由于有这种外排作用,细胞质的 Ca 2+浓度维持在 100 nM 左右,比细胞外的 Ca 2+浓度低几个数量级。由于稳态时 Ca 2+浓度低,易于感知信号传递造成的 Ca 2+浓度上升。 第二个特性是它与蛋白质结合紧密并能诱导结合蛋白发生构象变化(图 14.13)。Ca 2+ 与带负电荷的氧原子(由谷氨酸和天冬氨酸侧链提供)和不带电荷的氧原子(主链羰基及谷 氨酰胺和天冬酰胺提供)结合牢。Ca 2+与六至八个氧原子形成配位键,将蛋白质不同区域交 联在一起,诱导蛋白质发生构象变化。 探测胞内 Ca 2+浓度变化(甚至是进行即时检测)方法的建立极大地促进了人们对 Ca 2+ 在胞内生物作用的认识。这个方法有赖于人们设计的染料分子如 Fura-2。Fura-2 能结合 Ca 2+, 与 Ca 2+结合后,Fura-2 的荧光性质发生改变
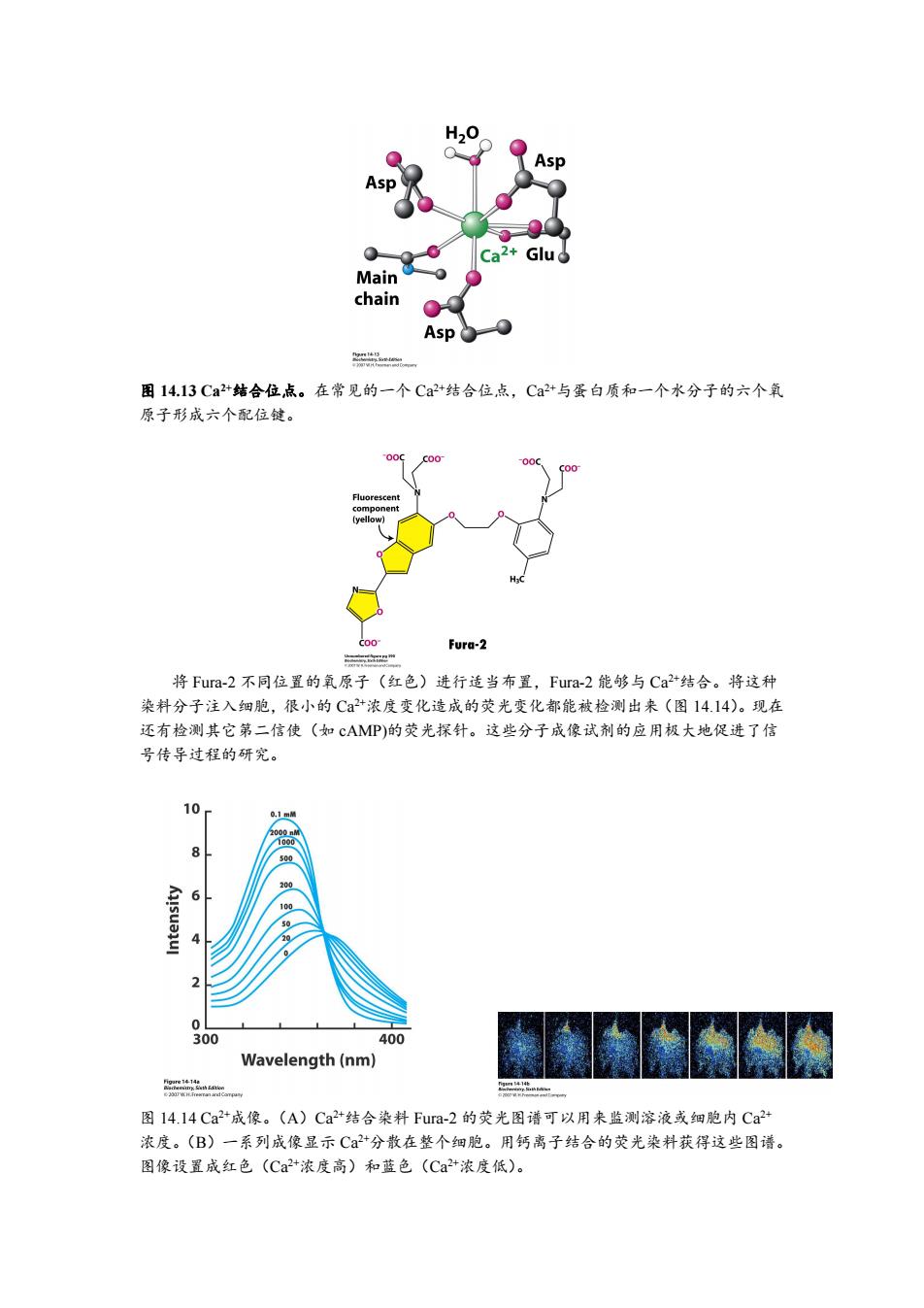
H20 Asp p Ca2+ Glud Main chain Asp 图14.13Ca2+结合位点。在常见的一个Ca2+结合位点,Ca2+与蛋白质和一个水分子的六个氧 原子形成六个配位键。 Fluorescent component C00 Fura-2 将Fura-2不同位置的氧原子(红色)进行适当布置,Fura-2能够与Ca+结合。将这种 染料分子注入细胞,很小的Ca2+浓度变化造成的荧光变化都能被检测出来(图14.14)。现在 还有检测其它第二信使(如cAMP)的荧光探针。这些分子成像试剂的应用极大地促进了信 号传导过程的研究。 10 200 100 50 20 300 400 Wavelength(nm) 图14.14Ca2+成像。(A)Ca2+结合染料Fur-2的荧光图谱可以用来监测溶液或细胞内Ca2+ 浓度。(B)一系列成像显示C+分散在整个细胞。用钙离子结合的荧光染料获得这些图谱。 图像设置成红色(Ca2+浓度高)和蓝色(Ca+浓度低)
图 14.13 Ca 2+结合位点。在常见的一个 Ca 2+结合位点,Ca 2+与蛋白质和一个水分子的六个氧 原子形成六个配位键。 将 Fura-2 不同位置的氧原子(红色)进行适当布置,Fura-2 能够与 Ca 2+结合。将这种 染料分子注入细胞,很小的 Ca 2+浓度变化造成的荧光变化都能被检测出来(图 14.14)。现在 还有检测其它第二信使(如 cAMP)的荧光探针。这些分子成像试剂的应用极大地促进了信 号传导过程的研究。 图 14.14 Ca 2+成像。(A)Ca 2+结合染料 Fura-2 的荧光图谱可以用来监测溶液或细胞内 Ca 2+ 浓度。(B)一系列成像显示 Ca 2+分散在整个细胞。用钙离子结合的荧光染料获得这些图谱。 图像设置成红色(Ca 2+浓度高)和蓝色(Ca 2+浓度低)