
第二章蛋白质的组成和结构(第六版) Primary Secondary Tertiary Quarternary structure structure structure structure 人胰岛素晶体。胰岛素是蛋白激素,是人体维持适当血糖浓度的关镀。多肽链的氨基酸序 列(一级结构)决定了蛋白质的性质。胰岛素两条多肽链折叠形成单一胰岛素分子的三级结构。 六个胰岛素分子之间相互作用形成复合物。这种复合物结构,即胰岛素分子之间的相互作用叫 蛋白质四级结构。在适当条件诱导下,胰岛素复合物能形成晶体。蛋白质晶体可以用来进行蛋 白质结构测定。 生物体内蛋白质的功能多样,它们在所有的生物过程中起关键作用。蛋白质能充当生物催 化剂(酶),能储存、运输其它分子如氧气,能给生物体提供机械支持力和免疫力,能产生运动、 发射神经冲动、控制生物体的生长与发育。实际上,本书大部分内容集中讨论蛋白质能执行哪 些功能,以及蛋白质执行这些功能的分子机理。 蛋白质具备几个关键性质使蛋白质能够执行各种各样的生物功能。 1.蛋白质是肽键连接氨基酸的线性聚合物。蛋白质能自动折叠成三维结构,而且蛋白质的三 维结构取决于蛋白质的氨基酸序列。蛋白质的功能直接依赖于蛋白质的三维结构(图2.1)。 因此,蛋白质是一维的分子序列向三维的分子功能转化的具体体现。 2.蛋白质有很多功能基团。这些功能基团包括醇羟基、巯基、巯醚基、羧基、酰胺基、和不 同的碱性基团。大多数基团有化学反应性。氨基酸序列不同,其功能基团的组合就不同, 这解释了不同蛋白质执行不同功能的原因。功能基团的化学反应性是酶催化活性必需的(见 第8至第10章)。 3.蛋白质分子之间或者蛋白质与其它分子之间能相互作用形成复合物。复合物的蛋白质组分 协同作用能够执行单一组分无法完成的功能(图2.2)。例如大分子复合物执行DA复制、 细胞内信号传递、以及其它必需的生物过程。 4.有些蛋白质很坚硬,但有些蛋白质很柔软。坚硬的蛋白质可以作为细胞骨架或粘联组织的 结构元件。而有一定柔软度的蛋白质可以充当绞合部(hinges),弹簧(springs).,或杠杆 (levers)。这些绞合部(hinges)、弹簧(springs).、或杠杆(levers)对有些蛋白质的功 能、蛋白质之间的相互作用或蛋白质与其它成分相互作用形成复合物、或者在细胞内或细 胞间传递信息是必需的
第二章 蛋白质的组成和结构(第六版) 人胰岛素晶体。胰岛素是蛋白激素,是人体维持适当血糖浓度的关键。多肽链的氨基酸序 列(一级结构)决定了蛋白质的性质。胰岛素两条多肽链折叠形成单一胰岛素分子的三级结构。 六个胰岛素分子之间相互作用形成复合物。这种复合物结构,即胰岛素分子之间的相互作用叫 蛋白质四级结构。在适当条件诱导下,胰岛素复合物能形成晶体。蛋白质晶体可以用来进行蛋 白质结构测定。 生物体内蛋白质的功能多样,它们在所有的生物过程中起关键作用。蛋白质能充当生物催 化剂(酶),能储存、运输其它分子如氧气,能给生物体提供机械支持力和免疫力,能产生运动、 发射神经冲动、控制生物体的生长与发育。实际上,本书大部分内容集中讨论蛋白质能执行哪 些功能,以及蛋白质执行这些功能的分子机理。 蛋白质具备几个关键性质使蛋白质能够执行各种各样的生物功能。 1. 蛋白质是肽键连接氨基酸的线性聚合物。蛋白质能自动折叠成三维结构,而且蛋白质的三 维结构取决于蛋白质的氨基酸序列。蛋白质的功能直接依赖于蛋白质的三维结构(图 2.1)。 因此,蛋白质是一维的分子序列向三维的分子功能转化的具体体现。 2. 蛋白质有很多功能基团。这些功能基团包括醇羟基、巯基、巯醚基、羧基、酰胺基、和不 同的碱性基团。大多数基团有化学反应性。氨基酸序列不同,其功能基团的组合就不同, 这解释了不同蛋白质执行不同功能的原因。功能基团的化学反应性是酶催化活性必需的(见 第 8 至第 10 章)。 3. 蛋白质分子之间或者蛋白质与其它分子之间能相互作用形成复合物。复合物的蛋白质组分 协同作用能够执行单一组分无法完成的功能(图 2.2)。例如大分子复合物执行 DNA 复制、 细胞内信号传递、以及其它必需的生物过程。 4. 有些蛋白质很坚硬,但有些蛋白质很柔软。坚硬的蛋白质可以作为细胞骨架或粘联组织的 结构元件。而有一定柔软度的蛋白质可以充当绞合部(hinges),弹簧(springs),或杠杆 (levers)。这些绞合部(hinges)、弹簧(springs)、或杠杆(levers)对有些蛋白质的功 能、蛋白质之间的相互作用或蛋白质与其它成分相互作用形成复合物、或者在细胞内或细 胞间传递信息是必需的

DNA 2007 W.H.Freeman and Company 图2.1结构决定功能。DNA复制机器的一个蛋白组分围绕DNA双螺旋的一个区域(圆柱形)。含 有两个完全相同亚基的蛋白质(分别用红色和黄色表示)像一把夹子夹住复制DNA,使复制DNA 不会与复制机器解离。 ● ● 图2.2蛋白质复合物。昆虫飞行组织切片的电子显微镜图谱,其中两种蛋白质纤维呈六边形排 列[Courtesy of Dr.Michael Reedy]
图 2.1 结构决定功能。DNA 复制机器的一个蛋白组分围绕 DNA 双螺旋的一个区域(圆柱形)。含 有两个完全相同亚基的蛋白质(分别用红色和黄色表示)像一把夹子夹住复制 DNA,使复制 DNA 不会与复制机器解离。 图 2.2 蛋白质复合物。昆虫飞行组织切片的电子显微镜图谱,其中两种蛋白质纤维呈六边形排 列[Courtesy of Dr. Michael Reedy]
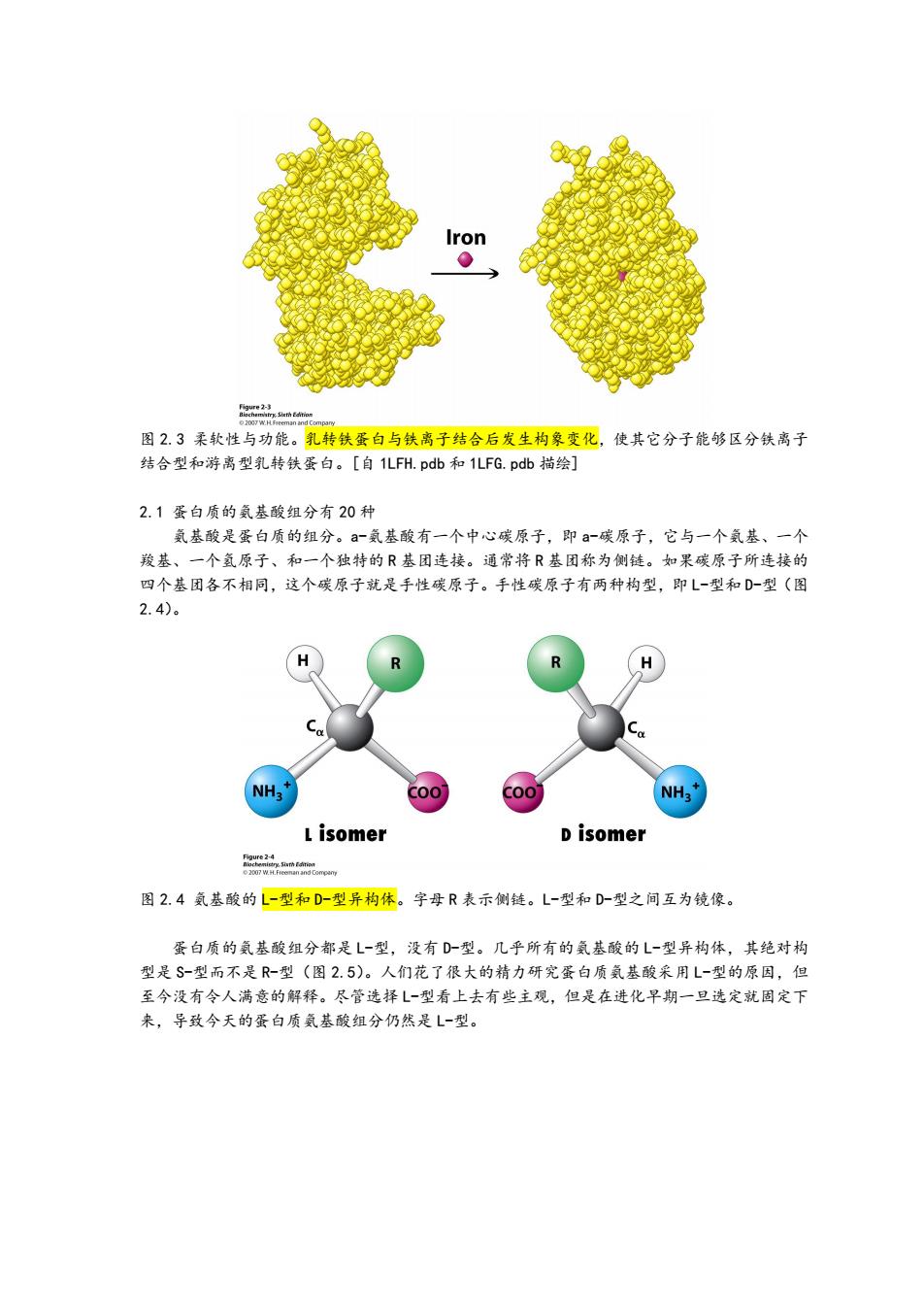
Iron 品 图2.3柔软性与功能。乳转铁蛋白与铁离子结合后发生构象变化,使其它分子能够区分铁离子 结合型和游离型乳转铁蛋白。[自1LFH.pdb和1LFG.pdb描绘] 2.1蛋白质的氨基酸组分有20种 氨基酸是蛋白质的组分。a-氨基酸有一个中心碳原子,即a-碳原子,它与一个氨基、一个 羧基、一个氢原子、和一个独特的R基团连接。通常将R基团称为侧链。如果碳原子所连接的 四个基团各不相同,这个碳原子就是手性碳原子。手性碳原子有两种构型,即L一型和D-型(图 2.4)。 R NH3 c00 L isomer D isomer n w 图2.4氨基酸的L-型和D-型异构体。字母R表示侧链。L-型和D-型之间互为镜像。 蛋白质的氨基酸组分都是L一型,没有D型。几乎所有的氨基酸的L一型异构体,其绝对构 型是S-型而不是R-型(图2.5)。人们花了很大的精力研究蛋白质氨基酸采用L-型的原因,但 至今没有令人满意的解释。尽管选择L一型看上去有些主观,但是在进化早期一旦选定就固定下 来,导致今天的蛋白质氨基酸组分仍然是L一型
图 2.3 柔软性与功能。乳转铁蛋白与铁离子结合后发生构象变化,使其它分子能够区分铁离子 结合型和游离型乳转铁蛋白。[自 1LFH.pdb 和 1LFG.pdb 描绘] 2.1 蛋白质的氨基酸组分有 20 种 氨基酸是蛋白质的组分。a-氨基酸有一个中心碳原子,即 a-碳原子,它与一个氨基、一个 羧基、一个氢原子、和一个独特的 R 基团连接。通常将 R 基团称为侧链。如果碳原子所连接的 四个基团各不相同,这个碳原子就是手性碳原子。手性碳原子有两种构型,即 L-型和 D-型(图 2.4)。 图 2.4 氨基酸的 L-型和 D-型异构体。字母 R 表示侧链。L-型和 D-型之间互为镜像。 蛋白质的氨基酸组分都是 L-型,没有 D-型。几乎所有的氨基酸的 L-型异构体,其绝对构 型是 S-型而不是 R-型(图 2.5)。人们花了很大的精力研究蛋白质氨基酸采用 L-型的原因,但 至今没有令人满意的解释。尽管选择 L-型看上去有些主观,但是在进化早期一旦选定就固定下 来,导致今天的蛋白质氨基酸组分仍然是 L-型

R (3) 2H(4) (1) (2) Q NH3 00 22n 图2.5蛋白质的氨基酸组分只有L-型。几乎所有L-型氨基酸的绝对构型是S型,即从最高优 先权替代基团至最低优先权替代基团呈逆时针时表明该手性碳原子是$-构型。 中性p“溶液中氨基酸主要是双极性离子解离型(也称为两性离子)。此时,氨基质子化成 铵离子(-NH),羧基脱质子成羧酸根离子(-C00)。氨基酸的解离状态受溶液pH值影响(图2.6)。 在酸性溶液中(如pH1),氨基酸的氨基质子化(-NH),但羧基不解离(-C00H)。随着pH值增 加,羧酸基团丢失质子变成-C00(因为羧基的pKa值接近2)。双极性离子状态持续到pH值至 9。pH值超过9导致铵离子丢失质子。 H N COOH H N H2N -coo 10 24 图2.6p州值控制离子化状态。改变溶液p州值能改变氨基酸的解离状态。中性pH溶液的氨基酸 呈两性离子。 20种氨基酸的侧链R各不相同,其差异表现在侧链的大小、形状、电荷、氢键形成能力、 疏水性、和化学反应性。实际上所有生物的蛋白质都由这20种氨基酸组成,只有几个例外。这 种方式组成蛋白质已经有几十亿年了。蛋白质能够执行不同功能来自于蛋白质组分氨基酸的多 样性。研究氨基酸如何构建成能够执行特定功能蛋白质的三维结构是生物化学令人兴奋的研究 领域,我们在2.6节将讨论这个问题。 现在我们来看看这20种氨基酸。最简单的氨基酸是甘氨酸,其侧链就是氢原子。有两个氢 原子与-碳原子结合,因此甘氦酸是唯一的一个非手性氨基酸(即对称氦基酸)。第二个简单 气基酸是丙氨酸,其侧链是甲基(-CH)(图2.7)
图 2.5 蛋白质的氨基酸组分只有 L-型。几乎所有 L-型氨基酸的绝对构型是 S 型,即从最高优 先权替代基团至最低优先权替代基团呈逆时针时表明该手性碳原子是 S-构型。 中性 pH 溶液中氨基酸主要是双极性离子解离型(也称为两性离子)。此时,氨基质子化成 铵离子(-NH4 +),羧基脱质子成羧酸根离子(-COO -)。氨基酸的解离状态受溶液 pH 值影响(图 2.6)。 在酸性溶液中(如 pH 1),氨基酸的氨基质子化(-NH4 +),但羧基不解离(-COOH)。随着 pH 值增 加,羧酸基团丢失质子变成-COO -(因为羧基的 pKa 值接近 2)。双极性离子状态持续到 pH 值至 9。pH 值超过 9 导致铵离子丢失质子。 图 2.6 pH 值控制离子化状态。改变溶液 pH 值能改变氨基酸的解离状态。中性 pH 溶液的氨基酸 呈两性离子。 20 种氨基酸的侧链 R 各不相同,其差异表现在侧链的大小、形状、电荷、氢键形成能力、 疏水性、和化学反应性。实际上所有生物的蛋白质都由这 20 种氨基酸组成,只有几个例外。这 种方式组成蛋白质已经有几十亿年了。蛋白质能够执行不同功能来自于蛋白质组分氨基酸的多 样性。研究氨基酸如何构建成能够执行特定功能蛋白质的三维结构是生物化学令人兴奋的研究 领域,我们在 2.6 节将讨论这个问题。 现在我们来看看这 20 种氨基酸。最简单的氨基酸是甘氨酸,其侧链就是氢原子。有两个氢 原子与 a-碳原子结合,因此甘氨酸是唯一的一个非手性氨基酸(即对称氨基酸)。第二个简单 氨基酸是丙氨酸,其侧链是甲基(-CH3)(图 2.7)
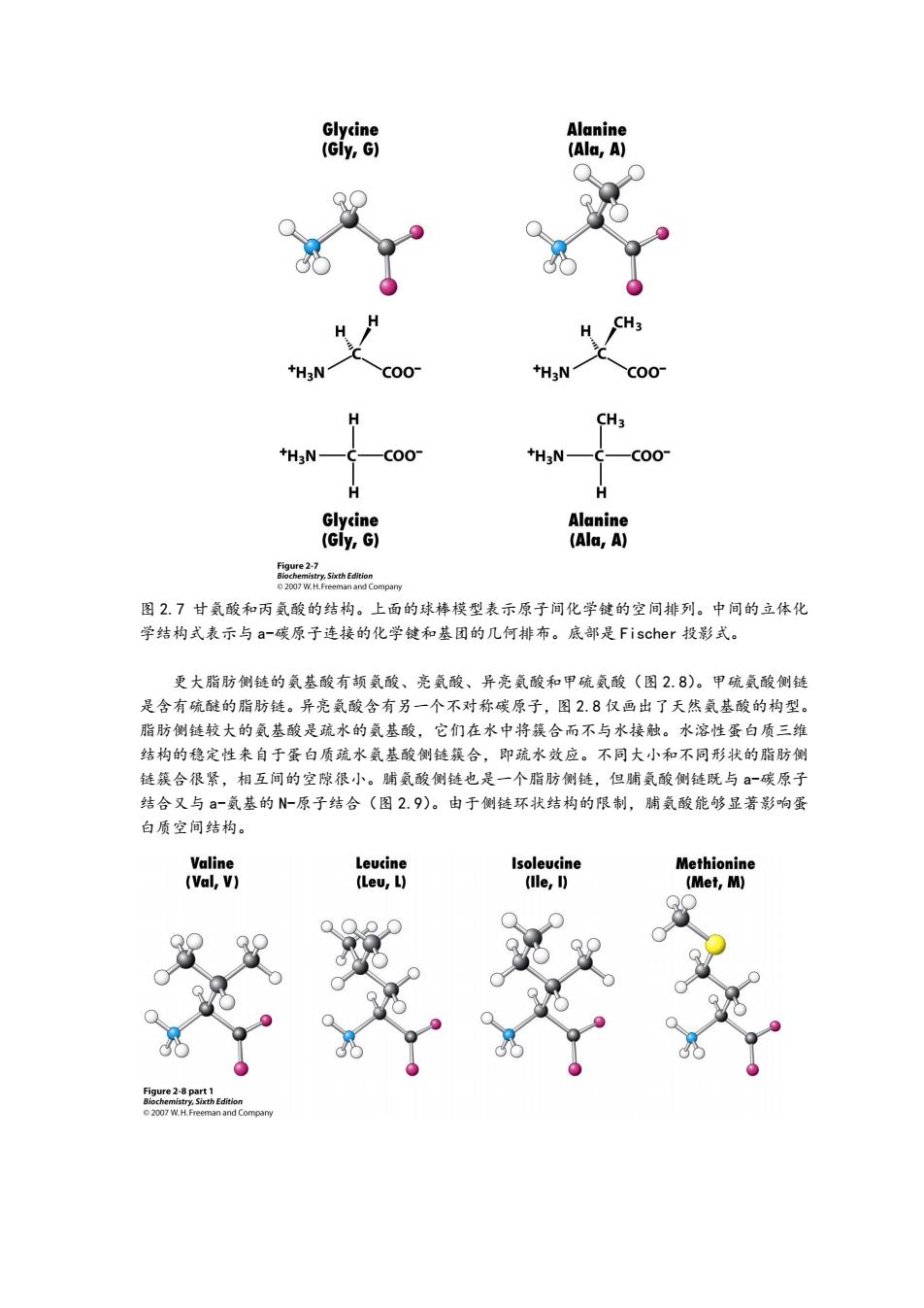
Glycine Alanine (Gly,G) (Ala,A) C00 +H3N C00 H CH C00- +H3N C00 H Glycine Alanine (Gly,G) (Ala,A) Figure2-7 图2.7甘氨酸和丙氨酸的结构。上面的球棒模型表示原子间化学键的空间排列。中间的立体化 学结构式表示与a-碳原子连接的化学键和基团的几何排布。底部是Fischer投影式。 更大脂肪侧链的氨基酸有颉氨酸、亮氨酸、异亮氨酸和甲硫氨酸(图2.8)。甲硫氨酸侧链 是含有硫醚的脂肪链。异亮氨酸含有另一个不对称碳原子,图28仅画出了天然氨基酸的构型。 脂肪侧链较大的氨基酸是疏水的氨基酸,它们在水中将簇合而不与水接触。水溶性蛋白质三维 结构的稳定性来自于蛋白质疏水氨基酸侧链簇合,即疏水效应。不同大小和不同形状的脂肪侧 链簇合很紧,相互间的空隙很小。脯氨酸侧链也是一个脂肪侧链,但脯氨酸侧链既与-碳原子 结合又与-氨基的N-原子结合(图2.9)。由于侧链环状结构的限制,脯氨酸能够显著影响蛋 白质空间结构。 Valine Leucine Isoleucine Methionine (Val,V) (Lev,L) (lle,I) (Met,M) Figure 2-8 part 1 Biochemistry.Sixth Edition 2007 W.H.Freeman and Company
图 2.7 甘氨酸和丙氨酸的结构。上面的球棒模型表示原子间化学键的空间排列。中间的立体化 学结构式表示与 a-碳原子连接的化学键和基团的几何排布。底部是 Fischer 投影式。 更大脂肪侧链的氨基酸有颉氨酸、亮氨酸、异亮氨酸和甲硫氨酸(图 2.8)。甲硫氨酸侧链 是含有硫醚的脂肪链。异亮氨酸含有另一个不对称碳原子,图 2.8 仅画出了天然氨基酸的构型。 脂肪侧链较大的氨基酸是疏水的氨基酸,它们在水中将簇合而不与水接触。水溶性蛋白质三维 结构的稳定性来自于蛋白质疏水氨基酸侧链簇合,即疏水效应。不同大小和不同形状的脂肪侧 链簇合很紧,相互间的空隙很小。脯氨酸侧链也是一个脂肪侧链,但脯氨酸侧链既与 a-碳原子 结合又与 a-氨基的 N-原子结合(图 2.9)。由于侧链环状结构的限制,脯氨酸能够显著影响蛋 白质空间结构
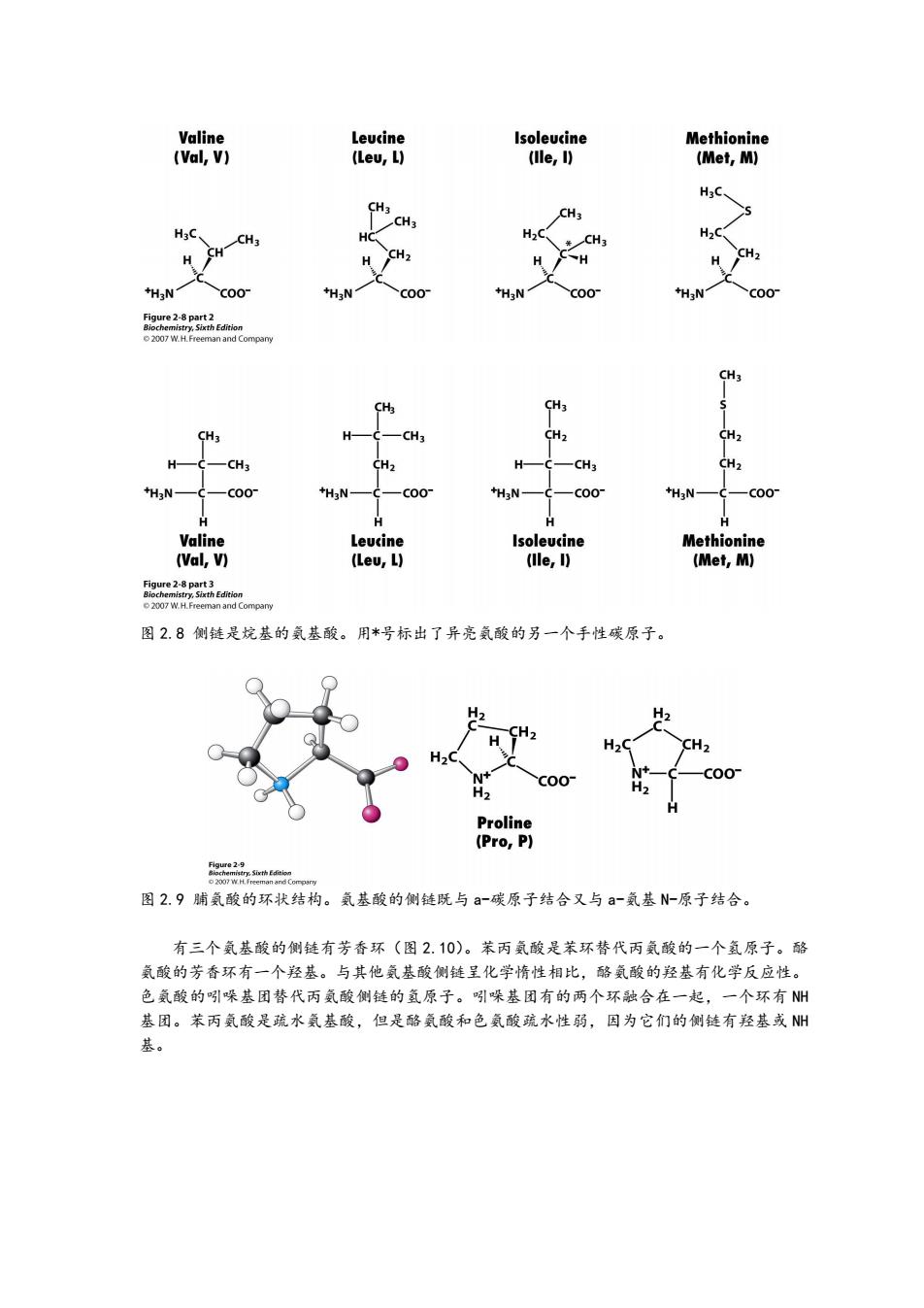
Valine Leucine Isoleucine Methionine (Val,V) (Lev,L) (le,) (Met,M) H3C、 CH3 CH3 CH3 HgC SH一CH3 H>C 一CH3 H2C H CH2 H CH +H3N +H3N C00 HgN 5ee2p2f4n 2007 W.H.Freeman and Compary CH3 CH3 CH3 -CH3 CH2 CH2 H CH3 CH2 H- CH3 CH2 +H3N C00 *H2N- -C00 +H3N- c00 +H2N- C00 H H H Valine Leucine Isoleucine Methionine (Val,V) (Leu,L) (lle,I) (Met,M) Figure 2-8 part 3 Biochemistry,Sixth Edition 2007 W.H.Freeman and Compary 图28侧链是烷基的氨基酸。用*号标出了异亮氨酸的另一个手性碳原子。 H2 CH2 H2C CH2 C00 H2 H2 Proline (Pro,P) 图2.9脯氨酸的环状结构。氨基酸的侧链既与a-碳原子结合又与a-氨基N-原子结合。 有三个氨基酸的侧链有芳香环(图2.10)。苯丙氨酸是苯环替代丙氨酸的一个氢原子。酪 氨酸的芳香环有一个羟基。与其他氨基酸侧链呈化学惰性相比,酪氨酸的羟基有化学反应性。 色氨酸的吲引哚基团替代丙氨酸侧链的氢原子。吲引哚基团有的两个环融合在一起,一个环有N州 基团。苯丙氨酸是疏水氨基酸,但是酪氨酸和色氨酸疏水性弱,因为它们的侧链有羟基或州 基
图 2.8 侧链是烷基的氨基酸。用*号标出了异亮氨酸的另一个手性碳原子。 图 2.9 脯氨酸的环状结构。氨基酸的侧链既与 a-碳原子结合又与 a-氨基 N-原子结合。 有三个氨基酸的侧链有芳香环(图 2.10)。苯丙氨酸是苯环替代丙氨酸的一个氢原子。酪 氨酸的芳香环有一个羟基。与其他氨基酸侧链呈化学惰性相比,酪氨酸的羟基有化学反应性。 色氨酸的吲哚基团替代丙氨酸侧链的氢原子。吲哚基团有的两个环融合在一起,一个环有 NH 基团。苯丙氨酸是疏水氨基酸,但是酪氨酸和色氨酸疏水性弱,因为它们的侧链有羟基或 NH 基
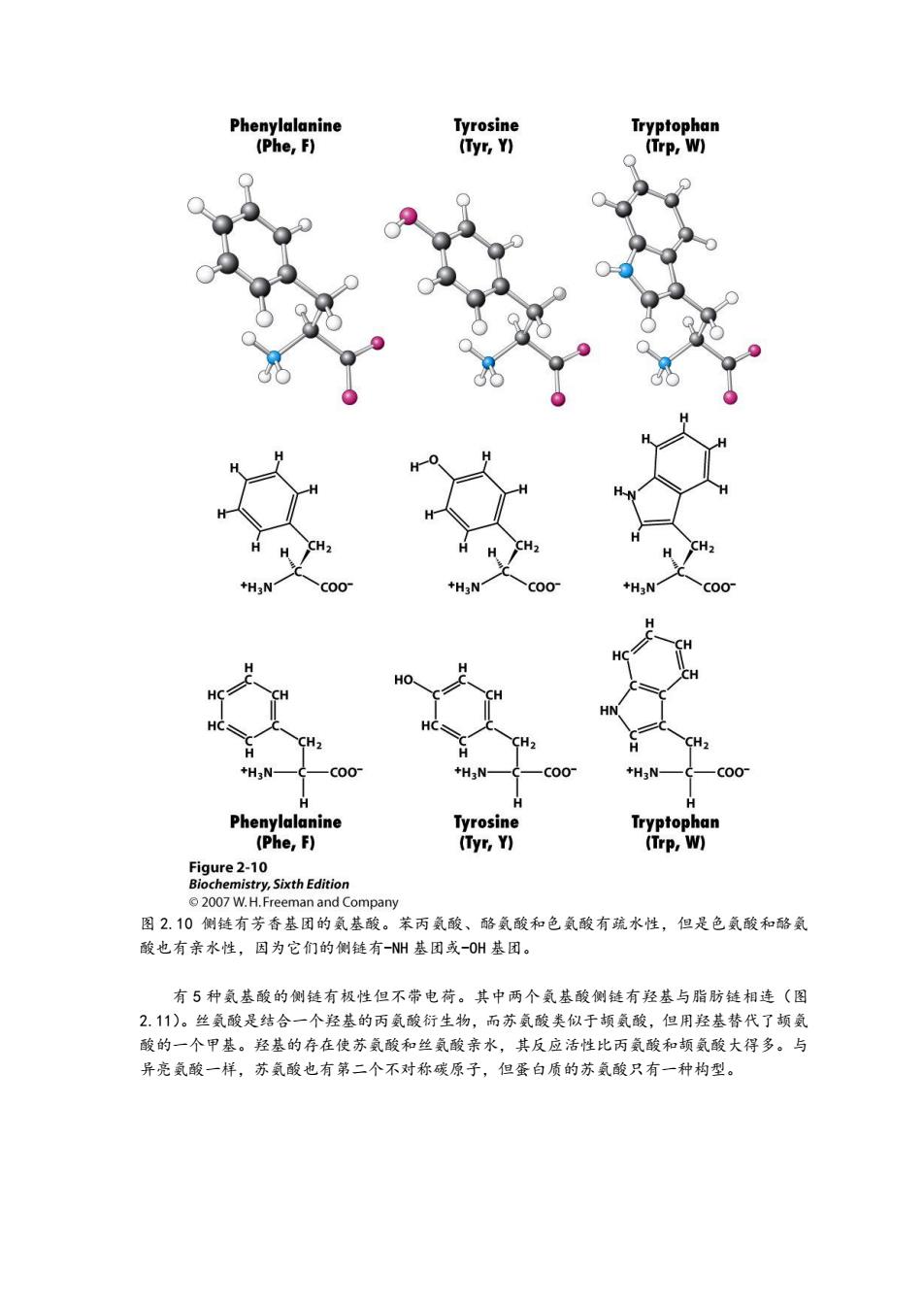
Phenylalanine Tyrosine Tryptophan (Phe,F) (yr,) (Trp,W) +H, C00 H HO HN CH2 CH2 CH, +H3N- C00 +H3N- C00 +H3N- coo H H H Phenylalanine Tyrosine Tryptophan (Phe,F) (Tyr,Y) (Trp,W) Figure 2-10 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图2.10侧链有芳香基团的氨基酸。苯丙氨酸、酪氦酸和色氨酸有疏水性,但是色氨酸和酪氨 酸也有亲水性,因为它们的侧链有-N州基团或-OH基团。 有5种氨基酸的侧链有极性但不带电荷。其中两个氨基酸侧链有羟基与脂肪链相连(图 2.11)。丝氨酸是结合一个羟基的丙氨酸衍生物,而苏氨酸类似于顿氨酸,但用羟基替代了颉氨 酸的一个甲基。羟基的存在使苏氨酸和丝氨酸亲水,其反应活性比丙氨酸和颉氨酸大得多。与 异亮氨酸一样,苏氨酸也有第二个不对称碳原子,但蛋白质的苏氨酸只有一种构型
图 2.10 侧链有芳香基团的氨基酸。苯丙氨酸、酪氨酸和色氨酸有疏水性,但是色氨酸和酪氨 酸也有亲水性,因为它们的侧链有-NH 基团或-OH 基团。 有 5 种氨基酸的侧链有极性但不带电荷。其中两个氨基酸侧链有羟基与脂肪链相连(图 2.11)。丝氨酸是结合一个羟基的丙氨酸衍生物,而苏氨酸类似于颉氨酸,但用羟基替代了颉氨 酸的一个甲基。羟基的存在使苏氨酸和丝氨酸亲水,其反应活性比丙氨酸和颉氨酸大得多。与 异亮氨酸一样,苏氨酸也有第二个不对称碳原子,但蛋白质的苏氨酸只有一种构型
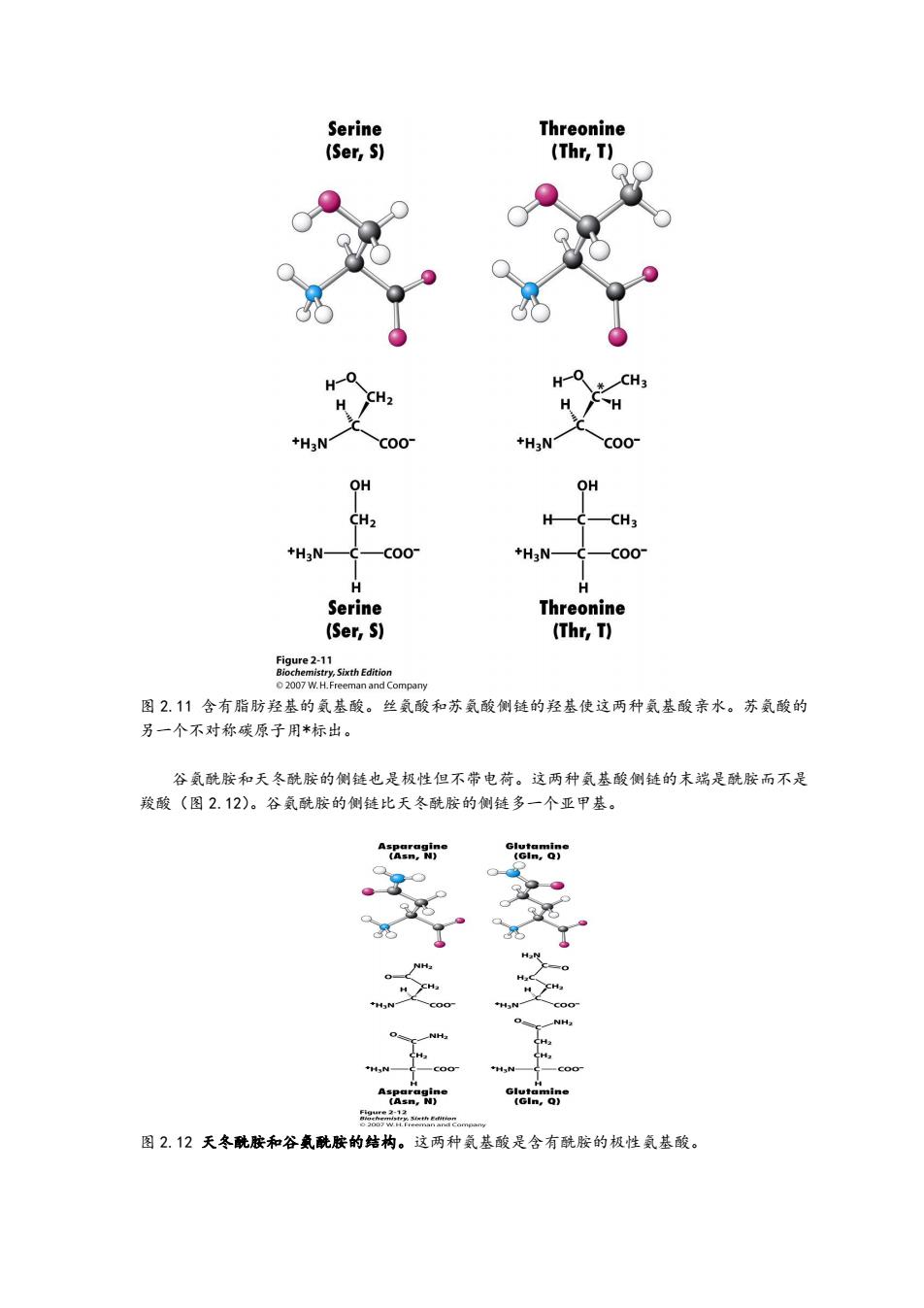
Serine Threonine (Ser,S) (Thr,T) H +H3N C00- +H3N C00 OH OH CH2 H —CH3 +H3N一 -C00 +H3N- -C00 H H Serine Threonine (Ser,S) (Thr,T) Figure 2-11 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图2.11含有脂肪羟基的氨基酸。丝氨酸和苏氨酸侧链的羟基使这两种氨基酸亲水。苏氨酸的 另一个不对称碳原子用*标出。 谷氨酰胺和天冬酰胺的侧链也是极性但不带电荷。这两种氨基酸侧链的末端是酰胺而不是 羧酸(图2.12)。谷氨酰胺的侧链比天冬酰胺的侧链多一个亚甲基。 Glutamine (GIn,Q) - H义 H *H3N- NH NH .H3 +H]N- HgN- Asparagine Glutamine 《asn,N) (GIn,Q) 8aoy 图2.12天冬酰胺和谷氨酰胺的结构。这两种氨基酸是含有酰胺的极性氨基酸
图 2.11 含有脂肪羟基的氨基酸。丝氨酸和苏氨酸侧链的羟基使这两种氨基酸亲水。苏氨酸的 另一个不对称碳原子用*标出。 谷氨酰胺和天冬酰胺的侧链也是极性但不带电荷。这两种氨基酸侧链的末端是酰胺而不是 羧酸(图 2.12)。谷氨酰胺的侧链比天冬酰胺的侧链多一个亚甲基。 图 2.12 天冬酰胺和谷氨酰胺的结构。这两种氨基酸是含有酰胺的极性氨基酸
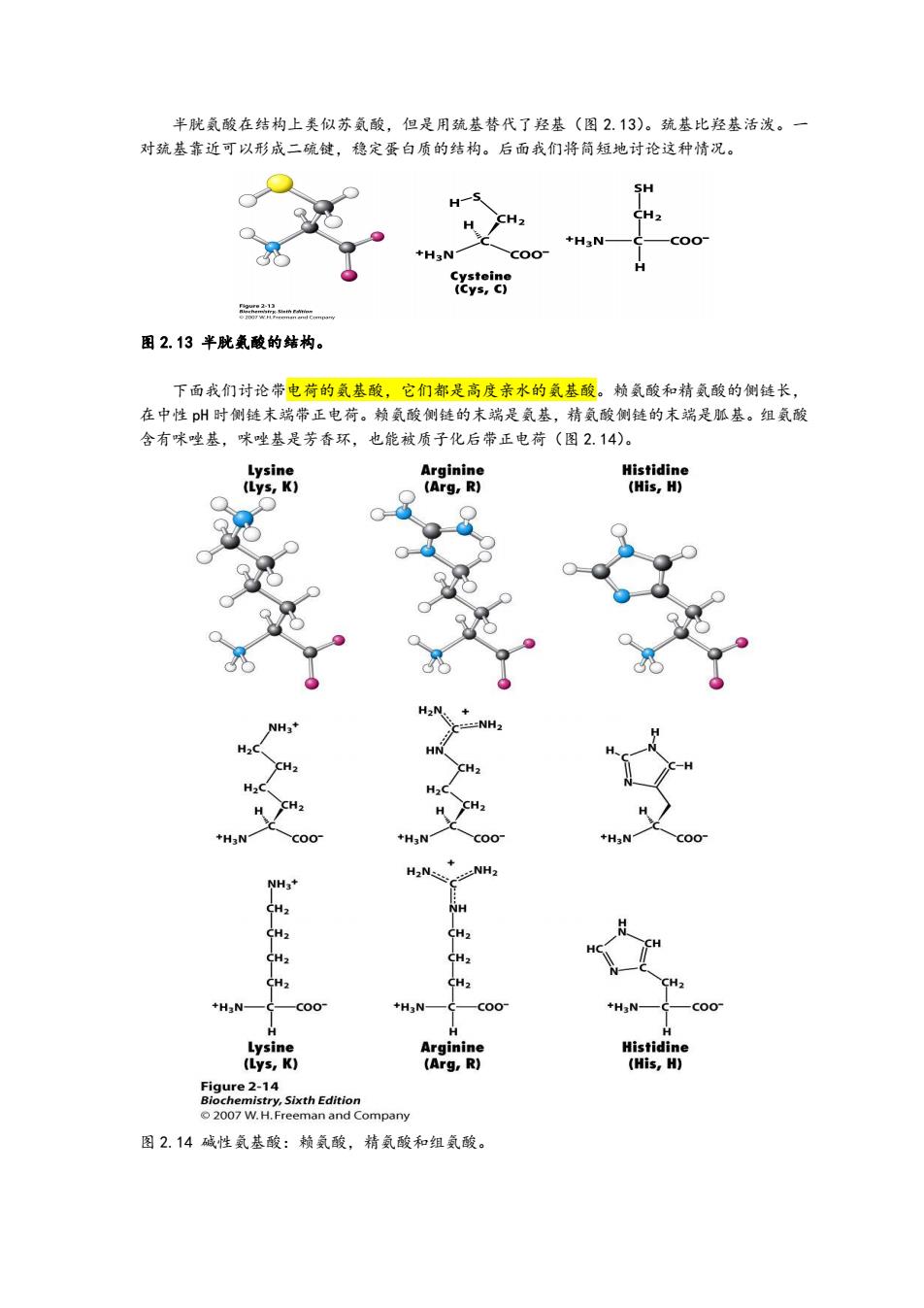
半胱氨酸在结构上类似苏氨酸,但是用巯基替代了羟基(图2.13)。巯基比羟基活泼。一 对巯基靠近可以形成二硫键,稳定蛋白质的结构。后面我们将简短地讨论这种情况。 SH H-S H CH2 CH2 +H3N- coo +H3N Cysteine (Cys,C) 图2.13半胱氨酸的结构。 下面我们讨论带电荷的氨基酸,它们都是高度亲水的氨基酸。赖氨酸和精氨酸的侧链长, 在中性p州时侧链末端带正电荷。赖氨酸侧链的末瑞是氨基,精氨酸侧链的末端是胍基。组氨酸 含有咪唑基,咪唑基是芳香环,也能被质子化后带正电荷(图2.14)。 Lysine Arginine Histidine (Lys,K) (Arg,R) (His,H) +H:N NH3+ CH2 NH CH CH2 CH2 CH2 CH H3N- +H3N- H3N一 Lysine Arginine Histidine (Lys,K) (Arg,R) (His,H) Figure 2-14 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图2.14碱性氨基酸:赖氨酸,精氨酸和组氨酸
半胱氨酸在结构上类似苏氨酸,但是用巯基替代了羟基(图 2.13)。巯基比羟基活泼。一 对巯基靠近可以形成二硫键,稳定蛋白质的结构。后面我们将简短地讨论这种情况。 图 2.13 半胱氨酸的结构。 下面我们讨论带电荷的氨基酸,它们都是高度亲水的氨基酸。赖氨酸和精氨酸的侧链长, 在中性 pH 时侧链末端带正电荷。赖氨酸侧链的末端是氨基,精氨酸侧链的末端是胍基。组氨酸 含有咪唑基,咪唑基是芳香环,也能被质子化后带正电荷(图 2.14)。 图 2.14 碱性氨基酸:赖氨酸,精氨酸和组氨酸
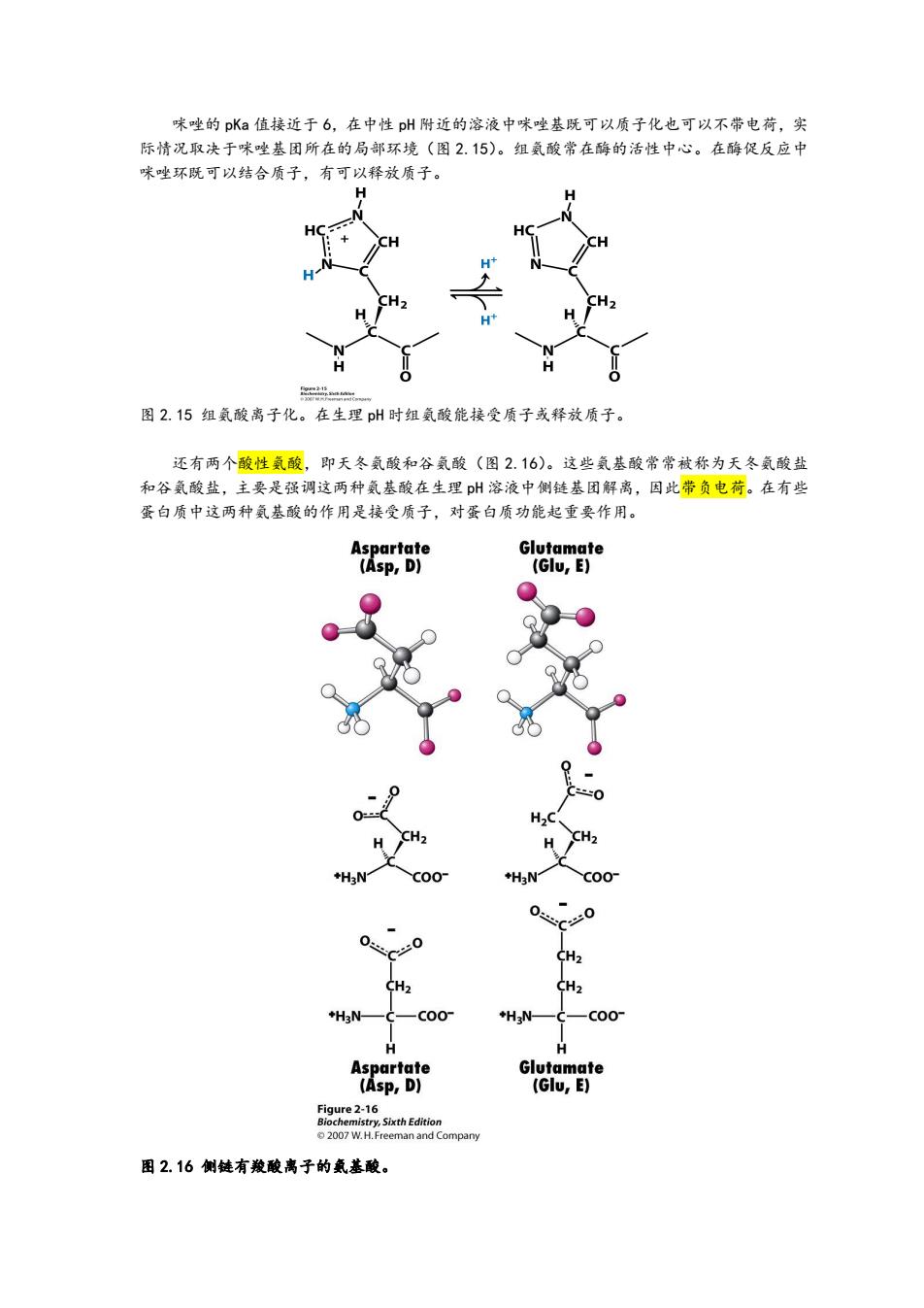
味唑的pKa值接近于6,在中性p州附近的溶液中咪唑基既可以质子化也可以不带电荷,实 际情况取决于咪唑基团所在的局部环境(图2.15)。组氨酸常在酶的活性中心。在酶促反应中 咪唑环既可以结合质子,有可以释放质子。 H 图2.15组氨酸离子化。在生理pH时组氨酸能接受质子或释放质子。 还有两个酸性氨酸,即天冬氨酸和谷氨酸(图2.16)。这些氨基酸常常被称为天冬氨酸盐 和谷氨酸盐,主要是强调这两种氨基酸在生理p州溶液中侧链基团解离,因此带负电荷。在有些 蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。 Aspartate Glutamate (Asp,D) (Glu,E) ℃0 CH2 CH2 CH2 +H3N- C00° +H3N- -C00 H Aspartate Glutamate (Asp,D) (Glu,E) Figure 2-16 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 图2.16侧链有羧酸离子的氨基酸
咪唑的 pKa 值接近于 6,在中性 pH 附近的溶液中咪唑基既可以质子化也可以不带电荷,实 际情况取决于咪唑基团所在的局部环境(图 2.15)。组氨酸常在酶的活性中心。在酶促反应中 咪唑环既可以结合质子,有可以释放质子。 图 2.15 组氨酸离子化。在生理 pH 时组氨酸能接受质子或释放质子。 还有两个酸性氨酸,即天冬氨酸和谷氨酸(图 2.16)。这些氨基酸常常被称为天冬氨酸盐 和谷氨酸盐,主要是强调这两种氨基酸在生理 pH 溶液中侧链基团解离,因此带负电荷。在有些 蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。 图 2.16 侧链有羧酸离子的氨基酸