
第十三章膜通道和泵 m7r气rm- 3 经过单一膜通道的离子流动(在左边的示意图中用红色表示通道)可以用全自动膜片钳测定。 这种技术能够记录通道开放和关闭状态的电流。 生物膜的脂质双层结构本身是离子和极性分子的通透障碍。但是要维持正常的细胞功 能,生物膜必须允许一些离子和极性分子通过。两类膜蛋白,即泵和通道,使生物膜具有这 样的功能。泵的能量来自能源分子如ATP的水解,或者是光能。泵能利用这些能源驱动离 子或分子作热力学的逆向运输(主动运输)。相反,通道不用能量,只是允许离子或分子作 热力学顺向运输(被动运输)。 泵是一种能量传导装置,能够将一种形式的自由能转化成另一种形式的自由能。ATP驱 动的泵油两种,P型ATP酶和和含有ATP结合盒(ABC)的运输器(transporter)。这两种 泵与ATP结合、水解ATP导致泵分子构型转化,使泵结合的离子被跨膜运输。另一种机制 利用离子梯度驱动其它物质跨膜运输。大肠杆菌乳糖运输器是这类次级运输器的一个例子。 乳糖运输器负责细菌从环境摄取特定糖分子。细胞膜有很多这类运输器。这些运输器的表达 决定了细胞所摄取物质的种类。因此调节运输器的表达是控制细胞代谢的主要手段。 泵能够建立特定离子持久的跨膜梯度。特定的离子通道允许这些离子迅速跨膜运输到浓 度低的一面(被动运输)。由于这些离子通道允许一些离子跨膜流过,而另一些离子(甚至 是那些与可跨膜流过离子密切相关的离子)不能通过,因此这些通道成为生物化学最迷人的 分子。这些门控离子通道在执行神经系统功能方面起中心作用。神经系统充当导线,允许精 细切换神经信号的快速流动。 最后,我们讨论另一种种通道,即细胞与细胞之间的通道(或缝隙连接,gap-junction).。 这种通道允许离子或代谢物质在细胞之间进行运输。例如分析连接的细胞间物质运输负责心 脏跳动时肌肉细胞同步收缩。 运输器的表达在很大程度上确定了特定细胞的代谢活性 各种细胞表达一套独有的细胞质膜运输器。由于这些运输器在很大程度上确定了细胞从 环境摄取离子和代谢物的模式,因此细胞表达的运输器组合非常重要。有些情况下,一个细 胞所表达的运输器组合就决定了这个细胞的性质,因为这个细胞只能摄取特定底物从而只能 执行特定的生物化学反应。 葡萄糖代谢能用来解释这种观,点。如同我们在第16章葡萄糖代谢部分将详细讨论的, 组织之间的差异在于他们利用不同分子充当能源的能力。哪个组织能够利用葡萄糖主要取决 于它们表达葡萄糖运输器的情况。这些葡萄糖运输器包括GLUT1,GLUT2,GLUT3,GLUT4, 和GLUT5。例如GLUT3只在神经元和集中其它类型的细胞表达。在葡萄糖浓度相对较低 时,GLUT3与葡萄糖结合相对较紧。在控制和整合活体代谢方面,这些运输器的表达非常
第十三章 膜通道和泵 经过单一膜通道的离子流动(在左边的示意图中用红色表示通道)可以用全自动膜片钳测定。 这种技术能够记录通道开放和关闭状态的电流。 生物膜的脂质双层结构本身是离子和极性分子的通透障碍。但是要维持正常的细胞功 能,生物膜必须允许一些离子和极性分子通过。两类膜蛋白,即泵和通道,使生物膜具有这 样的功能。泵的能量来自能源分子如 ATP 的水解,或者是光能。泵能利用这些能源驱动离 子或分子作热力学的逆向运输(主动运输)。相反,通道不用能量,只是允许离子或分子作 热力学顺向运输(被动运输)。 泵是一种能量传导装置,能够将一种形式的自由能转化成另一种形式的自由能。ATP 驱 动的泵油两种,P-型 ATP 酶和和含有 ATP 结合盒(ABC)的运输器(transporter)。这两种 泵与 ATP 结合、水解 ATP 导致泵分子构型转化,使泵结合的离子被跨膜运输。另一种机制 利用离子梯度驱动其它物质跨膜运输。大肠杆菌乳糖运输器是这类次级运输器的一个例子。 乳糖运输器负责细菌从环境摄取特定糖分子。细胞膜有很多这类运输器。这些运输器的表达 决定了细胞所摄取物质的种类。因此调节运输器的表达是控制细胞代谢的主要手段。 泵能够建立特定离子持久的跨膜梯度。特定的离子通道允许这些离子迅速跨膜运输到浓 度低的一面(被动运输)。由于这些离子通道允许一些离子跨膜流过,而另一些离子(甚至 是那些与可跨膜流过离子密切相关的离子)不能通过,因此这些通道成为生物化学最迷人的 分子。这些门控离子通道在执行神经系统功能方面起中心作用。神经系统充当导线,允许精 细切换神经信号的快速流动。 最后,我们讨论另一种种通道,即细胞与细胞之间的通道(或缝隙连接,gap-junction)。 这种通道允许离子或代谢物质在细胞之间进行运输。例如分析连接的细胞间物质运输负责心 脏跳动时肌肉细胞同步收缩。 运输器的表达在很大程度上确定了特定细胞的代谢活性 各种细胞表达一套独有的细胞质膜运输器。由于这些运输器在很大程度上确定了细胞从 环境摄取离子和代谢物的模式,因此细胞表达的运输器组合非常重要。有些情况下,一个细 胞所表达的运输器组合就决定了这个细胞的性质,因为这个细胞只能摄取特定底物从而只能 执行特定的生物化学反应。 葡萄糖代谢能用来解释这种观点。如同我们在第 16 章葡萄糖代谢部分将详细讨论的, 组织之间的差异在于他们利用不同分子充当能源的能力。哪个组织能够利用葡萄糖主要取决 于它们表达葡萄糖运输器的情况。这些葡萄糖运输器包括 GLUT1, GLUT2, GLUT3, GLUT4, 和 GLUT5。例如 GLUT3 只在神经元和集中其它类型的细胞表达。在葡萄糖浓度相对较低 时,GLUT3 与葡萄糖结合相对较紧。在控制和整合活体代谢方面,这些运输器的表达非常
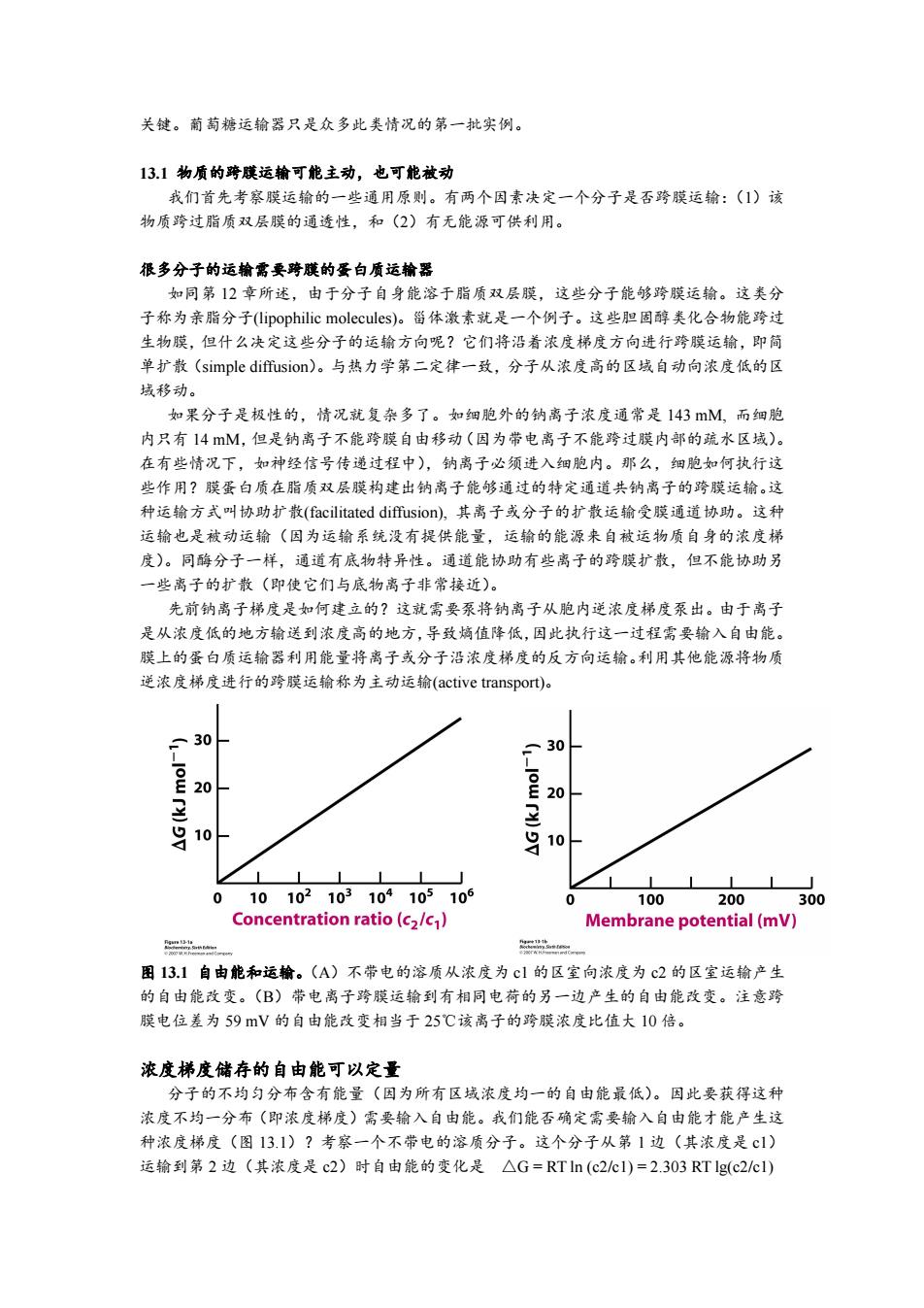
关键。葡萄糖运输器只是众多此类情况的第一批实例。 13.1物质的跨膜运输可能主动,也可能被动 我们首先考察膜运输的一些通用原则。有两个因素决定一个分子是否跨膜运输:(1)该 物质跨过脂质双层膜的通透性,和(2)有无能源可供利用。 很多分子的运输需要跨膜的蛋白质运输器 如同第12章所述,由于分子自身能溶于脂质双层膜,这些分子能够跨膜运输。这类分 子称为亲脂分子((lipophilic molecules)。甾体激素就是一个例子。这些胆固醇类化合物能跨过 生物膜,但什么决定这些分子的运输方向呢?它们将沿着浓度梯度方向进行跨膜运输,即简 单扩散(simple diffusion)。与热力学第二定律一致,分子从浓度高的区域自动向浓度低的区 域移动。 如果分子是极性的,情况就复杂多了。如细胞外的钠离子浓度通常是143mM,而细胞 内只有14M,但是钠离子不能跨膜自由移动(因为带电离子不能跨过膜内部的疏水区域)。 在有些情况下,如神经信号传递过程中),钠离子必须进入细胞内。那么,细胞如何执行这 些作用?膜蛋白质在脂质双层膜构建出钠离子能够通过的特定通道共钠离子的跨膜运输。这 种运输方式叫协助扩散(facilitated diffusion),其离子或分子的扩散运输受膜通道协助。这种 运输也是被动运输(因为运输系统没有提供能量,运输的能源来自被运物质自身的浓度梯 度)。同酶分子一样,通道有底物特异性。通道能协助有些离子的跨膜扩散,但不能协助另 一些离子的扩散(即使它们与底物离子非常接近)。 先前钠离子梯度是如何建立的?这就需要泵将钠离子从胞内逆浓度梯度泵出。由于离子 是从浓度低的地方输送到浓度高的地方,导致熵值降低,因此执行这一过程需要输入自由能。 膜上的蛋白质运输器利用能量将离子或分子沿浓度梯度的反方向运输。利用其他能源将物质 逆浓度梯度进行的跨膜运输称为主动运输(active transport)。 30 30 E20 显 10 吕10 E山 010102103104105106 100 200 300 Concentration ratio(c2/c) Membrane potential(mV) n 图13.1自由能和运输。(A)不带电的溶质从浓度为c1的区室向浓度为c2的区室运输产生 的自由能改变。(B)带电离子跨膜运输到有相同电荷的另一边产生的自由能改变。注意跨 膜电位差为59mV的自由能改变相当于25℃该离子的跨膜浓度比值大10倍。 浓度梯度储存的自由能可以定量 分子的不均匀分布含有能量(因为所有区域浓度均一的自由能最低)。因此要获得这种 浓度不均一分布(即浓度梯度)需要输入自由能。我们能否确定需要输入自由能才能产生这 种浓度梯度(图13.1)?考察一个不带电的溶质分子。这个分子从第1边(其浓度是c1) 运输到第2边(其浓度是c2)时自由能的变化是△G=RTln(c2cI)=2.303RTlg(c2/cl)
关键。葡萄糖运输器只是众多此类情况的第一批实例。 13.1 物质的跨膜运输可能主动,也可能被动 我们首先考察膜运输的一些通用原则。有两个因素决定一个分子是否跨膜运输:(1)该 物质跨过脂质双层膜的通透性,和(2)有无能源可供利用。 很多分子的运输需要跨膜的蛋白质运输器 如同第 12 章所述,由于分子自身能溶于脂质双层膜,这些分子能够跨膜运输。这类分 子称为亲脂分子(lipophilic molecules)。甾体激素就是一个例子。这些胆固醇类化合物能跨过 生物膜,但什么决定这些分子的运输方向呢?它们将沿着浓度梯度方向进行跨膜运输,即简 单扩散(simple diffusion)。与热力学第二定律一致,分子从浓度高的区域自动向浓度低的区 域移动。 如果分子是极性的,情况就复杂多了。如细胞外的钠离子浓度通常是 143 mM, 而细胞 内只有 14 mM,但是钠离子不能跨膜自由移动(因为带电离子不能跨过膜内部的疏水区域)。 在有些情况下,如神经信号传递过程中),钠离子必须进入细胞内。那么,细胞如何执行这 些作用?膜蛋白质在脂质双层膜构建出钠离子能够通过的特定通道共钠离子的跨膜运输。这 种运输方式叫协助扩散(facilitated diffusion), 其离子或分子的扩散运输受膜通道协助。这种 运输也是被动运输(因为运输系统没有提供能量,运输的能源来自被运物质自身的浓度梯 度)。同酶分子一样,通道有底物特异性。通道能协助有些离子的跨膜扩散,但不能协助另 一些离子的扩散(即使它们与底物离子非常接近)。 先前钠离子梯度是如何建立的?这就需要泵将钠离子从胞内逆浓度梯度泵出。由于离子 是从浓度低的地方输送到浓度高的地方,导致熵值降低,因此执行这一过程需要输入自由能。 膜上的蛋白质运输器利用能量将离子或分子沿浓度梯度的反方向运输。利用其他能源将物质 逆浓度梯度进行的跨膜运输称为主动运输(active transport)。 图 13.1 自由能和运输。(A)不带电的溶质从浓度为 c1 的区室向浓度为 c2 的区室运输产生 的自由能改变。(B)带电离子跨膜运输到有相同电荷的另一边产生的自由能改变。注意跨 膜电位差为 59 mV 的自由能改变相当于 25℃该离子的跨膜浓度比值大 10 倍。 浓度梯度储存的自由能可以定量 分子的不均匀分布含有能量(因为所有区域浓度均一的自由能最低)。因此要获得这种 浓度不均一分布(即浓度梯度)需要输入自由能。我们能否确定需要输入自由能才能产生这 种浓度梯度(图 13.1)?考察一个不带电的溶质分子。这个分子从第 1 边(其浓度是 c1) 运输到第 2 边(其浓度是 c2)时自由能的变化是 △G = RT ln (c2/c1) = 2.303 RT lg(c2/c1)

其中R是气体常数3.315x103kJ/mol,或1.987x103kcal/mol,T是绝对温度,单位是 kelvins。.对于带电离子跨膜不均匀分布还要考虑跨膜的电势差。浓度差和电势差的总和称为 膜电化学势能或膜势能。其自由能是 △G=RTln(c2cl)+ZF△V=2.303RTlg(c2/cl)+ZF△V 其中Z是被运离子的电荷,△V是跨膜电势差,F是法拉利常数(96.5kJN.mol,或23.1kcal V.mol)。 如果△G是正值,运输是主动的。如果△G是负值,运输时被动的。例如,不带电物质 从cl=103M运输到c2=10-M,△G=2.303RTlg(10-10)=+11.4 kJ/mol(若温度是 298k)。这个数值表明,这种运输需要能量,是主动运输。 13.2有两类膜蛋白利用ATP水解将离子或分子泵过膜 动物细胞的胞外液体的盐浓度与海水相似。但是细胞必须控制细胞内离子浓度,防止离 子达到有害的高浓度状态,有利于一些生化反应的进行。例如,与胞外溶液相比,大多数动 物细胞内含有高浓度的钾离子,但钠离子浓度较低。这些离子浓度梯度是特定的运输系统造 成的。这个运输系统是Na*-K+泵或Na*-K+ATPase。.这个泵对ATP的水解产生了Na*主 动运出细胞和K+主动运入细胞所需要的能量,产生离子梯度。只有N和K+都存在时, 这个泵才能水解ATP,所以称为Na-K+ATPase。与其它ATPase一样,该酶需要Mg+. Na和K+运输伴随着自由能的变化可以计算。假定胞外钠离子浓度是143mM,胞内是 14mM,而胞外钾离子浓度是4mM,胞内是157mM,跨膜电位是-50mV,温度是37℃, 那么运输3 mole Na+到胞外,运输2 mole K+到胞内需要3x5.99+2x9.46=+36.9kJ/mol。 ATP水解能提供50kJ/mol来驱动离子的主动运输。Na*和K+主动运输有重大的生理意义。 实际上没有运动的细胞内超过1/3的ATP用来驱动这些离子泵的运转。动物细胞的Na和 K浓度梯度控制细胞体积,使神经元和肌肉细胞能被电激活,驱动糖和氨基酸的主动运输。 随后纯化的其它离子泵表明离子泵蛋白质存在于从细菌、古生菌、到所有真核生物,是 一个蛋白大家族。这些离子泵能够主动运输特定离子。其中两个泵有特殊意义。Ca+ATPase 能够将Ca+运出细胞质,运入肌细胞内质网:胃H-K+ATPase将质子泵入胃,使之pH值 低于l.0。这些酶和众多已知的同源物,包括Na-K+ATPase,称为P-类ATPase,因为它们 能形成关键的磷酸化中间产物。在形成该中间产物的过程中,ATP提供的磷酸基团与ATPase 的一个保守的天冬氨酸残基的侧链形成共价连接。 Phosphorylaspartate
其中 R 是气体常数 3.315 x 10 -3 kJ/mol, 或 1.987 x 10 -3 kcal / mol, T 是绝对温度,单位是 kelvins。对于带电离子跨膜不均匀分布还要考虑跨膜的电势差。浓度差和电势差的总和称为 膜电化学势能或膜势能。其自由能是 △G = RT ln (c2/c1) + ZF △V = 2.303 RT lg(c2/c1) + ZF △V 其中 Z 是被运离子的电荷,△V 是跨膜电势差,F 是法拉利常数(96.5 kJ/V.mol, 或 23.1 kcal /V.mol)。 如果△G 是正值,运输是主动的。如果△G 是负值,运输时被动的。例如,不带电物质 从 c1 = 10 -3M 运输到 c2 = 10 -1M, △G = 2.303 RT lg (10 -1 /10 -3) = + 11.4 kJ/mol (若温度是 298k)。这个数值表明,这种运输需要能量,是主动运输。 13.2 有两类膜蛋白利用 ATP 水解将离子或分子泵过膜 动物细胞的胞外液体的盐浓度与海水相似。但是细胞必须控制细胞内离子浓度,防止离 子达到有害的高浓度状态,有利于一些生化反应的进行。例如,与胞外溶液相比,大多数动 物细胞内含有高浓度的钾离子,但钠离子浓度较低。这些离子浓度梯度是特定的运输系统造 成的。这个运输系统是 Na + - K+ 泵或 Na + - K+ ATPase。这个泵对 ATP 的水解产生了 Na + 主 动运出细胞和 K+主动运入细胞所需要的能量,产生离子梯度。只有 Na + 和 K+都存在时, 这个泵才能水解 ATP,所以称为 Na + - K+ ATPase。与其它 ATPase 一样,该酶需要 Mg 2+ . Na +和 K+运输伴随着自由能的变化可以计算。假定胞外钠离子浓度是 143 mM,胞内是 14 mM,而胞外钾离子浓度是 4 mM, 胞内是 157 mM, 跨膜电位是-50 mV,温度是 37℃, 那么运输 3 mole Na+到胞外,运输 2 mole K+到胞内需要 3 x 5.99 + 2 x 9.46 = + 36.9 kJ/mol。 ATP 水解能提供 50 kJ/mol 来驱动离子的主动运输。Na +和 K+主动运输有重大的生理意义。 实际上没有运动的细胞内超过 1/3 的 ATP 用来驱动这些离子泵的运转。动物细胞的 Na +和 K+浓度梯度控制细胞体积,使神经元和肌肉细胞能被电激活,驱动糖和氨基酸的主动运输。 随后纯化的其它离子泵表明离子泵蛋白质存在于从细菌、古生菌、到所有真核生物,是 一个蛋白大家族。这些离子泵能够主动运输特定离子。其中两个泵有特殊意义。Ca 2+ ATPase 能够将 Ca 2+运出细胞质,运入肌细胞内质网;胃 H+ -K+ ATPase 将质子泵入胃,使之 pH 值 低于 1.0。这些酶和众多已知的同源物,包括 Na + - K+ ATPase,称为 P-类 ATPase,因为它们 能形成关键的磷酸化中间产物。在形成该中间产物的过程中,ATP 提供的磷酸基团与 ATPase 的一个保守的天冬氨酸残基的侧链形成共价连接

P-类ATPase将磷酸化和泵构象转换偶联,实现钙离子的跨膜运输 膜泵作用原理简单,但是作用细节很复杂。基本上,每个膜泵蛋白质有两种功能状态, 即朝向生物膜一侧开放的离子结合状态和朝向生物膜另一侧开放的离子结合状态(图13.2)。 为了在单一方向跨膜运输离子,自由能的利用必须与泵蛋白构象转换偶联。 Energy input Conformation 1 Conformation 2 图132泵作用。用膜泵将一个分子跨膜运输的示意图。泵在两种构型之间相互转换,每种 构型都有一个离子结合位点,但是泵的开口分别处于生物膜的不同侧面。 我们以肌肉细胞内质网膜的Ca2+ATPase为例,来介绍P-类ATPase结构域特征。依靠5 种不同状态泵的晶体结构,已经确定了这类ATPase成员的详细特性。肌肉细胞内质网膜的 Ca2+ATPase站内质网膜蛋白量的80%在肌肉收缩方面起重要作用。细胞质Ca+浓度迅速提 升导致肌肉收缩。而细胞质C+迅速运入内质网导致细胞质Ca+浓度迅速降低使肌肉松弛。 度迅速提升导致肌肉收缩。肌细胞内质网是储存Ca+的特定场所。将细胞质Ca+运入肌细 胞内质网的是SERCA。这种泵使细胞质Ca+浓度维持在0.1M,而内质网的Ca+浓度处 于1.5mM水平。 阐明的第一例SERCA有Ca+结合,但没有核苷酸(图13.3)。SERCA只有一条多肽链, 大小是110kD,有一个含有10个螺旋的跨膜区。这个跨膜区有两个C+结合位点。每个 C+能够与7个氧原子形成配位键。这7个氧原子来自多肽链的谷氨酸、天冬氨酸、苏氨酸、 天冬酰胺侧链基团,多肽链骨架的羰基,和水分子。面向细胞质的头部大,相当于整个蛋白 质质量的一半,由三个不同的结构域构成。这三个结构域有不同的功能。一个结构域(称为 N)与ATP结合,另一个结构域(称为P)的保守天冬氨酸接受磷酸,第三个结构域(A)充 当调解器(actuator),将蛋白质N和P结构域的变化与这个蛋白的跨膜区域联系起来。 bb304 Asn 798 bb307 Glu 308 图13.3Ca2+泵结构。P.类ATPase成员SERCA的结构。注意两个钙离子(绿色)处于跨膜 结构域的中心。保守的天冬氨酸残基(As即351)与磷酸基团结合,位于P结构域。bb表示多 肽骨架链的羰基
P-类 ATPase 将磷酸化和泵构象转换偶联,实现钙离子的跨膜运输 膜泵作用原理简单,但是作用细节很复杂。基本上,每个膜泵蛋白质有两种功能状态, 即朝向生物膜一侧开放的离子结合状态和朝向生物膜另一侧开放的离子结合状态(图 13.2)。 为了在单一方向跨膜运输离子,自由能的利用必须与泵蛋白构象转换偶联。 图 13.2 泵作用。用膜泵将一个分子跨膜运输的示意图。泵在两种构型之间相互转换,每种 构型都有一个离子结合位点,但是泵的开口分别处于生物膜的不同侧面。 我们以肌肉细胞内质网膜的 Ca 2+ ATPase 为例,来介绍 P-类 ATPase 结构域特征。依靠 5 种不同状态泵的晶体结构,已经确定了这类 ATPase 成员的详细特性。肌肉细胞内质网膜的 Ca 2+ ATPase 站内质网膜蛋白量的 80%在肌肉收缩方面起重要作用。细胞质 Ca 2+浓度迅速提 升导致肌肉收缩。而细胞质 Ca 2+迅速运入内质网导致细胞质 Ca 2+浓度迅速降低使肌肉松弛。 度迅速提升导致肌肉收缩。肌细胞内质网是储存 Ca 2+的特定场所。将细胞质 Ca 2+运入肌细 胞内质网的是 SERCA。这种泵使细胞质 Ca 2+浓度维持在 0.1 M,而内质网的 Ca 2+浓度处 于 1.5 mM 水平。 阐明的第一例 SERCA 有 Ca 2+结合,但没有核苷酸(图 13.3)。SERCA 只有一条多肽链, 大小是 110 kD,有一个含有 10 个 螺旋的跨膜区。这个跨膜区有两个 Ca 2+结合位点。每个 Ca 2+能够与 7 个氧原子形成配位键。这 7 个氧原子来自多肽链的谷氨酸、天冬氨酸、苏氨酸、 天冬酰胺侧链基团,多肽链骨架的羰基,和水分子。面向细胞质的头部大,相当于整个蛋白 质质量的一半,由三个不同的结构域构成。这三个结构域有不同的功能。一个结构域(称为 N)与 ATP 结合,另一个结构域(称为 P)的保守天冬氨酸接受磷酸,第三个结构域(A)充 当调解器(actuator),将蛋白质 N 和 P 结构域的变化与这个蛋白的跨膜区域联系起来。 图 13.3 Ca 2+泵结构。P-类 ATPase 成员 SERCA 的结构。注意两个钙离子(绿色)处于跨膜 结构域的中心。保守的天冬氨酸残基(Asp351)与磷酸基团结合,位于 P 结构域。bb 表示多 肽骨架链的羰基
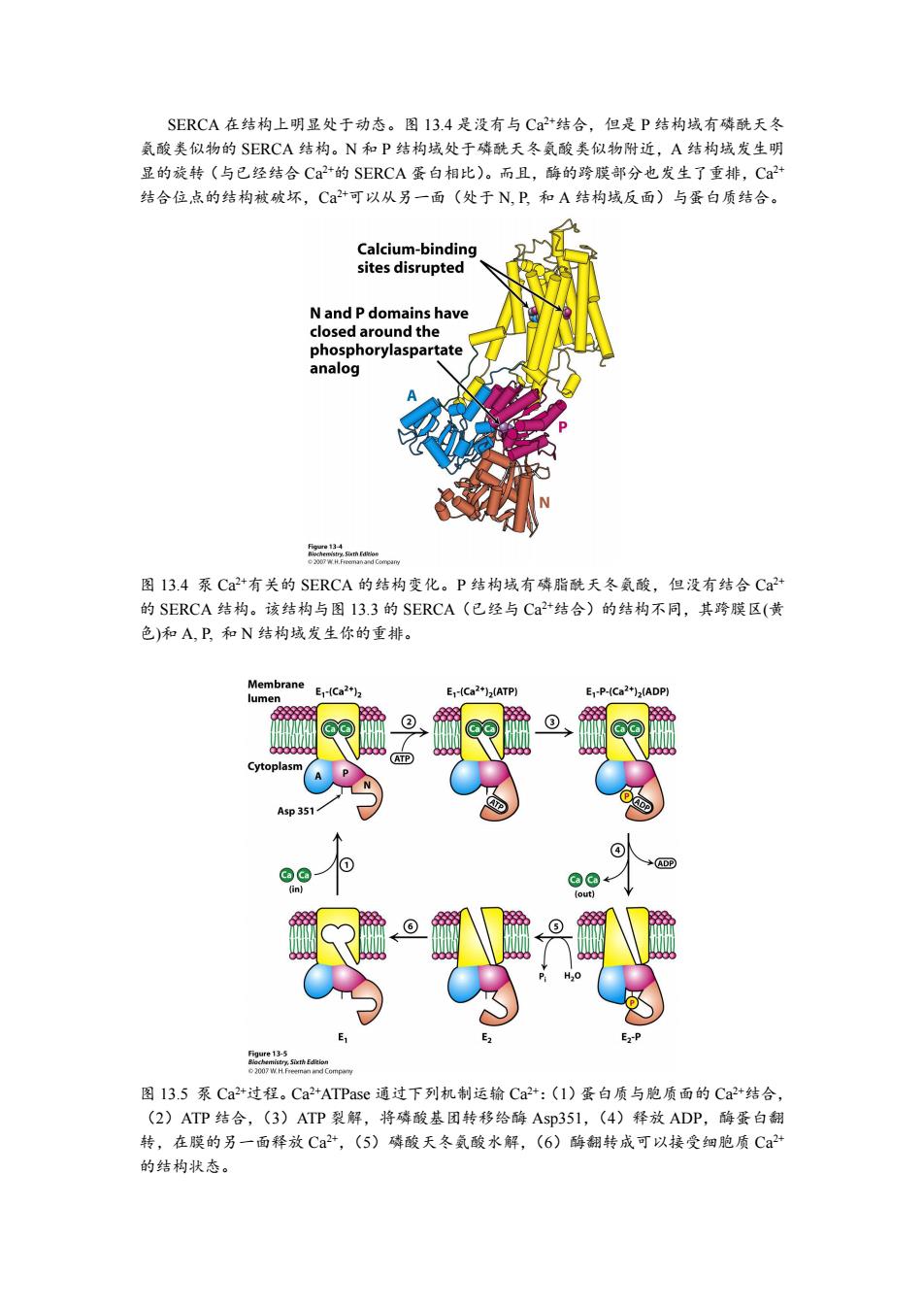
SERCA在结构上明显处于动态。图13.4是没有与C2+结合,但是P结构域有磷酰天冬 氨酸类似物的SERCA结构。N和P结构域处于磷酰天冬氨酸类似物附近,A结构域发生明 显的旋转(与已经结合Ca+的SERCA蛋白相比)。而且,酶的跨膜部分也发生了重排,Ca+ 结合位点的结构被破坏,C+可以从另一面(处于N,P,和A结构域反面)与蛋白质结合。 Calcium-binding sites disrupted N and P domains have closed around the phosphorylaspartate analog 2sfsgCapaw 图13.4泵Ca2+有关的SERCA的结构变化。P结构域有磷脂酰天冬氨酸,但没有结合Ca2+ 的SERCA结构。该结构与图13.3的SERCA(已经与Ca+结合)的结构不同,其跨膜区(黄 色)和A,P,和N结构域发生你的重排。 Membrane E1-Ca2+)2 lumen E-(Ca2+)(ATP) E-P-(Ca2+)2(ADP) ② ATP) Cytoplasm ⊙ 4sp35 ④ 1 ADP @©← (in) fout] E1 E2 E-P Figure 13-5 p 图13.5泵Ca2+过程。Ca2+ATPase通过下列机制运输Ca2+:(1)蛋白质与胞质面的Ca2+结合, (2)ATP结合,(3)ATP裂解,将磷酸基团转移给酶Asp351,(4)释放ADP,酶蛋白翻 转,在膜的另一面释放Ca2+,(5)磷酸天冬氨酸水解,(6)酶翻转成可以接受细胞质Ca2+ 的结构状态
SERCA 在结构上明显处于动态。图 13.4 是没有与 Ca 2+结合,但是 P 结构域有磷酰天冬 氨酸类似物的 SERCA 结构。N 和 P 结构域处于磷酰天冬氨酸类似物附近,A 结构域发生明 显的旋转(与已经结合 Ca 2+的 SERCA 蛋白相比)。而且,酶的跨膜部分也发生了重排,Ca 2+ 结合位点的结构被破坏,Ca 2+可以从另一面(处于 N, P, 和 A 结构域反面)与蛋白质结合。 图 13.4 泵 Ca 2+有关的 SERCA 的结构变化。P 结构域有磷脂酰天冬氨酸,但没有结合 Ca 2+ 的 SERCA 结构。该结构与图 13.3 的 SERCA(已经与 Ca 2+结合)的结构不同,其跨膜区(黄 色)和 A, P, 和 N 结构域发生你的重排。 图 13.5 泵 Ca 2+过程。Ca 2+ATPase 通过下列机制运输 Ca 2+:(1)蛋白质与胞质面的 Ca 2+结合, (2)ATP 结合,(3)ATP 裂解,将磷酸基团转移给酶 Asp351,(4)释放 ADP,酶蛋白翻 转,在膜的另一面释放 Ca 2+,(5)磷酸天冬氨酸水解,(6)酶翻转成可以接受细胞质 Ca 2+ 的结构状态

综合考虑这些结构数据和其它研究结果,人们构建出SERCA Ca+泵的详细机制(图 13.5)。 1.催化周期起始是酶结合了两个Ca+离子,但没有磷酸化。反应前没有结合Ca2+的酶 称为E1,结合了Ca+的结构称为El-(Ca2+)2。这种构型的SERCA酶能够交换Ca2+, 但是只局限于膜的细胞质这一面。 2.E1结构的酶蛋白与ATP结合。由于N,P,和A结构域处于结合ATP位,点附近, 这些结构域发生结构重排。但是酶蛋白的跨膜结构域没有结构变化。C+被俘获于 酶蛋白分子内。 3.磷酰基从ATP转移到Asp351 4.释放ADP,酶蛋白的结构(包括跨膜结构域)又发生变化。新的构型称为E2或E2-P (如果是磷酸化状态)。E1和E2之间的结构转换有时称为构型翻转(eversion)。E2-P 构型的酶蛋白,其Ca2+离子结合位点遭到破坏,Ca+离子被释放到膜的另一面,达 到了运输Ca2+离子的目的。其构型见图13.4。 5.磷酰天冬氨酸发生水解,释放无机磷酸。 6.随着无机磷酸的释放,E2构型中各种结构域之间的相互作用也不能维持,酶蛋白质 又发生翻转,恢复E1结构。 在细胞质面结合两个Ca2+离子,完成了SERCA运输Ca+离子的一个周期。这种运输机 制适用于其它P.类ATPase。例如,Na-K+ATPase是四聚体,其亚基与SERCA 同源,含有域ASp351类似的同源天冬氨酸。B亚基不直接参与离子运输。离子的运输机制 与图13.5描述的机制相似。E1构型结合胞内3个Na离子,E2构型结合细胞外2个K+。 洋地黄(digitalis)阻止Na+-Kt泵脱磷酸化,特异抑制Na+-K泵活性 植物来源的一些甾体化合物是很强的Na.K*泵抑制剂(Ki≈I0nM)。毛地黄毒苷 (digitoxigenin)和哇巴因(ouabain)属于这类抑制剂。这些化合物对心脏影响强烈,称为强 心类固醇(图13.6)。在膜的胞外面使用这些化合物,它们能抑制E2-P型的Na-K+泵脱 磷酸。 洋地黄是从植物的干叶子中获取的强心胆固醇类混合物。这种化合物能增强心肌的收缩 力,是治疗充血性心力衰竭(congestive heart failure)的选择药物。洋地黄抑制Na+-Kt泵 使细胞内Na浓度较高。Na+浓度梯度降低使Na-Ca+交换器外排Ca+速度降低。结果 细胞内C+浓度增加,促进心肌收缩。有趣的是,在人们发现洋地黄抑制Na-K+泵之前, 人们已经有很长时间都在有效地利用详地黄。I785年,英国医生William Withering听说一 位Shropshire的老妇人用植物千叶子抽提液治疗“积水”疾病(就是今天的充血性心力衰竭)。 Withering首次对植物千叶子抽提液治疗充血性心力衰竭进行科学研究,证实其治疗效果。 毛地黄是获取洋地黄的原料。洋地黄是使用最广泛的药物之一
综合考虑这些结构数据和其它研究结果,人们构建出 SERCA Ca 2+泵的详细机制(图 13.5)。 1. 催化周期起始是酶结合了两个 Ca 2+离子,但没有磷酸化。反应前没有结合 Ca 2+的酶 称为 E1,结合了 Ca 2+的结构称为 E1-(Ca 2+ )2。这种构型的 SERCA 酶能够交换 Ca 2+, 但是只局限于膜的细胞质这一面。 2. E1 结构的酶蛋白与 ATP 结合。由于 N,P,和 A 结构域处于结合 ATP 位点附近, 这些结构域发生结构重排。但是酶蛋白的跨膜结构域没有结构变化。Ca 2+被俘获于 酶蛋白分子内。 3. 磷酰基从 ATP 转移到 Asp351. 4. 释放 ADP,酶蛋白的结构(包括跨膜结构域)又发生变化。新的构型称为 E2或 E2-P (如果是磷酸化状态)。E1和 E2之间的结构转换有时称为构型翻转(eversion)。E2-P 构型的酶蛋白,其 Ca 2+离子结合位点遭到破坏,Ca 2+离子被释放到膜的另一面,达 到了运输 Ca 2+离子的目的。其构型见图 13.4。 5. 磷酰天冬氨酸发生水解,释放无机磷酸。 6. 随着无机磷酸的释放,E2构型中各种结构域之间的相互作用也不能维持,酶蛋白质 又发生翻转,恢复 E1结构。 在细胞质面结合两个 Ca 2+离子,完成了 SERCA 运输 Ca 2+离子的一个周期。这种运输机 制适用于其它 P-类 ATPase。例如,Na + - K+ ATPase 是 四聚体,其 亚基与 SERCA 同源,含有域 Asp351 类似的同源天冬氨酸。B 亚基不直接参与离子运输。离子的运输机制 与图 13.5 描述的机制相似。E1 构型结合胞内 3 个 Na +离子,E2 构型结合细胞外 2 个 K+。 洋地黄(digitalis)阻止 Na + - K+ 泵脱磷酸化,特异抑制 Na + - K+ 泵活性 植物来源的一些甾体化合物是很强的 Na + - K+ 泵抑制剂(Ki ≈ 10 nM)。毛地黄毒苷 (digitoxigenin)和哇巴因(ouabain)属于这类抑制剂。这些化合物对心脏影响强烈,称为强 心类固醇(图 13.6)。在膜的胞外面使用这些化合物,它们能抑制 E2-P 型的 Na + - K+ 泵脱 磷酸。 洋地黄是从植物的干叶子中获取的强心胆固醇类混合物。这种化合物能增强心肌的收缩 力,是治疗充血性心力衰竭(congestive heart failure)的选择药物。洋地黄抑制 Na + - K+ 泵 使细胞内 Na + 浓度较高。Na +浓度梯度降低使 Na + - Ca 2+ 交换器外排 Ca 2+ 速度降低。结果 细胞内 Ca 2+ 浓度增加,促进心肌收缩。有趣的是,在人们发现洋地黄抑制 Na + - K+泵之前, 人们已经有很长时间都在有效地利用洋地黄。1785 年,英国医生 William Withering 听说一 位 Shropshire 的老妇人用植物干叶子抽提液治疗“积水”疾病(就是今天的充血性心力衰竭)。 Withering 首次对植物干叶子抽提液治疗充血性心力衰竭进行科学研究,证实其治疗效果。 毛地黄是获取洋地黄的原料。洋地黄是使用最广泛的药物之一

E2-P+H20E2+P1 HO Inhibited by Digitoxigenin cardiotonic steroids n 图13.6毛地黄毒苷。强心类固醇如毛地黄毒苷阻止E2-P脱磷酸,从而抑制Na-K+泵。 P-类ATP进化保守、能执行很多功能 酵母全基因组序列指出有16个蛋白质属于P.类ATPase家族。更详细的序列分析提示, 其中两个蛋白质运输H中,两个蛋白质运输Ca2+,三个蛋白质运输Na*,两个运输金属离子 (如Cu+)。还有5个蛋白质参与头部带有氨基的磷脂运输。这种运输能够将磷脂酰丝氨 酸类磷脂从生物膜的内半面运输到外版面,维持生物膜的不对称性。这5种蛋白质称为翻转 酶(flippase)。令人印象更深刻的是,人基因组编码70种P-类ATPase。.该蛋白家族的所有 成员所采用的机制基本相同。ATP水解提供的能量导致膜蛋白构型转化、驱动生物膜运输。 这种构型转化是由于各种蛋白质特定的天冬氨酸发生磷酸化和去磷酸化诱导产生的。 多重药物抗性显示具有ATP结合域的膜泵家族蛋白的重要性 对人类疾病的研究揭示另一个重要的运输蛋白家族,其蛋白质结构和运输机理与 P-ATPase家族明显不同。培养的肿瘤细胞能够耐受那些起初对细胞毒性很大的药物。这种 细胞有耐药性后,对其他药物也有一定程度的抗性。这种现象叫多重药物抗性。后来发现分 子质量为170kD的膜蛋白质表达及其活性水平与多重药物耐受性密切相关。这种蛋白质是 依赖于ATP的分子泵,能够从细胞内泵出各种大小的小分子。这个膜蛋白称为多重药物抗 性蛋白(MDR)或P糖蛋白。因此,将这种细胞暴露于药物环境中,细胞膜上的MDR泵 能够将细胞内还没有发挥作用的药物泵出细胞。 MDR及其同源蛋白的氨基酸序列分析显示这些蛋白有共同的结构特征(图13.7)。每个 蛋白质有四个结构域:两个结构域跨膜,两个ATP结合cassettes(ABC)与细菌和古生菌 运输蛋白相应的结构城相似。含有这些结构域的运输蛋白称为ABC运输子。从大肠杆菌基 因组鉴定出ABC运输子有79个成员,属于最大的单一家族。人类基因组含有150多种ABC 运输子基因。 Membr ATP. ding domain cassette N ■C Multidrug-resistance protein (MDR) 图I3.7ABC运输子。多重药物抗性蛋白(MRD)是含有两个跨膜域和两个ATP结合域(即 ATP结合盒蛋白ABCs)大家族的代表
图 13.6 毛地黄毒苷。强心类固醇如毛地黄毒苷阻止 E2-P 脱磷酸,从而抑制 Na + - K+ 泵。 P-类 ATP 进化保守、能执行很多功能 酵母全基因组序列指出有 16 个蛋白质属于 P-类 ATPase 家族。更详细的序列分析提示, 其中两个蛋白质运输 H+,两个蛋白质运输 Ca 2+,三个蛋白质运输 Na +,两个运输金属离子 (如 Cu 2+ )。还有 5 个蛋白质参与头部带有氨基的磷脂运输。这种运输能够将磷脂酰丝氨 酸类磷脂从生物膜的内半面运输到外版面,维持生物膜的不对称性。这 5 种蛋白质称为翻转 酶(flippase)。令人印象更深刻的是,人基因组编码 70 种 P-类 ATPase。该蛋白家族的所有 成员所采用的机制基本相同。ATP 水解提供的能量导致膜蛋白构型转化、驱动生物膜运输。 这种构型转化是由于各种蛋白质特定的天冬氨酸发生磷酸化和去磷酸化诱导产生的。 多重药物抗性显示具有 ATP 结合域的膜泵家族蛋白的重要性 对人类疾病的研究揭示另一个重要的运输蛋白家族,其蛋白质结构和运输机理与 P-ATPase 家族明显不同。培养的肿瘤细胞能够耐受那些起初对细胞毒性很大的药物。这种 细胞有耐药性后,对其他药物也有一定程度的抗性。这种现象叫多重药物抗性。后来发现分 子质量为 170 kD 的膜蛋白质表达及其活性水平与多重药物耐受性密切相关。这种蛋白质是 依赖于 ATP 的分子泵,能够从细胞内泵出各种大小的小分子。这个膜蛋白称为多重药物抗 性蛋白(MDR)或 P-糖蛋白。因此,将这种细胞暴露于药物环境中,细胞膜上的 MDR 泵 能够将细胞内还没有发挥作用的药物泵出细胞。 MDR 及其同源蛋白的氨基酸序列分析显示这些蛋白有共同的结构特征(图 13.7)。每个 蛋白质有四个结构域:两个结构域跨膜,两个 ATP-结合 cassettes(ABC)与细菌和古生菌 运输蛋白相应的结构域相似。含有这些结构域的运输蛋白称为 ABC 运输子。从大肠杆菌基 因组鉴定出 ABC 运输子有 79 个成员,属于最大的单一家族。人类基因组含有 150 多种 ABC 运输子基因。 图 13.7 ABC 运输子。多重药物抗性蛋白(MRD)是含有两个跨膜域和两个 ATP 结合域(即 ATP 结合盒蛋白 ABCs)大家族的代表
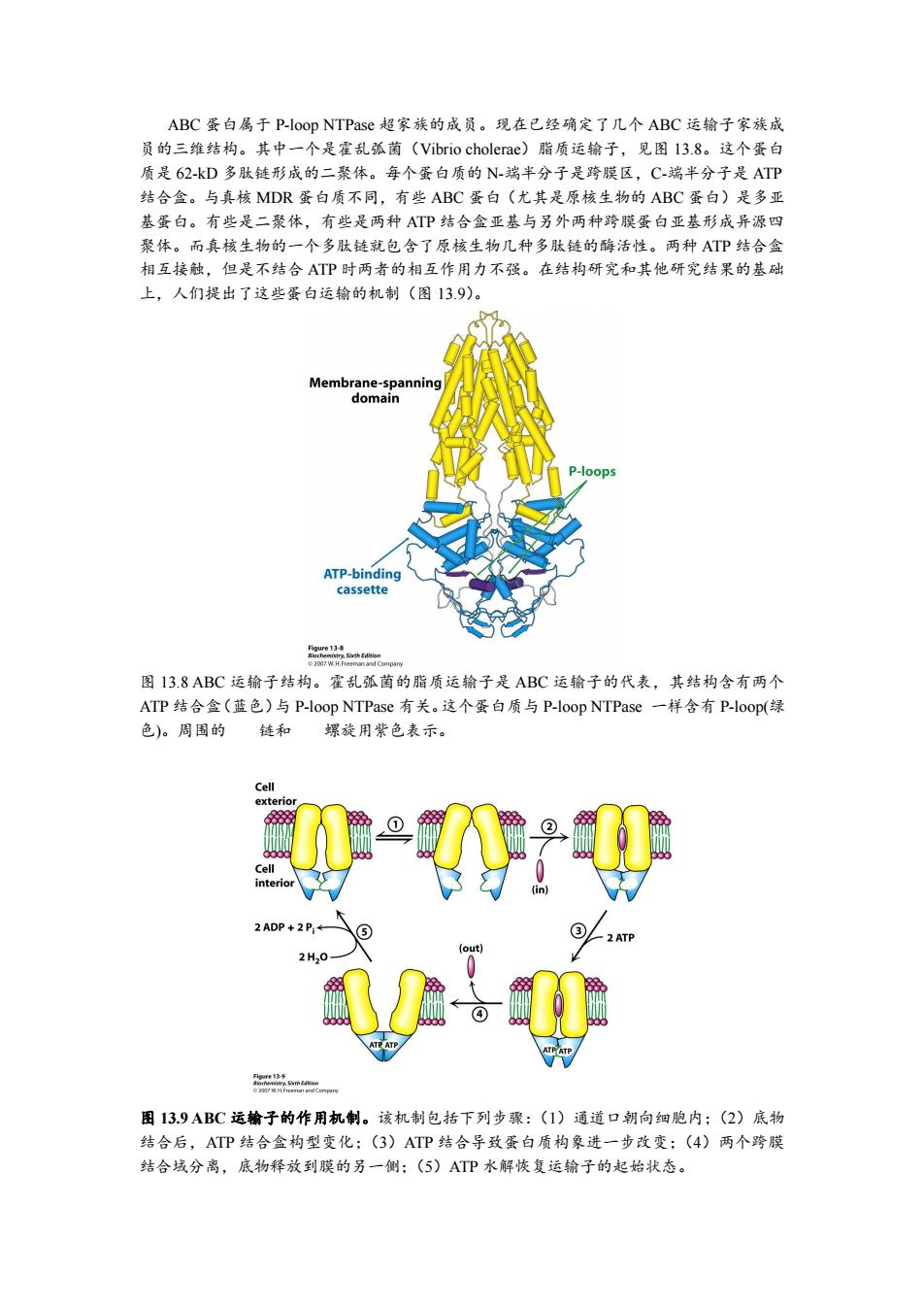
ABC蛋白属于P-loop NTPase超家族的成员。现在已经确定了几个ABC运输子家族成 员的三维结构。其中一个是霍乱孤菌(Vibrio cholerae)脂质运输子,见图l3.8。这个蛋白 质是62-kD多肽链形成的二聚体。每个蛋白质的N-端半分子是跨膜区,C端半分子是ATP 结合盒。与真核MDR蛋白质不同,有些ABC蛋白(尤其是原核生物的ABC蛋白)是多亚 基蛋白。有些是二聚体,有些是两种ATP结合盒亚基与另外两种跨膜蛋白亚基形成异源四 聚体。而真核生物的一个多肽链就包含了原核生物几种多肽链的酶活性。两种ATP结合盒 相互接触,但是不结合ATP时两者的相互作用力不强。在结构研究和其他研究结果的基础 上,人们提出了这些蛋白运输的机制(图13.9)。 Membrane-spanning domain P-loops ATP-binding cassette 图13.8ABC运输子结构。霍乱孤菌的脂质运输子是ABC运输子的代表,其结构含有两个 ATP结合盒(蓝色)与P-loop NTPase有关。这个蛋白质与P-loop NTPase一样含有P-loop(绿 色)。周围的链和 螺旋用紫色表示。 Cell exterior ② Cell interior (in) 2ADP+2P,← (⑤ ③ -2 ATP (out) 2H20 图13.9ABC运输子的作用机制。该机制包括下列步骤:(1)通道口朝向细胞内:(2)底物 结合后,ATP结合盒构型变化:(3)ATP结合导致蛋白质构象进一步改变;(4)两个跨膜 结合域分离,底物释放到膜的另一侧:(5)ATP水解恢复运输子的起始状态
ABC 蛋白属于 P-loop NTPase 超家族的成员。现在已经确定了几个 ABC 运输子家族成 员的三维结构。其中一个是霍乱弧菌(Vibrio cholerae)脂质运输子,见图 13.8。这个蛋白 质是 62-kD 多肽链形成的二聚体。每个蛋白质的 N-端半分子是跨膜区,C-端半分子是 ATP 结合盒。与真核 MDR 蛋白质不同,有些 ABC 蛋白(尤其是原核生物的 ABC 蛋白)是多亚 基蛋白。有些是二聚体,有些是两种 ATP 结合盒亚基与另外两种跨膜蛋白亚基形成异源四 聚体。而真核生物的一个多肽链就包含了原核生物几种多肽链的酶活性。两种 ATP 结合盒 相互接触,但是不结合 ATP 时两者的相互作用力不强。在结构研究和其他研究结果的基础 上,人们提出了这些蛋白运输的机制(图 13.9)。 图 13.8 ABC 运输子结构。霍乱弧菌的脂质运输子是 ABC 运输子的代表,其结构含有两个 ATP 结合盒(蓝色)与 P-loop NTPase 有关。这个蛋白质与 P-loop NTPase 一样含有 P-loop(绿 色)。周围的 链和 螺旋用紫色表示。 图 13.9 ABC 运输子的作用机制。该机制包括下列步骤:(1)通道口朝向细胞内;(2)底物 结合后,ATP 结合盒构型变化;(3)ATP 结合导致蛋白质构象进一步改变;(4)两个跨膜 结合域分离,底物释放到膜的另一侧;(5)ATP 水解恢复运输子的起始状态
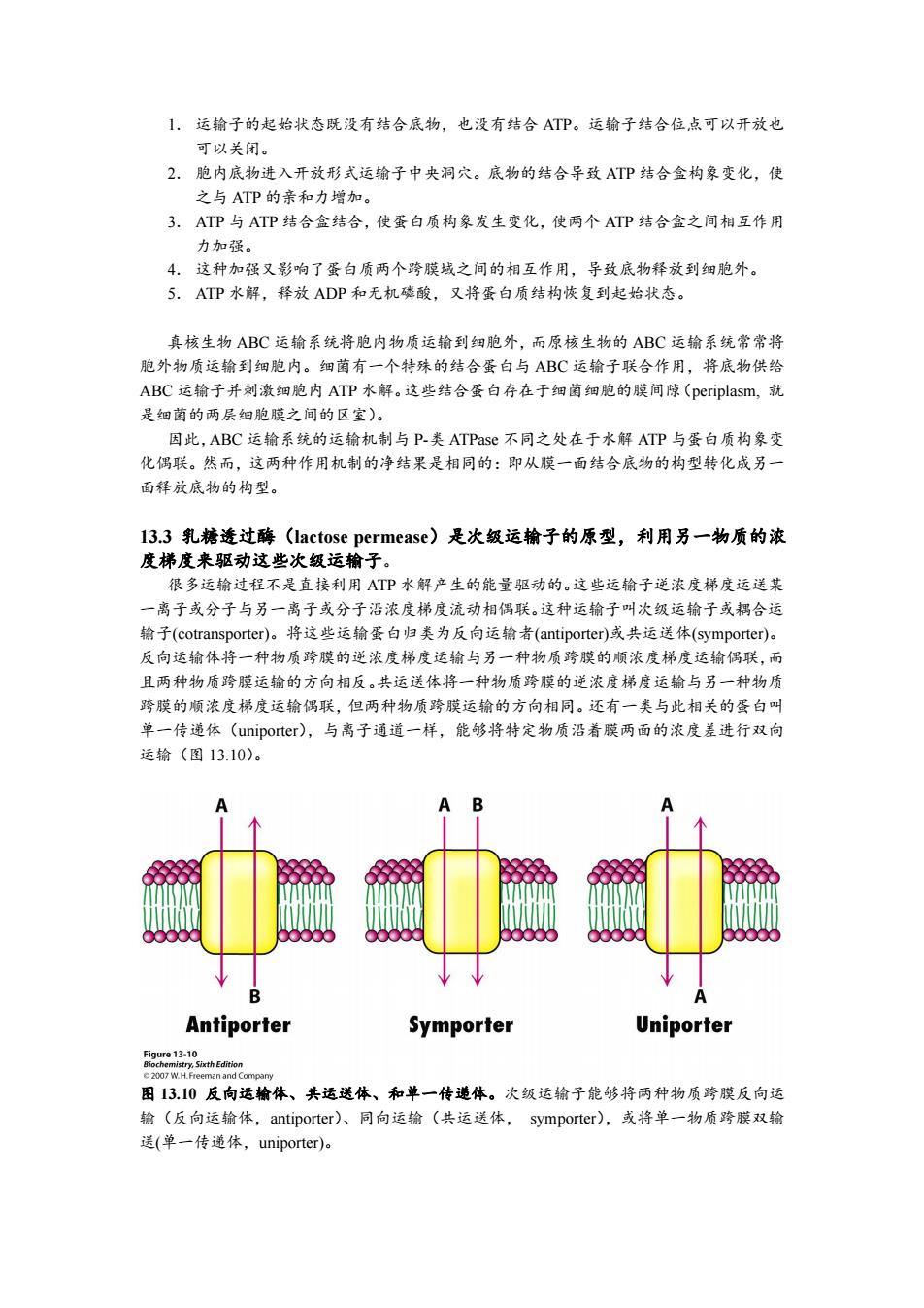
1.运输子的起始状态既没有结合底物,也没有结合ATP。运输子结合位点可以开放也 可以关闭。 2.胞内底物进入开放形式运输子中央洞穴。底物的结合导致ATP结合盒构象变化,使 之与ATP的亲和力增加。 3.ATP与ATP结合盒结合,使蛋白质构象发生变化,使两个ATP结合盒之间相互作用 力加强。 4.这种加强又影响了蛋白质两个跨膜域之间的相互作用,导致底物释放到细胞外。 5.ATP水解,释放ADP和无机磷酸,又将蛋白质结构恢复到起始状态。 真核生物ABC运输系统将胞内物质运输到细胞外,而原核生物的ABC运输系统常常将 胞外物质运输到细胞内。细菌有一个特殊的结合蛋白与ABC运输子联合作用,将底物供给 ABC运输子并刺激细胞内ATP水解。这些结合蛋白存在于细菌细胞的膜间隙(periplasm,就 是细菌的两层细胞膜之间的区室)。 因此,ABC运输系统的运输机制与P-类ATPase不同之处在于水解ATP与蛋白质构象变 化偶联。然而,这两种作用机制的净结果是相同的:即从膜一面结合底物的构型转化成另一 面释放底物的构型。 l3.3乳糖透过酶(lactose permease)是次级运输子的原型,利用另一物质的浓 度梯度来驱动这些次级运输子。 很多运输过程不是直接利用ATP水解产生的能量驱动的。这些运输子逆浓度梯度运送某 一离子或分子与另一离子或分子沿浓度梯度流动相偶联。这种运输子叫次级运输子或耦合运 输子(cotransporter)。将这些运输蛋白归类为反向运输者(antiporter)或共运送体(symporter)。 反向运输体将一种物质跨膜的逆浓度梯度运输与另一种物质跨膜的顺浓度梯度运输偶联,而 且两种物质跨膜运输的方向相反。共运送体将一种物质跨膜的逆浓度梯度运输与另一种物质 跨膜的顺浓度梯度运输偶联,但两种物质跨膜运输的方向相同。还有一类与此相关的蛋白叫 单一传递体(uniporter).,与离子通道一样,能够将特定物质沿着膜两面的浓度差进行双向 运输(图13.10)。 A B B 4 Antiporter Symporter Uniporter eei30ahEn 2007 W.H.Freeman and Company 图13.10反向运输体、共运送体、和单一传递体。次级运输子能够将两种物质跨膜反向运 输(反向运输体,antiporter)、同向运输(共运送体,symporter),或将单一物质跨膜双输 送(单一传递体,uniporter)
1. 运输子的起始状态既没有结合底物,也没有结合 ATP。运输子结合位点可以开放也 可以关闭。 2. 胞内底物进入开放形式运输子中央洞穴。底物的结合导致 ATP 结合盒构象变化,使 之与 ATP 的亲和力增加。 3. ATP 与 ATP 结合盒结合,使蛋白质构象发生变化,使两个 ATP 结合盒之间相互作用 力加强。 4. 这种加强又影响了蛋白质两个跨膜域之间的相互作用,导致底物释放到细胞外。 5. ATP 水解,释放 ADP 和无机磷酸,又将蛋白质结构恢复到起始状态。 真核生物 ABC 运输系统将胞内物质运输到细胞外,而原核生物的 ABC 运输系统常常将 胞外物质运输到细胞内。细菌有一个特殊的结合蛋白与 ABC 运输子联合作用,将底物供给 ABC 运输子并刺激细胞内 ATP 水解。这些结合蛋白存在于细菌细胞的膜间隙(periplasm, 就 是细菌的两层细胞膜之间的区室)。 因此,ABC 运输系统的运输机制与 P-类 ATPase 不同之处在于水解 ATP 与蛋白质构象变 化偶联。然而,这两种作用机制的净结果是相同的:即从膜一面结合底物的构型转化成另一 面释放底物的构型。 13.3 乳糖透过酶(lactose permease)是次级运输子的原型,利用另一物质的浓 度梯度来驱动这些次级运输子。 很多运输过程不是直接利用 ATP 水解产生的能量驱动的。这些运输子逆浓度梯度运送某 一离子或分子与另一离子或分子沿浓度梯度流动相偶联。这种运输子叫次级运输子或耦合运 输子(cotransporter)。将这些运输蛋白归类为反向运输者(antiporter)或共运送体(symporter)。 反向运输体将一种物质跨膜的逆浓度梯度运输与另一种物质跨膜的顺浓度梯度运输偶联,而 且两种物质跨膜运输的方向相反。共运送体将一种物质跨膜的逆浓度梯度运输与另一种物质 跨膜的顺浓度梯度运输偶联,但两种物质跨膜运输的方向相同。还有一类与此相关的蛋白叫 单一传递体(uniporter),与离子通道一样,能够将特定物质沿着膜两面的浓度差进行双向 运输(图 13.10)。 图 13.10 反向运输体、共运送体、和单一传递体。次级运输子能够将两种物质跨膜反向运 输(反向运输体,antiporter)、同向运输(共运送体, symporter),或将单一物质跨膜双输 送(单一传递体,uniporter)

次级运输子是一种古老的分子机器,普遍存在于今天的细菌、古生菌和真核生物。例如 大肠杆菌基因组编码160个左右的次级运输子蛋白质。序列比对和亲水作图分析提示这个最 大家族的成员有12个跨膜螺旋,来自一种具有六个跨膜螺旋蛋白的基因重复和融合。大肠 杆菌乳酸透过酶属于这一家族的成员。这个运输子利用H浓度梯度驱动细菌摄取乳糖和其 它糖类物质。细胞氧化燃料分子产生的能量驱动细胞将胞内H运输到细胞外,因此胞外H 浓度高。糖分子自胞外向胞内运输时,乳酸透过酶也将胞外H运入胞内(属于同向运输)。 H+自胞外向胞内顺浓度梯度跨膜运输,能够释放自由能。后者能够驱动糖逆浓度梯度跨膜 运输。这个运输蛋白被研究了几十年,可以拿来作为这类蛋白的原型。 (A) (B) c1aan 2007 W.H.Freeman and Company 图13.11与乳糖类似物结合的乳糖透过酶结构。蛋白质的N-端半分子(蓝色)和C-端半分 子(红色)的侧视图(A)和分子底部视图(从胞内朝外看)。这个蛋白结构的两个半分子 之间有一段多肽链连接,糖分子底物周围是蛋白质的两个半分子。 乳糖透过酶的空间结构已经确定(图13.11)。如同序列分析所预测的,这个蛋白质分为 两个半分子,每个半分子有六个跨膜-螺旋。有些螺旋不够规则。两个半分子之间用一段 多肽链连接。在这个蛋白的结构中,糖分子处于蛋白中心的口袋内。这个口袋有一个通道到 达细胞内。基于这些结构研究和大量的其它实验,人们提出了共运送体的作用机制(图 13.12)。这种运输机制与P-类ATPase和ABC运输子的运输机制很相似。 1.开始状态是两个半分子构成的底物结合口袋开口朝向细胞外,其构型与至今解析出来的 底物结合状态不同。细胞外质子与透过酶的一个残基(很可能是Gu269)结合。 2.在质子化状态,透过酶能够结合细胞外的乳糖。 3.结构发生反转,成为我们所观测到的蛋白晶体结构(图13.11)。 4.透过酶将乳糖释放到细胞内。 5.透过酶将质子释放到细胞内。 6.透过酶反转恢复起始状态的构型。 在这个运输过程中,质子化位,点可能发生了变化。这种翻转机制可能适用于所有的次级 运输蛋白,这些蛋白的结构与乳糖透过酶相似
次级运输子是一种古老的分子机器,普遍存在于今天的细菌、古生菌和真核生物。例如 大肠杆菌基因组编码 160 个左右的次级运输子蛋白质。序列比对和亲水作图分析提示这个最 大家族的成员有 12 个跨膜螺旋,来自一种具有六个跨膜螺旋蛋白的基因重复和融合。大肠 杆菌乳酸透过酶属于这一家族的成员。这个运输子利用 H+浓度梯度驱动细菌摄取乳糖和其 它糖类物质。细胞氧化燃料分子产生的能量驱动细胞将胞内 H+运输到细胞外,因此胞外 H+ 浓度高。糖分子自胞外向胞内运输时,乳酸透过酶也将胞外 H+运入胞内(属于同向运输)。 H+自胞外向胞内顺浓度梯度跨膜运输,能够释放自由能。后者能够驱动糖逆浓度梯度跨膜 运输。这个运输蛋白被研究了几十年,可以拿来作为这类蛋白的原型。 图 13.11 与乳糖类似物结合的乳糖透过酶结构。蛋白质的 N-端半分子(蓝色)和 C-端半分 子(红色)的侧视图(A)和分子底部视图(从胞内朝外看)。这个蛋白结构的两个半分子 之间有一段多肽链连接,糖分子底物周围是蛋白质的两个半分子。 乳糖透过酶的空间结构已经确定(图 13.11)。如同序列分析所预测的,这个蛋白质分为 两个半分子,每个半分子有六个跨膜螺旋。有些螺旋不够规则。两个半分子之间用一段 多肽链连接。在这个蛋白的结构中,糖分子处于蛋白中心的口袋内。这个口袋有一个通道到 达细胞内。基于这些结构研究和大量的其它实验,人们提出了共运送体的作用机制(图 13.12)。这种运输机制与 P-类 ATPase 和 ABC 运输子的运输机制很相似。 1. 开始状态是两个半分子构成的底物结合口袋开口朝向细胞外,其构型与至今解析出来的 底物结合状态不同。细胞外质子与透过酶的一个残基(很可能是 Glu 269)结合。 2. 在质子化状态,透过酶能够结合细胞外的乳糖。 3. 结构发生反转,成为我们所观测到的蛋白晶体结构(图 13.11)。 4. 透过酶将乳糖释放到细胞内。 5. 透过酶将质子释放到细胞内。 6. 透过酶反转恢复起始状态的构型。 在这个运输过程中,质子化位点可能发生了变化。这种翻转机制可能适用于所有的次级 运输蛋白,这些蛋白的结构与乳糖透过酶相似