正在加载图片...
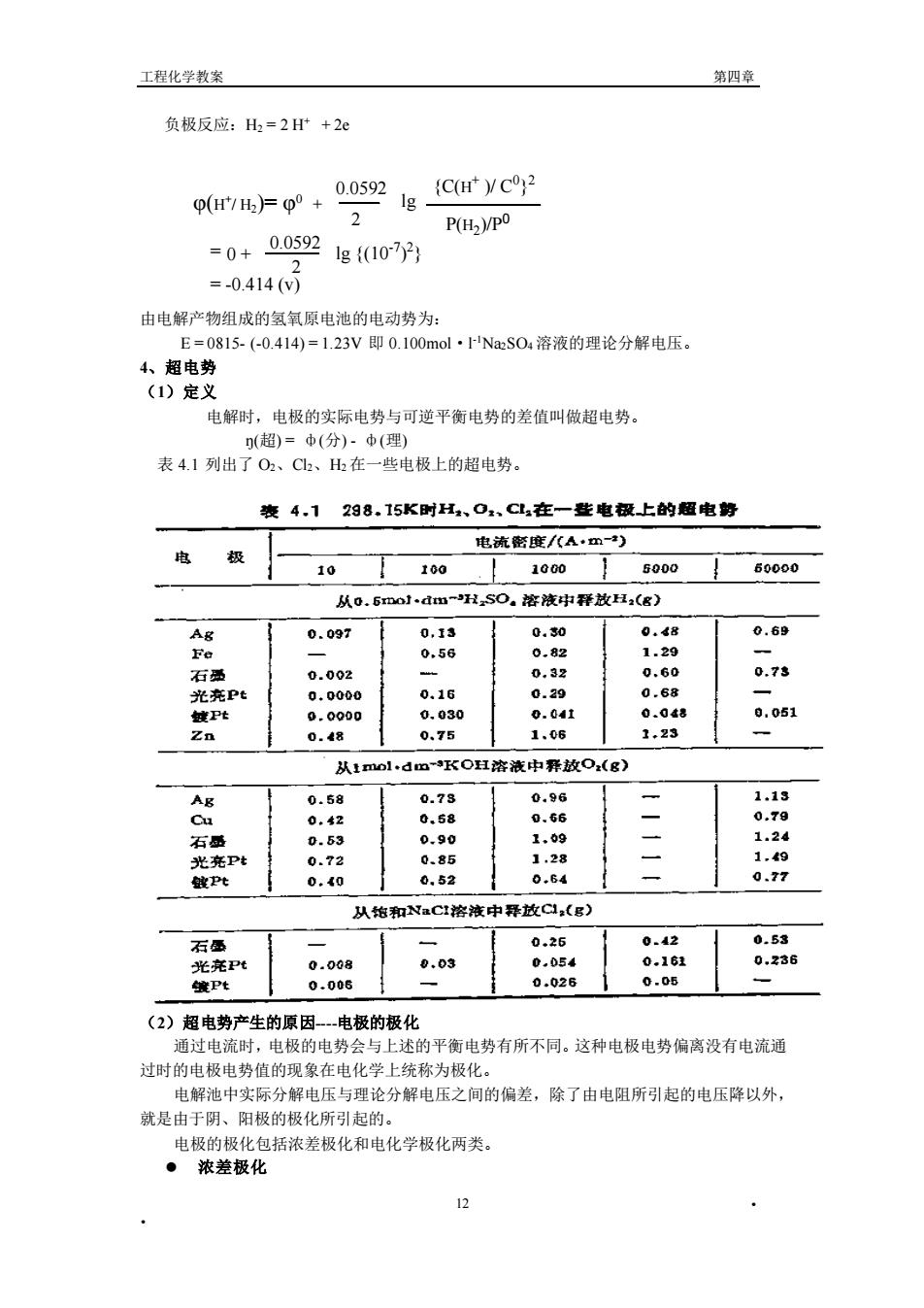
工程化学教案 第四章 负极反应:H2=2+2e p(1H2)=00+ 5 lgC(C2 P2)/p0 =0+00s92gf{007y3 =-0.414( 由电解产物组成的氢氧原电池的电动势为: E=0815-(-0.414)=1.23V即0.100mol·NaS0溶液的理论分解电压。 4、超电势 (1)定义 电解时,电极的实际电势与可逆平衡电势的差值叫做超电势 (超)=中(分)中(理 表4.1列出了O2、C2、在一些电极上的超电势。 表4.1298.15K时H,O,、C1,在一生电极上的超电野 _电流密度/八A·m) 电 极 10 100 1000】 5000↓60000 从0.6mo1dm-HSO。溶液中释故,(g) AR 0.097 0,13 0.30 0,4 0.69 Fe 0.58 0.8 石 0.002 0.7 0.16 0.68 0.030 0.0at 0.0d8 0.051 0.75 1,06 1.23 从1o1 dm-KOH溶液中释放O.(g) AE 0.58 0.73 1.24 石 P 1.49 0.52 0.64 0.77 从指和NaCt溶液中释放CQ:(g) 石西 0.26 042 光充Pt 0.008 0.03 壤Pt 0.006 (2)超电势产生的原因-电极的极化 通过电流时,电极的电势会与上述的平衡电势有所不同。这种电极电势偏离没有电流通 过时的电极电势值的现象在电化学上统称为极化。 电解池中实际分解电压与理论分解电压之间的偏差,除了由电阻所引起的电压降以外 就是由于阴、阳极的极化所引起的。 电极的极化包括浓差极化和电化学极化两类。 ·浓差极化 。 工程化学教案 第四章 • • 12 负极反应:H2 = 2 H+ + 2e φ(H + / H2)= φ 0 + 2 0.0592 lg = -0.414 (v) 0.0592 2 lg {(10 -7 ) 2 = 0 + } P(H2 )/P 0 {C(H + )/ C 0} 2 由电解产物组成的氢氧原电池的电动势为: E = 0815- (-0.414) = 1.23V 即 0.100mol·l -1Na2SO4 溶液的理论分解电压。 4、超电势 (1)定义 电解时,电极的实际电势与可逆平衡电势的差值叫做超电势。 ŋ(超) = ф(分) - ф(理) 表 4.1 列出了 O2、Cl2、H2 在一些电极上的超电势。 (2)超电势产生的原因----电极的极化 通过电流时,电极的电势会与上述的平衡电势有所不同。这种电极电势偏离没有电流通 过时的电极电势值的现象在电化学上统称为极化。 电解池中实际分解电压与理论分解电压之间的偏差,除了由电阻所引起的电压降以外, 就是由于阴、阳极的极化所引起的。 电极的极化包括浓差极化和电化学极化两类。 ⚫ 浓差极化