正在加载图片...
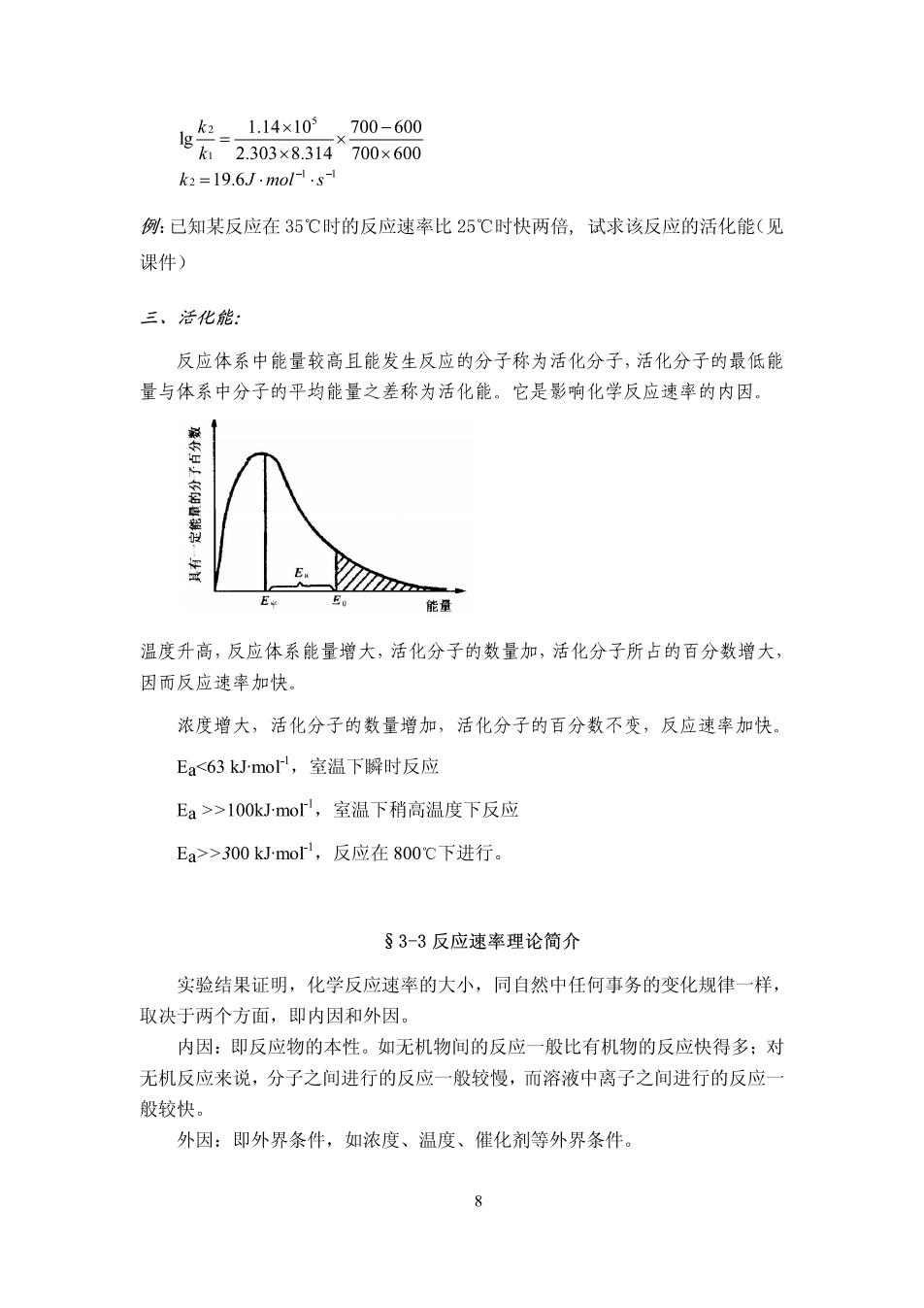
尝n k2=19.6J.mol-.s- 例:已知某反应在35℃时的反应速率比25℃时快两倍,试求该反应的活化能(见 课件) 三、活化能 反应体系中能量较高且能发生反应的分子称为活化分子,活化分子的最低能 量与体系中分子的平均能量之差称为活化能。它是影响化学反应速率的内因 E 能量 温度升高,反应体系能量增大,活化分子的数量加,活化分子所占的百分数增大, 因而反应速率加快 浓度增大,活化分子的数量增加,活化分子的百分数不变,反应速率加快 Ea<63kJmo,室温下瞬时反应 Ea>>100 kJ-mol,室温下稍高温度下反应 Ea>>300 kJ-mol,反应在800℃下进行。 §3-3反应速率理论简介 实验结果证明,化学反应速率的大小,同自然中任何事务的变化规律一样, 取决于两个方面,即内因和外因。 内因:即反应物的本性。如无机物间的反应一般比有机物的反应快得多:对 无机反应来说,分子之间进行的反应一般较慢,而溶液中离子之间进行的反应 般较快。 外因:即外界条件,如浓度、温度、催化剂等外界条件。 8