正在加载图片...
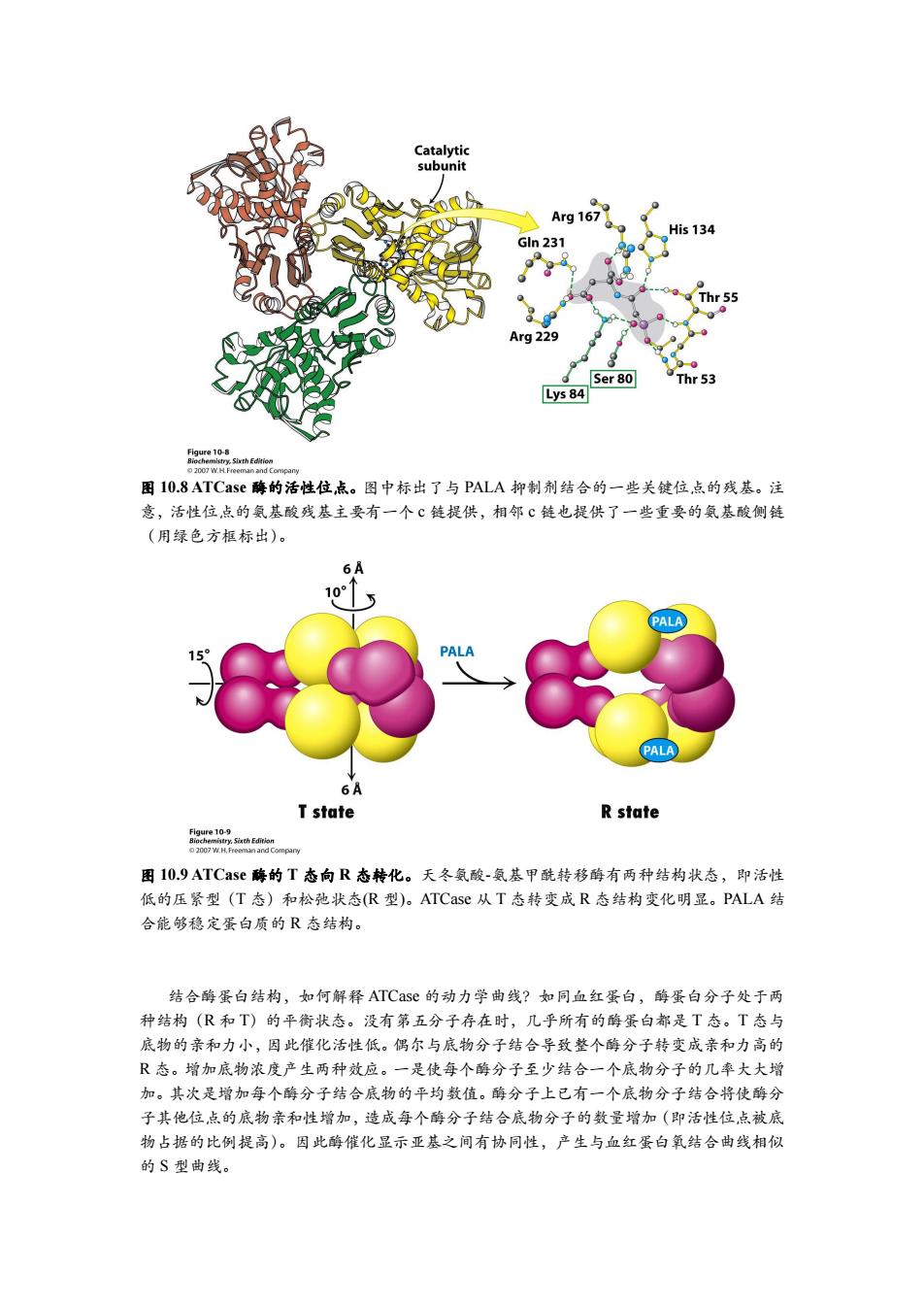
Catalytic subunit 2 Arg 167 His 134 Gln 231 Thr 55 Arg 229 Ser 80 Thr 53 Lys 84 Figure 10-8 图10.8 ATCase酶的活性位,点。图中标出了与PALA抑制剂结合的一些关键位,点的残基。注 意,活性位点的氨基酸残基主要有一个℃链提供,相邻℃链也提供了一些重要的氨基酸侧链 (用绿色方框标出)。 6A 10 PALA PALA PALA 6A T state R state fge102sahfhaon 2007 W.H.Freeman and Company 图10.9 ATCase酶的T态向R态转化。天冬氨酸-氨基甲酰转移酶有两种结构状态,即活性 低的压紧型(T态)和松弛状态(R型)。ATCase从T态转变成R态结构变化明显。PALA结 合能够稳定蛋白质的R态结构。 结合酶蛋白结构,如何解释ATCase的动力学曲线?如同血红蛋白,酶蛋白分子处于两 种结构(R和T)的平衡状态。没有第五分子存在时,几乎所有的酶蛋白都是T态。T态与 底物的亲和力小,因此催化活性低。偶尔与底物分子结合导致整个酶分子转变成亲和力高的 R态。增加底物浓度产生两种效应。一是使每个酶分子至少结合一个底物分子的几率大大增 加。其次是增加每个酶分子结合底物的平均数值。酶分子上已有一个底物分子结合将使酶分 子其他位点的底物亲和性增加,造成每个酶分子结合底物分子的数量增加(即活性位点被底 物占据的比例提高)。因此酶催化显示亚基之间有协同性,产生与血红蛋白氧结合曲线相似 的S型曲线。图 10.8 ATCase 酶的活性位点。图中标出了与 PALA 抑制剂结合的一些关键位点的残基。注 意,活性位点的氨基酸残基主要有一个 c 链提供,相邻 c 链也提供了一些重要的氨基酸侧链 (用绿色方框标出)。 图 10.9 ATCase 酶的 T 态向 R 态转化。天冬氨酸-氨基甲酰转移酶有两种结构状态,即活性 低的压紧型(T 态)和松弛状态(R 型)。ATCase 从 T 态转变成 R 态结构变化明显。PALA 结 合能够稳定蛋白质的 R 态结构。 结合酶蛋白结构,如何解释 ATCase 的动力学曲线?如同血红蛋白,酶蛋白分子处于两 种结构(R 和 T)的平衡状态。没有第五分子存在时,几乎所有的酶蛋白都是 T 态。T 态与 底物的亲和力小,因此催化活性低。偶尔与底物分子结合导致整个酶分子转变成亲和力高的 R 态。增加底物浓度产生两种效应。一是使每个酶分子至少结合一个底物分子的几率大大增 加。其次是增加每个酶分子结合底物的平均数值。酶分子上已有一个底物分子结合将使酶分 子其他位点的底物亲和性增加,造成每个酶分子结合底物分子的数量增加(即活性位点被底 物占据的比例提高)。因此酶催化显示亚基之间有协同性,产生与血红蛋白氧结合曲线相似 的 S 型曲线