正在加载图片...
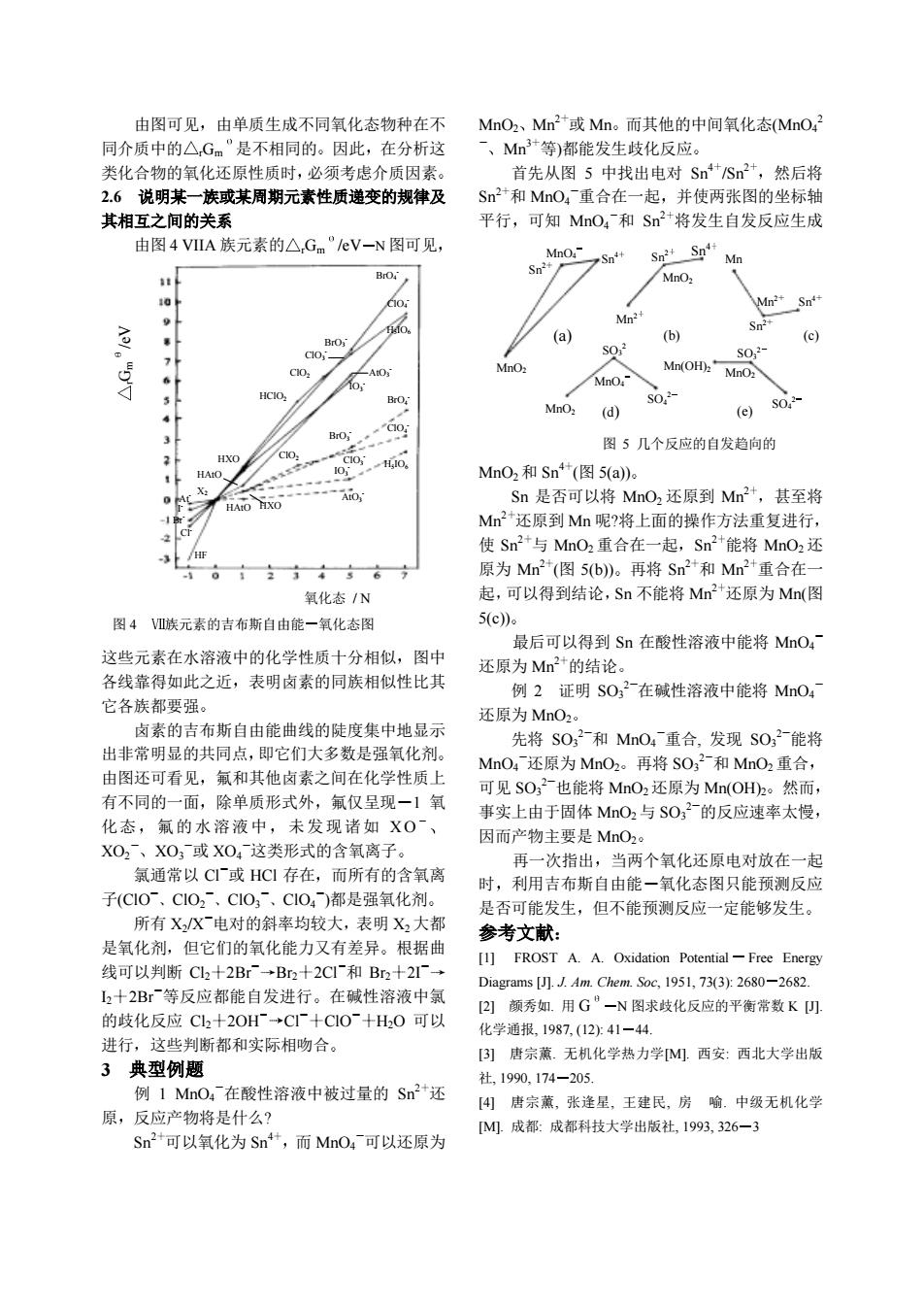
由图可见,由单质生成不同氧化态物种在不 MnO2、Mn2或Mn。而其他的中间氧化态MnO, 同介质中的△Gm”是不相同的。因此,在分析这 、Mn3等)都能发生歧化反应。 类化合物的氧化还原性质时,必须考虑介质因素。 首先从图5中找出电对Sn4*/Sn2,然后将 2.6说明某一族或某周期元素性质递变的规律及 Sn2和MnO4重合在一起,并使两张图的坐标轴 其相互之间的关系 平行,可知MnO4和Sn+将发生自发反应生成 由图4VIA族元素的△,Gm"eV-N图可见 Mno Sn Sn Sn2+Sn Mn BrO. 0 Mn2 Sn (a) (c) 0, S02 o.4 Mno Mn(OH)MnO2 HCIO MnO: (d) (e) s0.3 3 图5几个反应的自发趋向的 HXO HAO、 MnO2和Sn*(图5(a)。 HAO HXO Sn是否可以将MnO2还原到Mn2+,甚至将 Mn2*还原到M血呢?将上面的操作方法重复进行, /F 使Sn2+与MnO2重合在一起,Sn2+能将MnO2还 原为Mn2+(图5b)。再将Sn2+和Mn2+重合在 氧化态/N 起,可以得到结论,Sn不能将Mn+还原为Mn(图 图4族元素的吉布斯自由能一氧化态图 5c) 最后可以得到Sn在酸性溶液中能将MnO4 这些元素在水溶液中的化学性质十分相似,图中 还原为Mn2+的结论。 各线靠得如此之近,表明卤素的同族相似性比其 例2证明SO,2-在碱性溶液中能将MnO4 它各族都要强。 还原为MnO2。 卤素的吉布斯自由能曲线的陡度集中地显示 先将S0,2-和MnO4重合,发现S0,2-能将 出非常明显的共同点,即它们大多数是强氧化剂。 MnO,还原为MnO2。再将S02和MnO2重合, 由图还可看见,氟和其他卤素之间在化学性质上 可见SO,2也能将MnO2还原为Mn(OH2。然而 有不同的一面,除单质形式外,氟仅呈现一1氧 事实上由于固体MnO2与SO,2的反应速率太慢, 化态,氟的水溶液中,未发现诸如X0ˉ、 因而产物主要是MnO2。 XO2、XO3或XO4这类形式的含氧离子。 再一次指出,当两个氧化还原电对放在一起 氯通常以C或HCI存在,而所有的含氧离 时,利用吉布斯自由能一氧化态图只能预测反应 子(C1Oˉ、C1O2、C1O3ˉ、C104)都是强氧化剂。 是否可能发生,但不能预测反应一定能够发生。 所有XX电对的斜率均较大,表明X2大都 参考文献: 是氧化剂,但它们的氧化能力又有差异。根据曲 [1]FROST A.A.Oxidation Potential-Free Energy 线可以判断C2十2Br→Br2十2C1和Br2十2 Diagrams []J.Am.Chem.Soc,1951,73(3):2680-2682. L2十2B等反应都能自发进行。在碱性溶液中氯 [2颜秀如.用G”一N图求歧化反应的平衡常数K) 的歧化反应C2十20H+CI+C10ˉ+H0可以 化学通报,1987,(12少:41-44. 进行,这些判断都和实际相吻合。 B)唐宗薰.无机化学热力学M西安:西北大学出版 3典型例题 社,1990,174-205. 例1MnO:在酸性溶液中被过量的Sn2还 [4唐宗薰,张逢星,王建民,房喻。中级无机化学 原,反应产物将是什么? M.成都:成都科技大学出版社,1993,326一3 Sn2+可以氧化为Sn4+,而MnO4可以还原为 由图可见 由单质生成不同氧化态物种在不 同介质中的 rGm 是不相同的 因此 在分析这 类化合物的氧化还原性质时 必须考虑介质因素 2.6 说明某一族或某周期元素性质递变的规律及 其相互之间的关系 由图 4 VIIA 族元素的 rGm /eV N 图可见 这些元素在水溶液中的化学性质十分相似 图中 各线靠得如此之近 表明卤素的同族相似性比其 它各族都要强 卤素的吉布斯自由能曲线的陡度集中地显示 出非常明显的共同点 即它们大多数是强氧化剂 由图还可看见 氟和其他卤素之间在化学性质上 有不同的一面 除单质形式外 氟仅呈现 1 氧 化态 氟的水溶液中 未发现诸如 X O XO2 XO3 或 XO4 这类形式的含氧离子 氯通常以 Cl 或 HCl 存在 而所有的含氧离 子(ClO ClO2 ClO3 ClO4 )都是强氧化剂 所有 X2/X 电对的斜率均较大 表明 X2 大都 是氧化剂 但它们的氧化能力又有差异 根据曲 线可以判断 Cl2 2Br Br2 2Cl 和 Br2 2I I2 2Br 等反应都能自发进行 在碱性溶液中氯 的歧化反应 Cl2 2OH Cl ClO H2O 可以 进行 这些判断都和实际相吻合 3 典型例题 例 1 MnO4 在酸性溶液中被过量的 Sn2 还 原 反应产物将是什么? Sn2 可以氧化为 Sn4 而 MnO4 可以还原为 MnO2 Mn2 或 Mn 而其他的中间氧化态(MnO4 2 Mn3 等)都能发生歧化反应 首先从图 5 中找出电对 Sn4 /Sn2 然后将 Sn2 和 MnO4 重合在一起 并使两张图的坐标轴 平行 可知 MnO4 和 Sn2 将发生自发反应生成 MnO2 和 Sn4 (图 5(a)) Sn 是否可以将 MnO2 还原到 Mn2 甚至将 Mn2 还原到 Mn 呢?将上面的操作方法重复进行 使 Sn2 与 MnO2 重合在一起 Sn2 能将 MnO2 还 原为 Mn2 (图 5(b)) 再将 Sn2 和 Mn2 重合在一 起 可以得到结论 Sn 不能将 Mn2 还原为 Mn(图 5(c)) 最后可以得到 Sn 在酸性溶液中能将 MnO4 还原为 Mn2 的结论 例 2 证明 SO3 2 在碱性溶液中能将 MnO4 还原为 MnO2 先将 SO3 2 和 MnO4 重合, 发现 SO3 2 能将 MnO4 还原为 MnO2 再将 SO3 2 和 MnO2 重合 可见 SO3 2 也能将 MnO2还原为 Mn(OH)2 然而 事实上由于固体 MnO2与 SO3 2 的反应速率太慢 因而产物主要是 MnO2 再一次指出 当两个氧化还原电对放在一起 时 利用吉布斯自由能 氧化态图只能预测反应 是否可能发生 但不能预测反应一定能够发生 参考文献 [1] FROST A. A. Oxidation Potential Free Energy Diagrams [J]. J. Am. Chem. Soc, 1951, 73(3): 2680 2682. [2] 颜秀如. 用 G N 图求歧化反应的平衡常数 K [J]. 化学通报, 1987, (12): 41 44. [3] 唐宗薰. 无机化学热力学[M]. 西安: 西北大学出版 社, 1990, 174 205. [4] 唐宗薰, 张逢星, 王建民, 房 喻. 中级无机化学 [M]. 成都: 成都科技大学出版社, 1993, 326 3 氧化态 / N 图 4 族元素的吉布斯自由能 氧化态图 Gr m /eV ClO4 - H5IO6 BrO3 - BrO4 - IO3 - ClO3 - AtO3 - ClO2 HClO2 HXO HF ClI - BrO4 - ClO4 - H5IO6 BrO3 - ClO2 AtO3 - HAtO HXO X2 HAtO BrAtIO3 - ClO3 - Sn2 Sn MnO4 4 MnO2 Sn2 Sn4 MnO2 Mn2 Mn Mn2 Sn2 Sn4 (a) (b) MnO2 (d) (e) MnO4 SO3 2 SO4 2 SO3 2 SO4 2 MnO2 图 5 几个反应的自发趋向的 Mn(OH)2 (c)