正在加载图片...
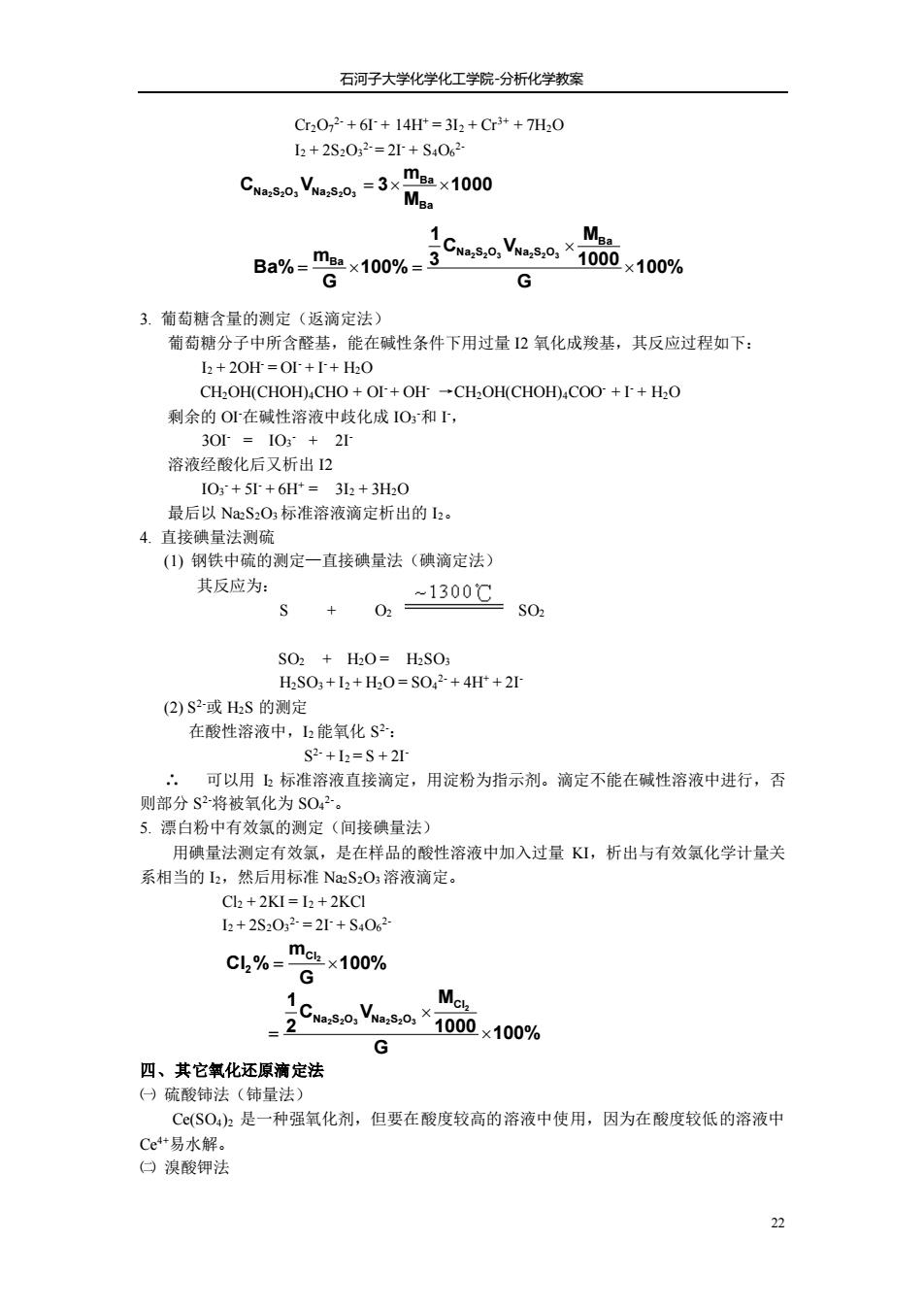
石河子大学化学化工学院分析化学教案 Cr202-+6+14=3L2+Cr3++7H20 2+2S202=2+S4062 Cea,Vao,=3xm×1000 Me. Ba%=mg2x100%3Cwas:0,Va8,0×1o00 ×100% 3.葡萄糖含量的测定(返滴定法} 葡萄糖分子中所含醛基,能在碱性条件下用过量2氧化成羧基,其反应过程如下: I2+20H=0++H2O CH2OH(CHOH)CHO+OI+OH -CH2OH(CHOH)COO+1+H2O 剩余的Or在碱性溶液中歧化成IO和 溶液经酸化后又析出12 10+5+6=32+3H0 最后以NaS2O3标准溶液滴定析出的2。 4直接碘量法测硫 ()钢铁中硫的测定一直接碘量法(碘滴定法) 其反应为: + ,-1300℃0 SO2+HO=HSO HS03+2+H,0=S02+4H+2 (2)S2或HS的测定 在酸性溶液中,2能氧化S2: S2+l2=S+2 :,可以用上标准溶液直接滴定,用淀粉为指示剂。滴定不能在碱性溶液中进行,否 则部分S2-将被氧化为S02。 5.漂白粉中 有效氯的测定(间接碘量法) 用碘量法测定有效氯,是在样品的酸性溶液中加入过量K1,析出与有效氯化学计量关 系相当的2,然后用标准NaS2O3溶液滴定。 Cl +2KI=I+2KCI h+2S2032=2+S4062 c4%="g10% M G 四、其它氧化还原滴定法 日硫酸铈法 (铈量法, C©(SOh是一种强氧化剂,但要在酸度较高的溶液中使用,因为在酸度较低的溶液中 Ce艹易水解。 口溴酸钾法 石河子大学化学化工学院-分析化学教案 22 Cr2O7 2- + 6I- + 14H+ = 3I2 + Cr3+ + 7H2O I2 + 2S2O3 2- = 2I- + S4O6 2- 3. 葡萄糖含量的测定(返滴定法) 葡萄糖分子中所含醛基,能在碱性条件下用过量 I2 氧化成羧基,其反应过程如下: I2 + 2OH- = OI- + I- + H2O CH2OH(CHOH)4CHO + OI- + OH- →CH2OH(CHOH)4COO- + I- + H2O 剩余的 OI-在碱性溶液中歧化成 IO3 -和 I -, 3OI- = IO3 - + 2I- 溶液经酸化后又析出 I2 IO3 - + 5I- + 6H+ = 3I2 + 3H2O 最后以 Na2S2O3 标准溶液滴定析出的 I2。 4. 直接碘量法测硫 (1) 钢铁中硫的测定—直接碘量法(碘滴定法) 其反应为: S + O2 SO2 SO2 + H2O = H2SO3 H2SO3 + I2 + H2O = SO4 2- + 4H+ + 2I- (2) S2-或 H2S 的测定 在酸性溶液中,I2 能氧化 S 2-: S 2- + I2 = S + 2I- ∴ 可以用 I2 标准溶液直接滴定,用淀粉为指示剂。滴定不能在碱性溶液中进行,否 则部分 S 2-将被氧化为 SO4 2-。 5. 漂白粉中有效氯的测定(间接碘量法) 用碘量法测定有效氯,是在样品的酸性溶液中加入过量 KI,析出与有效氯化学计量关 系相当的 I2,然后用标准 Na2S2O3 溶液滴定。 Cl2 + 2KI = I2 + 2KCl I2 + 2S2O3 2- = 2I- + S4O6 2- 四、其它氧化还原滴定法 ㈠ 硫酸铈法(铈量法) Ce(SO4)2 是一种强氧化剂,但要在酸度较高的溶液中使用,因为在酸度较低的溶液中 Ce4+易水解。 ㈡ 溴酸钾法 1000 M m C V 3 Ba Ba Na2S2O3 Na2S2O3 = 100% G 1000 M C V 3 1 100% G m Ba% Ba Na S O Na S O Ba 2 2 3 2 2 3 = = 100% G m Cl % Cl2 2 = 100% G 1000 M C V 2 1 2 2 2 3 2 2 3 Cl Na S O Na S O =