正在加载图片...
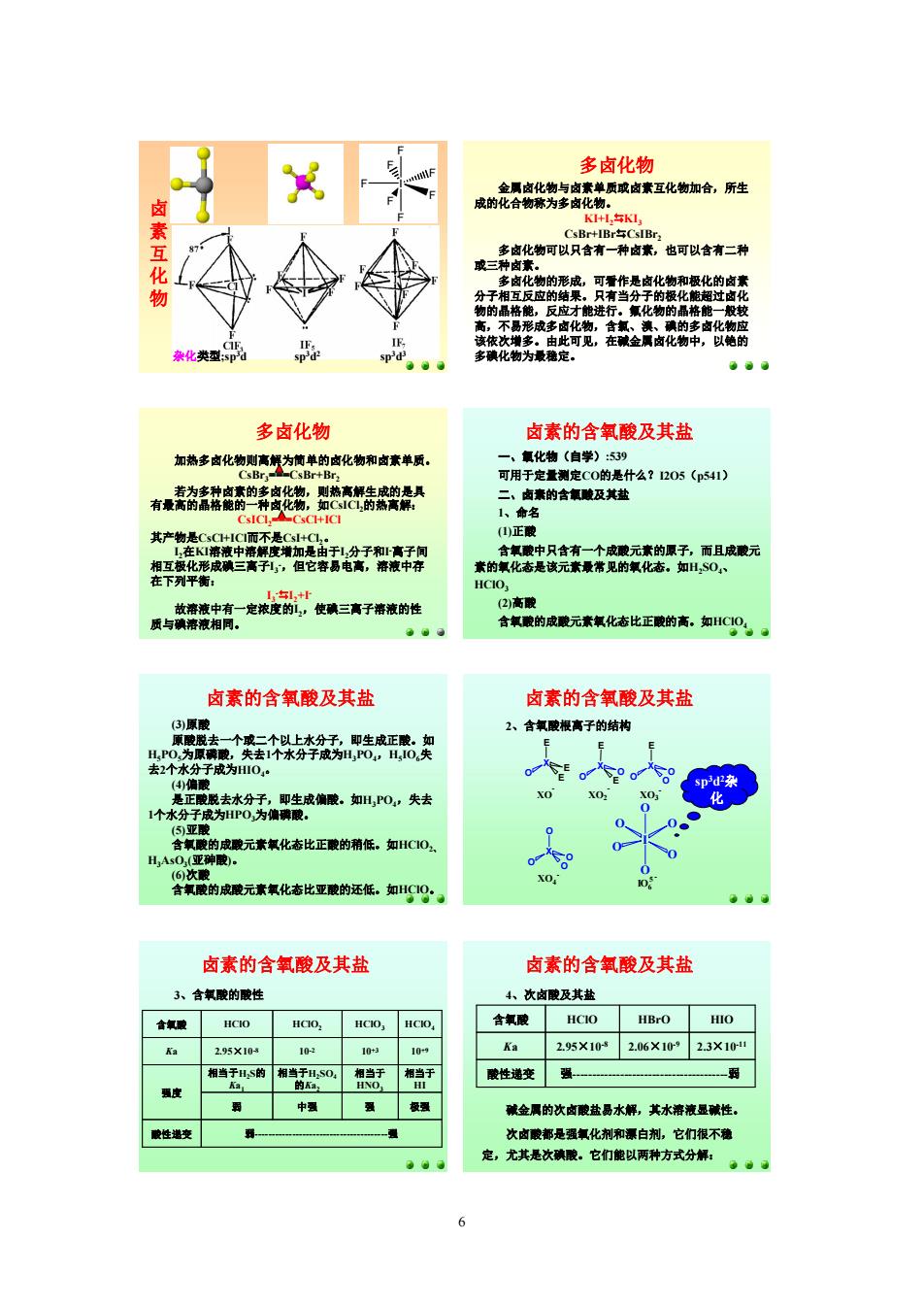
E 多卤化物 多 也可以含有二种 化类型 多化物为最定。 0.0 多卤化物 卤素的含氧酸及其盐 一、氧化物(自学):539 什么?1205(p541) 有热密资的茶光袋货典 属热精结克定技的皮精三青子常精的性 0 高酸 含氧酸的成酸元素氧化态比正酸的离,知0。 肉素的含氧酸及其盐 卤素的含氧酸及其盐 2、含氧酸根高子的结构 眼去 E E X02 卤素的含氧酸及其盐 卤素的含氧酸及其盐 3、合氧的酸性 次卤膜及其盐 含氧酸 HCIO HBro HIO Ka 295X10 295X102.06×1*23X10 湘当于H,s的当s0海于 酸性递变强一 中 减金属的次卤酸盐西水解,其水溶液显碱性。 性变 次肉酸都是强氯化剂和源白剂,它门很不薄 定,尤其是次确酸。它们能以两种方式分解:6 卤 素 互 化 物 杂化类型;sp 3d sp 3d 2 sp 3d 3 F F F F F I F F 多卤化物 金属卤化物与卤素单质或卤素互化物加合,所生 成的化合物称为多卤化物。 KI+I2DKI3 CsBr+IBrDCsIBr 2 多卤化物可以只含有一种卤素,也可以含有二种 或三种卤素。 多卤化物的形成,可看作是卤化物和极化的卤素 分子相互反应的结果。只有当分子的极化能超过卤化 物的晶格能,反应才能进行。氟化物的晶格能一般较 高,不易形成多卤化物,含氯、溴、碘的多卤化物应 该依次增多。由此可见,在碱金属卤化物中,以铯的 多碘化物为最稳定。 多卤化物 加热多卤化物则离解为简单的卤化物和卤素单质。 CsBr 3===CsBr+Br 2 若为多种卤素的多卤化物,则热离解生成的是具 有最高的晶格能的一种卤化物,如CsICl 2的热离解: CsICl 2===CsCl+ICl 其产物是CsCl+ICl而不是CsI+Cl 2。 I2在KI溶液中溶解度增加是由于I2分子和I 离子间 相互极化形成碘三离子I3 ,但它容易电离,溶液中存 在下列平衡: I3 DI2+I 故溶液中有一定浓度的I2,使碘三离子溶液的性 质与碘溶液相同。 卤素的含氧酸及其盐 一、氧化物(自学):539 可用于定量测定CO的是什么?I2O5(p541) 二、卤素的含氧酸及其盐 1、命名 (1)正酸 含氧酸中只含有一个成酸元素的原子,而且成酸元 素的氧化态是该元素最常见的氧化态。如H 2SO 4、 HClO 3 (2)高酸 含氧酸的成酸元素氧化态比正酸的高。如HClO 4 卤素的含氧酸及其盐 (3)原酸 原酸脱去一个或二个以上水分子,即生成正酸。如 H 5PO 5为原磷酸,失去1个水分子成为H 3PO 4,H 5IO 6失 去2个水分子成为HIO 4。 (4)偏酸 是正酸脱去水分子,即生成偏酸。如H 3PO 4,失去 1个水分子成为HPO 3为偏磷酸。 (5)亚酸 含氧酸的成酸元素氧化态比正酸的稍低。如HClO 2、 H 3AsO 3(亚砷酸)。 (6)次酸 含氧酸的成酸元素氧化态比亚酸的还低。如HClO。 卤素的含氧酸及其盐 2、含氧酸根离子的结构 sp 3 d 2 杂 化 E X O O O E X O EO E X O E E I O O O O O O IO 6 O X O O O XO XO 2 XO 3 XO 4 5 卤素的含氧酸及其盐 3、含氧酸的酸性 酸性递变 弱强 弱 中强 强 极强 相当于 HI 相当于 HNO 3 相当于H 2 SO 4 的Ka2 相当于H 2 S的 Ka1 强度 10 +9 10 +3 10 2 2.95×10 K 8 a HClO HC 4 lO HC 3 lO HC 2 含氧酸 lO 卤素的含氧酸及其盐 4、次卤酸及其盐 酸性递变 强弱 2.3×10 11 2.06×10 9 2.95×10 K 8 a 含氧酸 HClO HBrO HIO 碱金属的次卤酸盐易水解,其水溶液显碱性。 次卤酸都是强氧化剂和漂白剂,它们很不稳 定,尤其是次碘酸。它们能以两种方式分解: