正在加载图片...
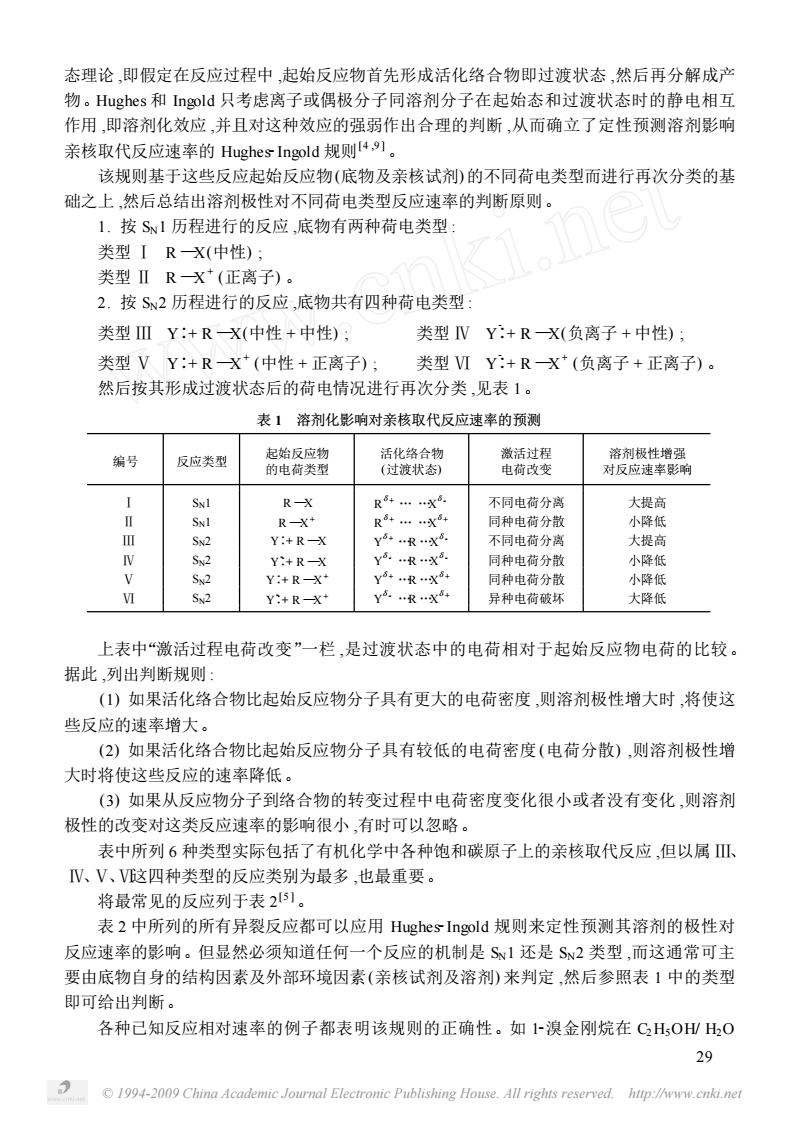
态理论,即假定在反应过程中,起始反应物首先形成活化络合物即过渡状态,然后再分解成产 物。Hughes和Ingold只考虑离子或偶极分子同溶剂分子在起始态和过渡状态时的静电相互 作用,即溶剂化效应,并且对这种效应的强弱作出合理的判断,从而确立了定性预测溶剂影响 亲核取代反应速率的Hughes Ingold规则4,。 该规则基于这些反应起始反应物(底物及亲核试剂)的不同荷电类型而进行再次分类的基 础之上,然后总结出溶剂极性对不同荷电类型反应速率的判断原则。 1.按S1历程进行的反应,底物有两种荷电类型 类型IRX(中性): 类型ⅡRX(正离子) 2.按S2历程进行的反应,底物共有四种荷电类型: 类型ⅢY:+R一X(中性+中性): 类型NY:+RX(负离子+中性): 类型VY:+RX(中性+正离子) 类型ⅥY:+RX*(负离子+正离子)。 然后按其形成过渡状态后的荷电情况进行再次分类,见表1。 表】溶剂化影响对亲核取代反应速率的预测 编号 反应类型 的电爽避 R- R……X 不同电荷分离 大提高 R R…X 同种电荷分散 小降低 Y:+R-X Y…R…X 不同电荷分义 大提高 Y:+R-X 司种电荷分留 小降低 Y:+R-X y+x 同种电荷分者 小降低 M Y:+R- 异种电荷破坏 大降低 上表中“激活过程电荷改变”一栏,是过渡状态中的电荷相对于起始反应物电荷的比较 据此,列出判断规则: ()如果活化络合物比起始反应物分子具有更大的电荷密度,则溶剂极性增大时,将使这 些反应的速率增大。 (2)如果活化络合物比起始反应物分子具有较低的电荷密度(电荷分散),则溶剂极性增 大时将使这些反应的速率降低。 (3)如果从反应物分子到络合物的转变过程中电荷密度变化很小或者没有变化,则溶剂 极性的改变对这类反应速率的影响很小,有时可以忽略。 表中所列6种类型实际包括了有机化学中各种饱和碳原子上的亲核取代反应,但以属Ⅲ、 V、V、V这四种类型的反应类别为最多,也最重要。 将最常见的反应列于表251。 表2中所列的所有异裂反应都可以应用Hughes-Ingold规则来定性预测其溶剂的极性对 反应速率的影响。但显然必须知道任何一个反应的机制是S1还是S2类型,而这通常可主 要由底物自身的结构因素及外部环境因素(亲核试剂及溶剂)来判定,然后参照表1中的类型 即可给出判断。 各种己知反应相对速率的例子都表明该规则的正确性。如~溴金刚烷在CH,O山H,O 29 194-009 China Academic Journal Electronic Publishing House.All rights reserved.hup://ww.© 1994-2009 China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 态理论 ,即假定在反应过程中 ,起始反应物首先形成活化络合物即过渡状态 ,然后再分解成产 物。Hughes 和 Ingold 只考虑离子或偶极分子同溶剂分子在起始态和过渡状态时的静电相互 作用 ,即溶剂化效应 ,并且对这种效应的强弱作出合理的判断 ,从而确立了定性预测溶剂影响 亲核取代反应速率的 Hughes2Ingold 规则[4 ,9 ] 。 该规则基于这些反应起始反应物(底物及亲核试剂) 的不同荷电类型而进行再次分类的基 础之上 ,然后总结出溶剂极性对不同荷电类型反应速率的判断原则。 1. 按 SN1 历程进行的反应 ,底物有两种荷电类型 : 类型 Ⅰ R —X(中性) ; 类型 Ⅱ R —X + (正离子) 。 2. 按 SN2 历程进行的反应 ,底物共有四种荷电类型 : 类型 Ⅲ Y∶+ R —X(中性 + 中性) ; 类型 Ⅳ Y -∶+ R —X(负离子 + 中性) ; 类型 Ⅴ Y∶+ R —X + (中性 + 正离子) ; 类型 Ⅵ Y -∶+ R —X + (负离子 + 正离子) 。 然后按其形成过渡状态后的荷电情况进行再次分类 ,见表 1。 表 1 溶剂化影响对亲核取代反应速率的预测 编号 反应类型 起始反应物 的电荷类型 活化络合物 (过渡状态) 激活过程 电荷改变 溶剂极性增强 对反应速率影响 Ⅰ SN1 R —X R δ+ … …X δ- 不同电荷分离 大提高 Ⅱ SN1 R —X + R δ+ … …X δ+ 同种电荷分散 小降低 Ⅲ SN2 Y∶+ R —X Y δ+ …R …X δ- 不同电荷分离 大提高 Ⅳ SN2 Y -∶+ R —X Y δ- …R …X δ- 同种电荷分散 小降低 Ⅴ SN2 Y∶+ R —X + Y δ+ …R …X δ+ 同种电荷分散 小降低 Ⅵ SN2 Y -∶+ R —X + Y δ- …R …X δ+ 异种电荷破坏 大降低 上表中“激活过程电荷改变”一栏 ,是过渡状态中的电荷相对于起始反应物电荷的比较。 据此 ,列出判断规则 : (1) 如果活化络合物比起始反应物分子具有更大的电荷密度 ,则溶剂极性增大时 ,将使这 些反应的速率增大。 (2) 如果活化络合物比起始反应物分子具有较低的电荷密度 (电荷分散) ,则溶剂极性增 大时将使这些反应的速率降低。 (3) 如果从反应物分子到络合物的转变过程中电荷密度变化很小或者没有变化 ,则溶剂 极性的改变对这类反应速率的影响很小 ,有时可以忽略。 表中所列 6 种类型实际包括了有机化学中各种饱和碳原子上的亲核取代反应 ,但以属 Ⅲ、 Ⅳ、Ⅴ、Ⅵ这四种类型的反应类别为最多 ,也最重要。 将最常见的反应列于表 2 [5 ] 。 表 2 中所列的所有异裂反应都可以应用 Hughes2Ingold 规则来定性预测其溶剂的极性对 反应速率的影响。但显然必须知道任何一个反应的机制是 SN1 还是 SN2 类型 ,而这通常可主 要由底物自身的结构因素及外部环境因素(亲核试剂及溶剂) 来判定 ,然后参照表 1 中的类型 即可给出判断。 各种已知反应相对速率的例子都表明该规则的正确性。如 12溴金刚烷在 C2H5OH/ H2O 29