正在加载图片...
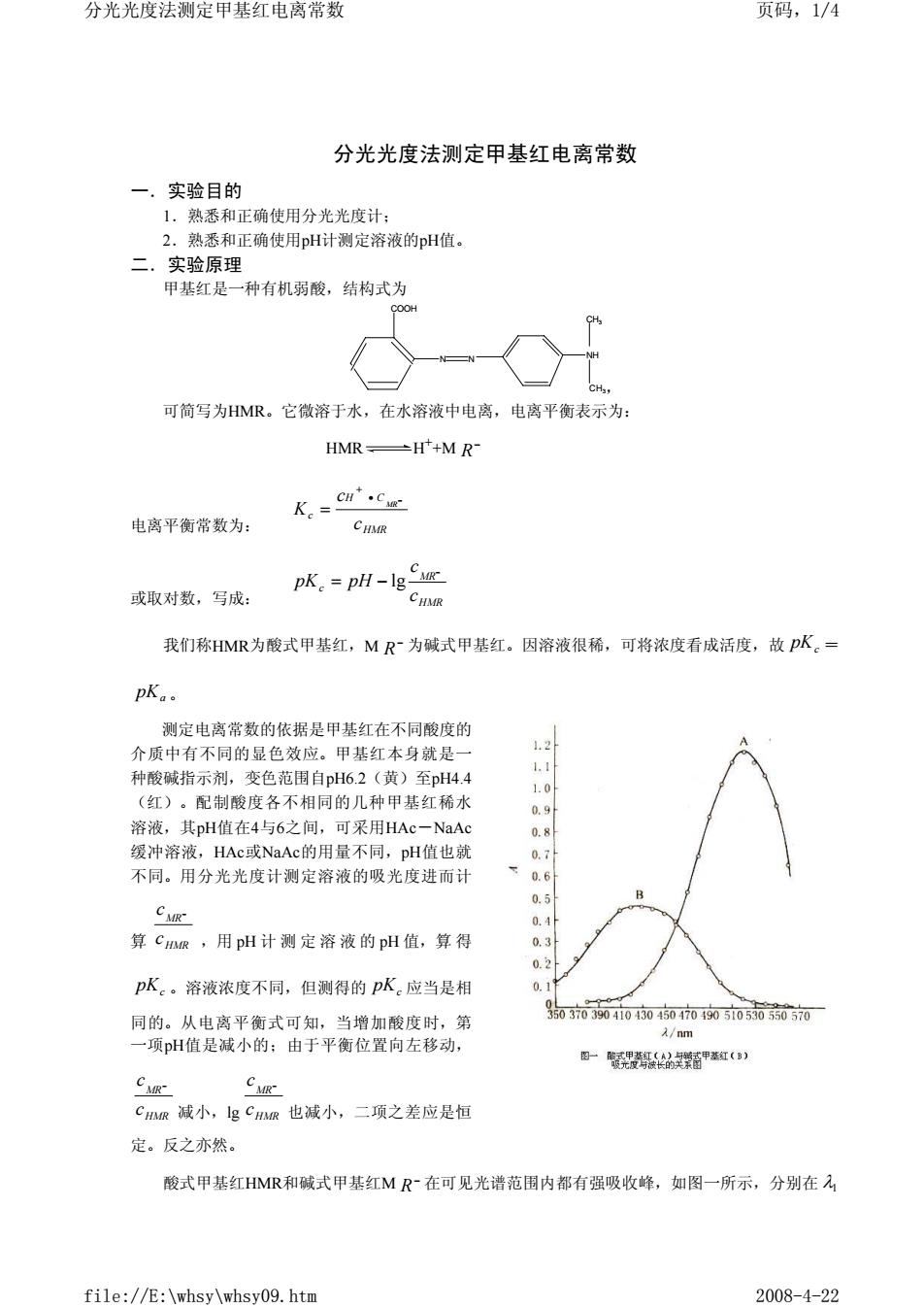
分光光度法测定甲基红电离常数 页码,1/4 分光光度法测定甲基红电离常数 一,实验目的 1。熟悉和正确使用分光光府计 2. 熟悉和正确使用pH计测定溶液的pH值。 二.实验原理 甲基红是一种有机弱酸,结构式为 T9 可简写为HMR。它微溶于水,在水溶液中电离,电离平衡表示为 HMR-H++M R- K。=er'cz 电离平衡常数为: 或取对数,写成: pK.-pH-Ig ug CHMR 我们称HMR为酸式甲基红,MR~为碱式甲基红。因溶液很稀,可将浓度看成活度,故pK。= pK.. 测定电离常数的依据是甲基红在不同酸度的 介质中有不同的显色效应。甲基红本身就是一 .1 种酸碱指示剂,变色范围自pH6.2(黄)至pH4.4 1.0 (红)。配制酸度各不相同的几种甲基红稀水 溶液,其pH值在4与6之间,可采用HAc一NaA a.9 0.8 缓冲溶液,HAc或NaAc的用最不同,pH值也就 0.7 不同。用分光光度计测定溶液的吸光度进而计 下0.6 0.5 0.1 算CR,用pH计测定溶液的pH值,算得 0 0.2 pK。溶液浓度不同,但测得的pK。应当是相 同的。从电离平衡式可知,当增加酸度时,第 07004040400005005沉 /nm 一项pH值是减小的:由于平衡位置向左移动, 一轻甲( C假- CuR Cm减小,lgCR也减小,二项之差应是恒 定。反之亦然。 酸式甲基红HMR和碱式甲基红MR在可见光谱范围内都有强吸收峰,如图一所示,分别在 file://E:\whsy\whsy09.htm 2008-4-22 分光光度法测定甲基红电离常数 一.实验目的 1.熟悉和正确使用分光光度计; 2.熟悉和正确使用pH计测定溶液的pH值。 二.实验原理 甲基红是一种有机弱酸,结构式为 , 可简写为HMR。它微溶于水,在水溶液中电离,电离平衡表示为: HMR H++M 电离平衡常数为: 或取对数,写成: 我们称HMR为酸式甲基红,M 为碱式甲基红。因溶液很稀,可将浓度看成活度,故 = 。 测定电离常数的依据是甲基红在不同酸度的 介质中有不同的显色效应。甲基红本身就是一 种酸碱指示剂,变色范围自pH6.2(黄)至pH4.4 (红)。配制酸度各不相同的几种甲基红稀水 溶液,其pH值在4与6之间,可采用HAc-NaAc 缓冲溶液,HAc或NaAc的用量不同,pH值也就 不同。用分光光度计测定溶液的吸光度进而计 算 ,用 pH 计测定溶液的 pH 值,算 得 。溶液浓度不同,但测得的 应当是相 同的。从电离平衡式可知,当增加酸度时,第 一项pH值是减小的;由于平衡位置向左移动, 减小,lg 也减小,二项之差应是恒 定。反之亦然。 酸式甲基红HMR和碱式甲基红M 在可见光谱范围内都有强吸收峰,如图一所示,分别在 COOH N N NH CH3 CH3 − R HMR H C c c c K MR • − + = HMR MR c c c pK pH − = − lg − R pKc pKa HMR MR c c − pKc pKc HMR MR c c − HMR MR c c − − R λ1 分光光度法测定甲基红电离常数 页码,1/4 file://E:\whsy\whsy09.htm 2008-4-22