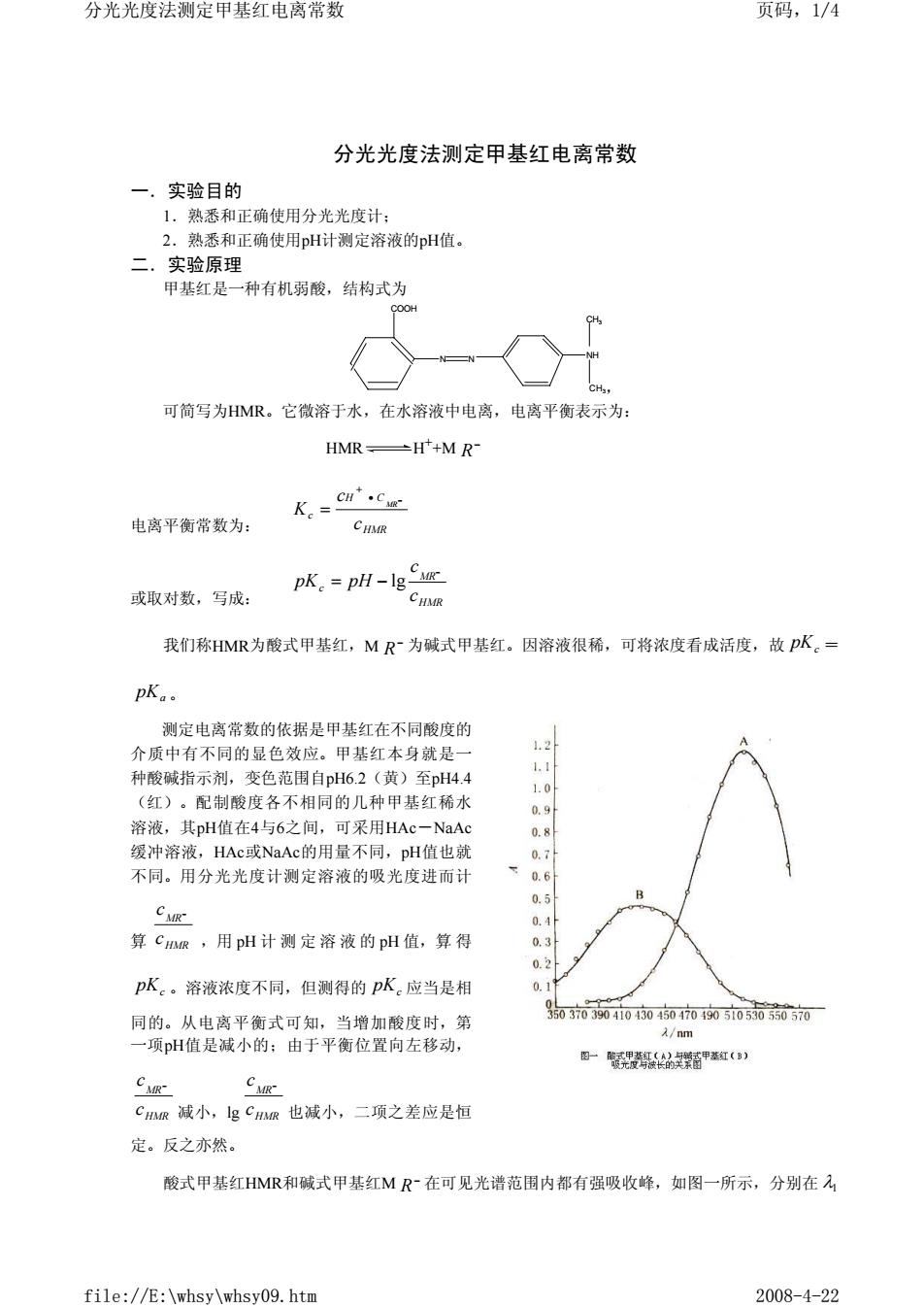
分光光度法测定甲基红电离常数 页码,1/4 分光光度法测定甲基红电离常数 一,实验目的 1。熟悉和正确使用分光光府计 2. 熟悉和正确使用pH计测定溶液的pH值。 二.实验原理 甲基红是一种有机弱酸,结构式为 T9 可简写为HMR。它微溶于水,在水溶液中电离,电离平衡表示为 HMR-H++M R- K。=er'cz 电离平衡常数为: 或取对数,写成: pK.-pH-Ig ug CHMR 我们称HMR为酸式甲基红,MR~为碱式甲基红。因溶液很稀,可将浓度看成活度,故pK。= pK.. 测定电离常数的依据是甲基红在不同酸度的 介质中有不同的显色效应。甲基红本身就是一 .1 种酸碱指示剂,变色范围自pH6.2(黄)至pH4.4 1.0 (红)。配制酸度各不相同的几种甲基红稀水 溶液,其pH值在4与6之间,可采用HAc一NaA a.9 0.8 缓冲溶液,HAc或NaAc的用最不同,pH值也就 0.7 不同。用分光光度计测定溶液的吸光度进而计 下0.6 0.5 0.1 算CR,用pH计测定溶液的pH值,算得 0 0.2 pK。溶液浓度不同,但测得的pK。应当是相 同的。从电离平衡式可知,当增加酸度时,第 07004040400005005沉 /nm 一项pH值是减小的:由于平衡位置向左移动, 一轻甲( C假- CuR Cm减小,lgCR也减小,二项之差应是恒 定。反之亦然。 酸式甲基红HMR和碱式甲基红MR在可见光谱范围内都有强吸收峰,如图一所示,分别在 file://E:\whsy\whsy09.htm 2008-4-22
分光光度法测定甲基红电离常数 一.实验目的 1.熟悉和正确使用分光光度计; 2.熟悉和正确使用pH计测定溶液的pH值。 二.实验原理 甲基红是一种有机弱酸,结构式为 , 可简写为HMR。它微溶于水,在水溶液中电离,电离平衡表示为: HMR H++M 电离平衡常数为: 或取对数,写成: 我们称HMR为酸式甲基红,M 为碱式甲基红。因溶液很稀,可将浓度看成活度,故 = 。 测定电离常数的依据是甲基红在不同酸度的 介质中有不同的显色效应。甲基红本身就是一 种酸碱指示剂,变色范围自pH6.2(黄)至pH4.4 (红)。配制酸度各不相同的几种甲基红稀水 溶液,其pH值在4与6之间,可采用HAc-NaAc 缓冲溶液,HAc或NaAc的用量不同,pH值也就 不同。用分光光度计测定溶液的吸光度进而计 算 ,用 pH 计测定溶液的 pH 值,算 得 。溶液浓度不同,但测得的 应当是相 同的。从电离平衡式可知,当增加酸度时,第 一项pH值是减小的;由于平衡位置向左移动, 减小,lg 也减小,二项之差应是恒 定。反之亦然。 酸式甲基红HMR和碱式甲基红M 在可见光谱范围内都有强吸收峰,如图一所示,分别在 COOH N N NH CH3 CH3 − R HMR H C c c c K MR • − + = HMR MR c c c pK pH − = − lg − R pKc pKa HMR MR c c − pKc pKc HMR MR c c − HMR MR c c − − R λ1 分光光度法测定甲基红电离常数 页码,1/4 file://E:\whsy\whsy09.htm 2008-4-22

分光光度法测定甲基红电离常数 页码,2/4 =520nm与入2=430nm处出峰。此处测得的吸光度对该物质十分灵敏,其他物质的干扰吸收则 很小。 根据朗白一比耳(Lambert--Beer)定律,溶液对某单色光的吸光度A、溶液浓度c、吸收池厚度b 等服从如下关系 A=lg /=kcb=Kc 式中,与分别为该波长单色光的入射强度与透射强度,1,称为透光度,以T表示。当吸收池厚度 b一定时吸光度与溶液浓度成正比。K称为吸光系数,它与光波波长、吸光物质有关。吸光度有加和 性,当溶液中含有多种组分时,总吸光度等于各组分吸光度之和。现溶液中HMR和MR~的浓度分 别为CHR和Csm,A,和A2为在波长和入2下测得的总吸光度,则 A=K1MMIRCIR +KAC A2=K,nnCR+K2rCR CA A.K.IR-AK 解联立方程得: Cma AK:r A K u 解出CR并测得pH值,可得pK。· 吸光系数K的确定。因K与吸光物质和光的波长有关,故确定吸光系数应固定波长(通常选择出 现吸收峰时的波长)和采用纯净的被测物质。例如测HMR的吸光系数,溶液的酸度应为pH=2,此 时几乎全是HMR:而pH=8时溶液中几平全是MR。具体测定方法是配制不同浓度的被测物质溶 液,在确定的波长下测吸光度,作吸光度一浓度曲线,所得直线斜率即为吸光系数。 因pK。随温度变化很小,故本实验可在室温下进行 三.仪器与试剂 722型分光光度计(1台):pHS-3C酸度计(1台):100ml容最瓶(7支);50ml烧杯(6支): 10ml移液管(4支):50ml量筒(4台):甲基红溶液(公用)。 (1)贮备溶液一1g甲基红品体溶于300ml95%乙醇中,过滤,用纯水稀释至500ml. (2)标准溶液 一取4ml贮备溶液加50ml95%乙醇,用纯水稀释至100ml。 NaAc溶液0.04molL(公用):NaAc溶液0.01molL(公用):HAc溶液0.02molL(公用): HC1溶液0.01moL(公用):HCI溶液0.1 mol/L(公用)。 以上溶液都不必准确配制,取液可用量筒。 四.实验步骤 1.722型分光光度计的调节和使用 fi】 //E:\whsy\whsy09.htm 2008-4-22
=520nm与 430nm处出峰。此处测得的吸光度对该物质十分灵敏,其他物质的干扰吸收则 很小。 根据朗白-比耳(Lambert-Beer)定律,溶液对某单色光的吸光度A、溶液浓度c、吸收池厚度b 等服从如下关系: A=lg =kcb=Kc 式中,I 0与I分别为该波长单色光的入射强度与透射强度, 称为透光度,以T表示。当吸收池厚度 b一定时吸光度与溶液浓度成正比。K称为吸光系数,它与光波波长、吸光物质有关。吸光度有加和 性,当溶液中含有多种组分时,总吸光度等于各组分吸光度之和。现溶液中HMR和M 的浓度分 别为 和 ,A1和A2为在波长 和 下测得的总吸光度,则 A1= A2= 解联立方程得: 解出 并测得pH值,可得 。 吸光系数K的确定。因K与吸光物质和光的波长有关,故确定吸光系数应固定波长(通常选择出 现吸收峰时的波长)和采用纯净的被测物质。例如测HMR的吸光系数,溶液的酸度应为pH=2,此 时几乎全是HMR;而pH=8时溶液中几乎全是M 。具体测定方法是配制不同浓度的被测物质溶 液,在确定的波长下测吸光度,作吸光度-浓度曲线,所得直线斜率即为吸光系数。 因 随温度变化很小,故本实验可在室温下进行。 三.仪器与试剂 722型分光光度计(1台);pHS-3C酸度计(1台);100ml容量瓶(7支);50ml烧杯(6支); 10ml移液管(4支);50ml量筒(4台);甲基红溶液(公用)。 (1)贮备溶液——1g甲基红晶体溶于300ml95%乙醇中,过滤,用纯水稀释至500ml。 (2)标准溶液——取4ml贮备溶液加50ml95%乙醇,用纯水稀释至100ml。 NaAc溶液0.04mol/L(公用);NaAc溶液0.01mol/L(公用);HAc溶液0.02mol/L(公用); HCl溶液0.01mol/L(公用);HCl溶液0.1mol/L(公用)。 以上溶液都不必准确配制,取液可用量筒。 四.实验步骤 1.722型分光光度计的调节和使用 λ2 = I I 0 0 I I − R HMR c − MR c λ1 λ2 + − − HMR HMR MR MR K c K c 1, 1, + − − HMR HMR MR MR K c K c 2, 2, − − − − − = MR MR HMR HMR HMR MR A K A K A K A K c c 1 2, 2 1, 2 1, 1 2, HMR MR c c − pKc − R pKc 分光光度法测定甲基红电离常数 页码,2/4 file://E:\whsy\whsy09.htm 2008-4-22

分光光度法测定甲基红电离常数 页码,3/4 2.吸光系数KHR、KR、K2R、K2.R的测定 (1)用移液管准确吸取10ml甲基红标准溶液移入100ml容量瓶中,加入10ml0.1mol/LHC1溶 液,用水稀释至刻度。此溶液pH值约为2,甲基红绝大部分以HMR存在,称为A液,颜色为深红: (2)用移液管准确吸取10ml甲基红标准溶液移入100ml容量瓶中 加入25ml0.04 mol/LNaAc溶 液,用水稀释至刻度。此溶液H值约为8,甲基红绝大部分以MR存在,称为B液,颜色为黄色; 31 (3)用0.01 mol/LHCI溶液和0.01 mol/LnaAc溶液分别准确稀释A液和B液至原刻度的4、2、和 4。如此配制6份待测液。设A液、B液的浓度为c,(二者相等),则稀释后的浓度c分别为4co 1 1 2c04c0 (4)以纯水为空白,以21=520nm、2=430nm单色光分别测定以上6份待测液的吸光度A. 作吸光度A对溶液浓度©的曲线,包括原点(c=O,A=O)和A、B原液的数据。曲线为直线,从直 c 线斜率可求吸光系数K。由于A、B原液的浓度c,的确切值并不知道,故横坐标采用相对浓度C, CMR- 求得的吸光系数K中包含有的因子,在计算CR时,c,被消去,所以对计算结果没有影响。 3.配制四种不同酸度的甲基红溶液并测吸光度。各取10ml甲基红标准溶液和25ml0.04mol1 NaA溶液,随后分别加入50、2 、10、5ml0.02 mol/LHAc溶液,加纯水稀释至约100ml。配制待测 液样品时所用各种试剂的量不必很准,但配好后浓度不能再作变动。 测定上述4种溶液通过1、32单色光的吸光度。 4.用酸度计测定上述4种溶液的pH值。 五.数据处理 1.A、B液不同浓度下吸光度数据记录表 co A液 吸光度 B液 2 作吸光度对浓度A-C图,求直线斜率和各个吸光系数KHR、KR、KmR、K2,,并 计算出CR。 2.不同酸度甲基红溶液吸光度和pH值测定结果及计算 样品号 2 3 4 file://E:\whsy\whsy09.htm 2008-4-22
2.吸光系数 、 、 、 的测定 (1)用移液管准确吸取10ml甲基红标准溶液移入100ml容量瓶中,加入10ml0.1mol/LHCl溶 液,用水稀释至刻度。此溶液pH值约为2,甲基红绝大部分以HMR存在,称为A液,颜色为深红; (2)用移液管准确吸取10ml甲基红标准溶液移入100ml容量瓶中,加入25ml0.04mol/LNaAc溶 液,用水稀释至刻度。此溶液pH值约为8,甲基红绝大部分以MR- 存在,称为B液,颜色为黄色; (3)用0.01mol/LHCl溶液和0.01mol/LnaAc溶液分别准确稀释A液和B液至原刻度的 、 、和 。如此配制6份待测液。设A液、B液的浓度为c0(二者相等),则稀释后的浓度c分别为 c0、 c0、 c0。 (4)以纯水为空白,以λ1=520nm、λ2=430nm单色光分别测定以上6份待测液的吸光度A。 作吸光度A对溶液浓度c的曲线,包括原点(c=0,A=0)和A、B原液的数据。曲线为直线,从直 线斜率可求吸光系数K。由于A、B原液的浓度c0的确切值并不知道,故横坐标采用相对浓度 , 求得的吸光系数K中包含有 c0 的因子,在计算 时,c0被消去,所以对计算结果没有影响。 3.配制四种不同酸度的甲基红溶液并测吸光度。各取10ml甲基红标准溶液和25ml0.04mol/L NaAc溶液,随后分别加入50、25、10、5ml0.02mol/LHAc溶液,加纯水稀释至约100ml。配制待测 液样品时所用各种试剂的量不必很准,但配好后浓度不能再作变动。 测定上述4种溶液通过λ1、λ2单色光的吸光度。 4.用酸度计测定上述4种溶液的pH值。 五.数据处理 1.A、B液不同浓度下吸光度数据记录表 作吸光度对浓度A-c图,求直线斜率和各个吸光系数 、 、 、 ,并 计算出 。 2.不同酸度甲基红溶液吸光度和pH值测定结果及计算 K1,HMR − MR K1, K2,HMR − MR K2, 4 3 2 1 4 1 4 3 2 1 4 1 0 c c HMR MR c c − c0 4 3 c0 2 1 c0 4 1 吸光度A A液 λ1 λ2 B液 λ1 λ2 K1,HMR − MR K1, K2,HMR − MR K2, HMR MR c c − 样品号 1 2 3 4 分光光度法测定甲基红电离常数 页码,3/4 file://E:\whsy\whsy09.htm 2008-4-22

分光光度法测定甲基红电离常数 页码,4/4 g pH 3.25℃时K的文献值为4.95,求各测定值的相对误差。 六.思考题 1.制备溶液时,所用HC、Ac、NaAc溶液各起什么作用? 2用分光光度法进行测定时,为什么要用空白溶液校正零点?理论上应该用什么溶液作为空白 溶液 参考文献: [1]陈国珍编著,分光光度法,科学出版社(1961)。 [2]F.Daniels,R.A.Albert,J.W.Williams,C.D.Comnwell,P.Bender,J.E.Harriman, Experimental Physical Chemistry.hed McGraw-Hill,Inc..New York(1962). file://E:\whsy\whsy09.htm 2008-4-22
3.25℃时pKc 的文献值为4.95,求各测定值的相对误差。 六.思考题 1.制备溶液时,所用HCl、HAc、NaAc溶液各起什么作用? 2.用分光光度法进行测定时,为什么要用空白溶液校正零点?理论上应该用什么溶液作为空白 溶液? 参考文献: [1]陈国珍编著,分光光度法,科学出版社(1961)。 [2]F. Daniels, R. A. Albert, J. W. Williams, C. D. Cornwell, P. Bender, J. E. Harriman, Experimental Physical Chemistry, 6th ed., McGraw-Hill, Inc., New York(1962). A1 A2 lg HMR c MR c − pH pKc 分光光度法测定甲基红电离常数 页码,4/4 file://E:\whsy\whsy09.htm 2008-4-22