
原电池电动势的测定 页码,1/5 原电池电动势的测定 一,实验目的 1理解电极、电池、电极电势、电池电势、可逆电池电动势等概念 2.学会一些电极的制作和处理方法。 3.学会电位差计、直流复射式检流计的使用。掌握对消法(补偿法)测定可逆电池电动势的原理 和操作方法。 二.实验原理 1.电池和电极 概括地说,电化学是研究电池的科学。电池是使化学能与电能互相转化的装置,通常分为自发 电池(又称原电池)和电解电池两大类。电池的主要组成部分是电板,电板是由金属《电子号体 及与它紧密接触的电解质(离子导体)构成,如钢电极Cu/Cu2+,锌电极ZZn2+等。电极结构中金 属对于电解质的电位递降值△p=中金属一电解质称为电极电势。因△中不能直接测量,故电极电势 的绝对数值无法确定,现选用标准氢电极的电势为基准来衡量比较各电极的电势,得到的相对数值 称为氢标电极电势 “氢标 二字通常省略不 两个不同的电极组成电池,二电极电势之差称为电池电势(即电压)。联结二极管的金属端使 电池形成回路,产生电流。此时电极界面上必有核电粒子(离子或电子)作跨越界面的传递,从而 发生氧化还原反应一一电极反应。二电极反应的总效果为电池反应。 可逆电极、可逆电池与可逆电池电动势 2。可逆电极是指电极反应为可逆的电极。具体地说,电极界面通过正向微电流所产生的效应在逆 向微电流通过时能完全消除,电极反应随时处于平衡状态。此时的电极电势称为平衡电势。同样, 可逆电池内发生的所有过程都应是可逆的,随时处于平衡状态。因此,构成可逆电池的条件是:电 极必须是可逆的:电池内部应当不存在液体接界:通过电池的电流应无限小。可道电池电势习惯上 称为电动势。可逆电极和可逆电池的电势可用能斯特公式计算。 本实验所研究的丹聂尔电池常被引用为可逆电池的实际例子,它由铜、锌两个可逆电池组成, 电池反应Zn+CSO,一ZnSO,+C1可逆进行,但电池内部存在液体接界CSO,/ZnSO, 界面的电荷迁移不可逆:正向反应时主要是Z2+迁移到CuS0,溶液,逆向反应时主要是Cu+迁移到 ZS0,溶液。所以只能把丹聂尔电池近似地看成可逆。真正可逆电池的典型例子可举出哈纳德电 池,它是由氢电极同某种可逆电极组成的无液体接界电池,例如: (-)PH2(气)HCI(水溶液4gCAg(+) 它在电解质溶液理论和电化学热力学的研究中有广泛的应用。我们将在另一实验中加以研究 3.补偿法(对消法)测定电动势的原理 可逆电池的一个必要条件是通过电池的电流无限小。 file://E:\whsy\whsy01.htm 2008-4-22
原电池电动势的测定 一.实验目的 1. 理解电极、电池、电极电势、电池电势、可逆电池电动势等概念。 2. 学会一些电极的制作和处理方法。 3. 学会电位差计、直流复射式检流计的使用。掌握对消法(补偿法)测定可逆电池电动势的原理 和操作方法。 二.实验原理 1.电池和电极 概括地说,电化学是研究电池的科学。电池是使化学能与电能互相转化的装置,通常分为自发 电池(又称原电池)和电解电池两大类。电池的主要组成部分是电极,电极是由金属(电子导体) 及与它紧密接触的电解质(离子导体)构成,如铜电极Cu/Cu2+,锌电极Zn/Zn2+等。电极结构中金 属对于电解质的电位递降值 称为电极电势。因 不能直接测量,故电极电势 的绝对数值无法确定,现选用标准氢电极的电势为基准来衡量比较各电极的电势,得到的相对数值 称为氢标电极电势,“氢标”二字通常省略不写。 两个不同的电极组成电池,二电极电势之差称为电池电势(即电压)。联结二极管的金属端使 电池形成回路,产生电流。此时电极界面上必有核电粒子(离子或电子)作跨越界面的传递,从而 发生氧化还原反应——电极反应。二电极反应的总效果为电池反应。 可逆电极、可逆电池与可逆电池电动势 2.可逆电极是指电极反应为可逆的电极。具体地说,电极界面通过正向微电流所产生的效应在逆 向微电流通过时能完全消除,电极反应随时处于平衡状态。此时的电极电势称为平衡电势。同样, 可逆电池内发生的所有过程都应是可逆的,随时处于平衡状态。因此,构成可逆电池的条件是:电 极必须是可逆的;电池内部应当不存在液体接界;通过电池的电流应无限小。可逆电池电势习惯上 称为电动势。可逆电极和可逆电池的电势可用能斯特公式计算。 本实验所研究的丹聂尔电池常被引用为可逆电池的实际例子,它由铜、锌两个可逆电池组成, 电池反应 可逆进行,但电池内部存在液体接界 , 界面的电荷迁移不可逆:正向反应时主要是Zn2+迁移到CuSO4溶液,逆向反应时主要是Cu2+迁移到 ZnSO4溶液。所以只能把丹聂尔电池近似地看成可逆。真正可逆电池的典型例子可举出哈纳德电 池,它是由氢电极同某种可逆电极组成的无液体接界电池,例如: 它在电解质溶液理论和电化学热力学的研究中有广泛的应用。我们将在另一实验中加以研究。 3.补偿法(对消法)测定电动势的原理 可逆电池的一个必要条件是通过电池的电流无限小。 ∆φ = φ 金属-φ电解质 ∆φ Zn + CuSO4 ZnSO + Cu 4 4 4 CuSO / ZnSO ( ) ( ) ( ) ( ) − Pt H2 气 HCl 水溶液 AgCl Ag + 原电池电动势的测定 页码,1/5 file://E:\whsy\whsy01.htm 2008-4-22

原电池电动势的测定 页码,2/5 测定电动势时不应有电流通过。电位差计能满足这个要求。电位差计的原理如图所示。图的上 部是工作回路,E为工作电源,【是调节工作电流1的变阻器,工作电流通过R和R、产生电位降作补偿 (对消)用。图的左下部是标准回路,E、是标准电池,其电势十分稳定: Ex=1.01859-4.06×10-5u-20) 式中,t为环境温度:G为灵敏检流计,用来指示电流零点:R、为标准电池的补偿电阻,它与工作电 流之乘积IR、恰等于标准电池电动势E、。因型电位差计的工作电流规定为0.0001安培,故R、应确定 En 在000P处将选择开关合在位置“1”,调节r使G指零,1R与5、对消,此时1必为001A 图的右下部是测量回路,EX是被测电池电动势,R是被测电池的补偿电阻,由已知电阻值的各进位 盘组成,将选择开关合在位置“2”,旋转R各进位盘,调到C点使G指零,Rc与Ex对消。这样有关 系式: Ex=IR 1=Ex ,=风是= 可知电位差计是一种比例仪器,将已知电势Ev乘以一个比例系数K来补偿未知电动势Ex-KEN,所 以用电位差计测量电动势的方法称为补偿法或对消法。 三.仪器与试剂 UJ-25型电位差计1台:直流复射式检流计1台:锌锰干电池2支:甘汞电极(饱和)1支:铜电 极、锌电极各1支:盐桥1支:醌氢醌(二级):硫酸铜(二级):硫酸锌(二级):邻苯二甲酸氢 钾(二级):销酸(二级)。 四.实验步骤 电极的制作 (1)醒氢醌(Q-HQ)电极 取一支铂电极,用6moln的硝酸浸泡5min,用水冲洗,去离子水洗涤,用滤纸吸干。在小烧杯 中放入约15ml待测的pH溶液(0.05mo/L邻苯二甲酸氢钾水溶液或酒石酸氢钾饱和水溶液),用小匙 取少量配氢程固体放入溶液中,橙拌溶解制成饱和溶液,呈深湖伍,并有不溶解的制余强氢翻固 体。插入铂电极。醒氢醒是醒与氢醒的等分子化合物,溶解后成为氧化(醌)还原(氢醒)电极 是一种氢离子指示电极: (2)锌电极和钢电极 将锌(或铜)棒用砂皮擦亮,用水和去离子水冲洗,用滤纸吸干: (3)甘汞申极(的和) 浸在饱和KCI溶液中。 2.电池的制作 电池D,gs,C,KC(饱和水溶液H(待测№-HP 将醒氢醒电极与饱和甘汞电极组合成电池,氢醒电极为正极,甘汞电极为负极。 fi】 ://E:\whsy\whsy01.htm 2008-4-22
测定电动势时不应有电流通过。电位差计能满足这个要求。电位差计的原理如图所示。图的上 部是工作回路,E为工作电源,r是调节工作电流I的变阻器,工作电流通过R和RN产生电位降作补偿 (对消)用。图的左下部是标准回路,EN是标准电池,其电势十分稳定: 式中,t为环境温度;G为灵敏检流计,用来指示电流零点;RN为标准电池的补偿电阻,它与工作电 流之乘积IRN恰等于标准电池电动势EN。因型电位差计的工作电流规定为0.0001安培,故RN应确定 在 处。将选择开关合在位置“1”,调节r使G指零,IRN与EN对消,此时I必为0.0001A。 图的右下部是测量回路,EX是被测电池电动势,R是被测电池的补偿电阻,由已知电阻值的各进位 盘组成,将选择开关合在位置“2”,旋转R各进位盘,调到C点使G指零,IRC与EX对消。这样有关 系式: 可知电位差计是一种比例仪器,将已知电势EN乘以一个比例系数K来补偿未知电动势EX=KEN,所 以用电位差计测量电动势的方法称为补偿法或对消法。 三.仪器与试剂 UJ-25型电位差计1台;直流复射式检流计1台;锌锰干电池2支;甘汞电极(饱和)1支;铜电 极、锌电极各1支;盐桥1支;醌氢醌(二级);硫酸铜(二级);硫酸锌(二级);邻苯二甲酸氢 钾(二级);硝酸(二级)。 四.实验步骤 1.电极的制作 (1)醌氢醌(Q-HQ)电极 取一支铂电极,用6mol/L的硝酸浸泡5min,用水冲洗,去离子水洗涤,用滤纸吸干。在小烧杯 中放入约15ml待测的pH溶液(0.05mol/L邻苯二甲酸氢钾水溶液或酒石酸氢钾饱和水溶液),用小匙 取少量醌氢醌固体放入溶液中,搅拌溶解制成饱和溶液,呈深褐色,并有不溶解的剩余醌氢醌固 体。插入铂电极。醌氢醌是醌与氢醌的等分子化合物,溶解后成为氧化(醌)还原(氢醌)电极, 是一种氢离子指示电极; (2)锌电极和铜电极 将锌(或铜)棒用砂皮擦亮,用水和去离子水冲洗,用滤纸吸干; (3)甘汞电极(饱和) 浸在饱和KCl溶液中。 2.电池的制作 电池(1): 将醌氢醌电极与饱和甘汞电极组合成电池,醌氢醌电极为正极,甘汞电极为负极。 EN 1.01859 4.06 10 (t 20)V 5 = − × − − Ω 0.0001 En N N E = IR N N R E I = N N N C X C E KE R R E = IR = = Hg Hg Cl KCl H Q − HQ Pt + ( ) ( ) 2 2 饱和水溶液 待测 原电池电动势的测定 页码,2/5 file://E:\whsy\whsy01.htm 2008-4-22
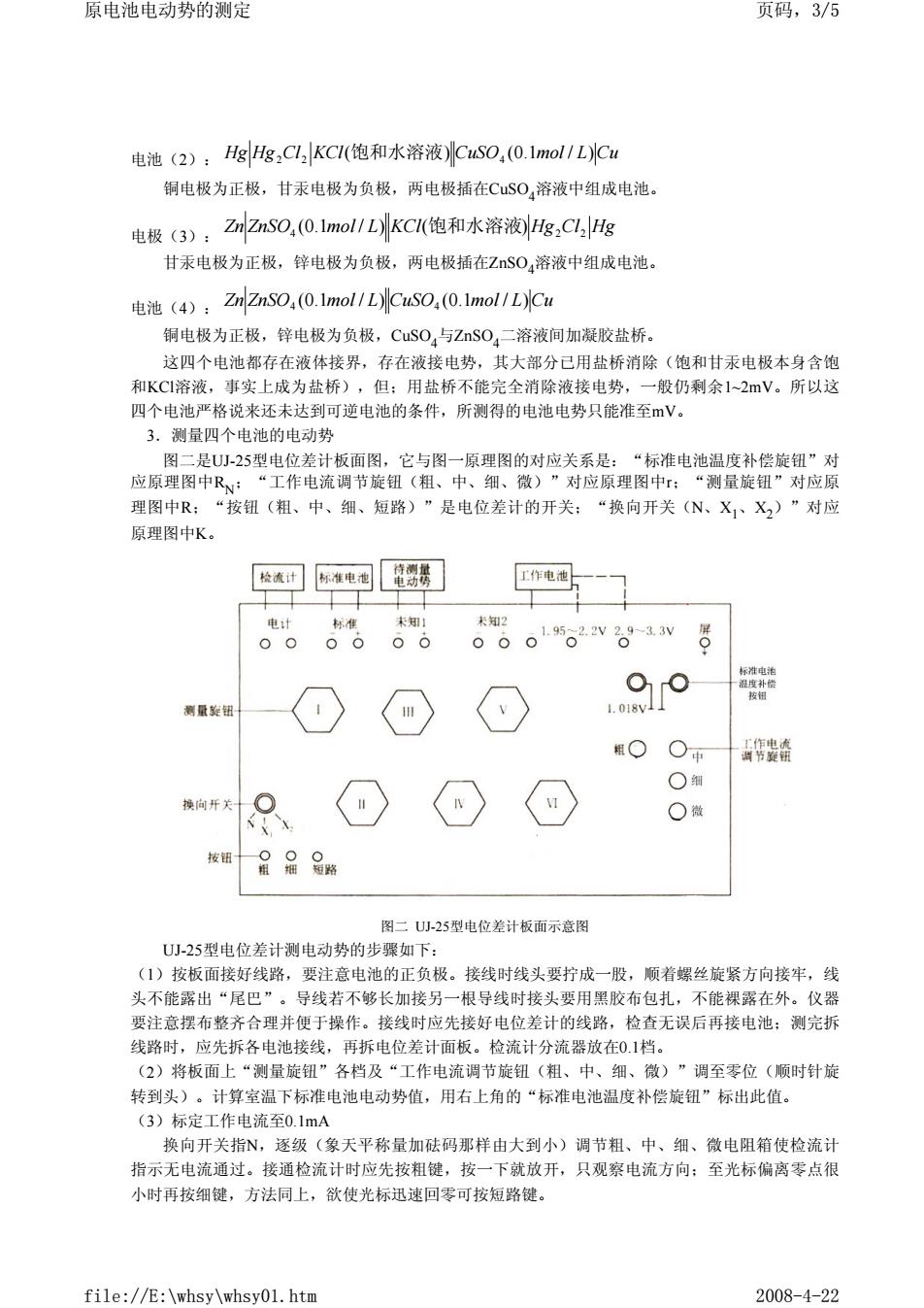
原电池电动势的测定 页码,3/5 电池(2):HgHg,C1,KC1(饱和水溶液)CSO,(0.1mol1LCu 铜电极为正极,甘汞电极为负极,两电极插在CSO,溶液中组成电池, 电极3),Z2sO.(0.1mol1LKC(饱和水溶液Hg,C,e 甘汞电极为正极,锌电极为负极,两电极插在ZS0,溶液中组成电池 电港(4,2忆ns0.0.1mol/LC0,0.1mol1LC 铜电极为正极,锌电极为负极,CuS0,与ZS0,二溶液间加凝胶盐桥。 这四个电池都存在液体接界,存在液接电势,其大部分已用盐桥消除(饱和甘汞电极本身含饱 和KCI溶液,事实上成为盐桥),但:用盐桥不能完全消除液接电势,一般仍剩余1~2mV。所以这 四个电池严格说来还未达到可逆电池的条件,所测得的电池电势只能准至mV。 3.测量四个电池的电动势 图一是[山25型申位差计板面图。应与图一原理图的对应关系是,“标准申池温度补旋钮”对 应原理图中R,: “工作电流调节旋钮(粗、中、细、微)”对应原理图中:“测量旋钮”对应原 理图中R: “按钮(粗、中、细、短路)”是电位差计的开关: “换向开关(N、X1、X2)”对应 原理图中K。 检流订际准电酒笔翻琴】 工作电迪 未知2 。0015.2w。1w8 衡最装钮 特搜 ○细 ○微 按日品品路 图二U-25型电位差计板面示意图 U小-25型电位差计测电动势的步如下 (1)按板面接好线路,要注意电池的正负极。接线时线头要拧成一股,顺着螺丝旋紧方向接牢,线 头不能露出“尾巴”。导线若不够长加接另一根导线时接头要用黑胶布包扎,不能裸露在外。仪器 要注意摆布整齐合理并便于操作。接线时应先接好电位差计的线路,检查无误后再接电池:测完拆 线路时,应先拆各电池接线,再拆电位差计面板。检流计分流器放在01挡。 (2)将板面上“测量旋钮”各档及“工作电流调节旋钮(粗、中、细、微)”调至零位(顺时针旋 转到头)。计算室温下标准电池电动势值,用右上角的“标淮电池温度补偿旋钮”标出此值。 (3)标定工作电流至0.1mA 换向开关指N,逐级(象天平称量加砝码那样由大到小)调节粗、中、细、微电阻箱使检流计 指示无电流通过。接通检流计时应先按粗键,按一下就放开,只观察电流方向:至光标偏离零点很 小时再按细键,方法同上,欲使光标迅速回零可按短路键, file://E:\whsy\whsy01.htm 2008-4-22
电池(2): 铜电极为正极,甘汞电极为负极,两电极插在CuSO4溶液中组成电池。 电极(3): 甘汞电极为正极,锌电极为负极,两电极插在ZnSO4溶液中组成电池。 电池(4): 铜电极为正极,锌电极为负极,CuSO4与ZnSO4二溶液间加凝胶盐桥。 这四个电池都存在液体接界,存在液接电势,其大部分已用盐桥消除(饱和甘汞电极本身含饱 和KCl溶液,事实上成为盐桥),但;用盐桥不能完全消除液接电势,一般仍剩余1~2mV。所以这 四个电池严格说来还未达到可逆电池的条件,所测得的电池电势只能准至mV。 3.测量四个电池的电动势 图二是UJ-25型电位差计板面图,它与图一原理图的对应关系是:“标准电池温度补偿旋钮”对 应原理图中RN;“工作电流调节旋钮(粗、中、细、微)”对应原理图中r;“测量旋钮”对应原 理图中R;“按钮(粗、中、细、短路)”是电位差计的开关;“换向开关(N、X1、X2)”对应 原理图中K。 图二 UJ-25型电位差计板面示意图 UJ-25型电位差计测电动势的步骤如下: (1)按板面接好线路,要注意电池的正负极。接线时线头要拧成一股,顺着螺丝旋紧方向接牢,线 头不能露出“尾巴”。导线若不够长加接另一根导线时接头要用黑胶布包扎,不能裸露在外。仪器 要注意摆布整齐合理并便于操作。接线时应先接好电位差计的线路,检查无误后再接电池;测完拆 线路时,应先拆各电池接线,再拆电位差计面板。检流计分流器放在0.1档。 (2)将板面上“测量旋钮”各档及“工作电流调节旋钮(粗、中、细、微)”调至零位(顺时针旋 转到头)。计算室温下标准电池电动势值,用右上角的“标准电池温度补偿旋钮”标出此值。 (3)标定工作电流至0.1mA 换向开关指N,逐级(象天平称量加砝码那样由大到小)调节粗、中、细、微电阻箱使检流计 指示无电流通过。接通检流计时应先按粗键,按一下就放开,只观察电流方向;至光标偏离零点很 小时再按细键,方法同上,欲使光标迅速回零可按短路键。 Hg Hg Cl KCl( ) CuSO (0.1mol / L)Cu 2 2 饱和水溶液 4 Zn ZnSO4 (0.1mol / L) KCl(饱和水溶液) Hg2Cl2 Hg Zn ZnSO4 (0.1mol / L) CuSO4 (0.1mol / L)Cu 原电池电动势的测定 页码,3/5 file://E:\whsy\whsy01.htm 2008-4-22

原电池电动势的测定 页码,4/5 (4)测定电池电动势 换向开关指X,或X2,由大到小调节测量旋钮使检流计指示无电流通过,旋钮示值就是电池电动 势。如此,标定一测量一再标定一再测量,直至稳定值。 五.数据处理 电池(1)反应为: C.H2O2+2Hg+2H++2Cl Hg2Cl+CHa(OH) 电池电动势等于二可逆电极电势之差,用能斯特公式表示为: E=e-E=6地+23031gan-5R 其中,E8e=0.6994-0.000741-25)P Et*=0.2415-0.00076(1-25)W 因plH=一lgar,得: pH=Foug-Evs- 2.303RT F 电池(2)反应为: 2Hg+2Cr+Cu2+=Hg,Cl+Cu E:EE+2.303RT gdo 2F 得 5=,+E-201g4 2F 电池(3)反应为: Hg,Cl+Zn2Hg+Zn2++2Cr E3=E甘表-E2*1a 2303RT@ 2F 得: =5-,-2303ga 2F 电池(4)反应为: Zn+Cu2+Cu +Zn2+ fi1e://E:\whsy\whsy01.htm 2008-4-22
(4)测定电池电动势 换向开关指X1或X2,由大到小调节测量旋钮使检流计指示无电流通过,旋钮示值就是电池电动 势。如此,标定-测量-再标定-再测量,直至稳定值。 五.数据处理 电池(1)反应为: C6H4O2+2Hg+2H++2Cl- Hg2Cl2+C6H4(OH)2 电池电动势等于二可逆电极电势之差,用能斯特公式表示为: 其中, 因pH=- ,得: 电池(2)反应为: 2Hg+2Cl- +Cu2+ Hg2Cl2+Cu 得 电池(3)反应为: Hg2Cl2+Zn 2Hg+Zn2++2Cl- 得: 电池(4)反应为: Zn+ Cu2+ Cu +Zn2+ = 甘汞= E甘汞 F RT E E E E Q HQ Q HQ H − + + − Φ lgα 2.303 1 / / EQ / HQ = 0.6994 − 0.00074(t − 25)V Φ E甘汞=0.2415 − 0.00076(t − 25)V + H lgα F RT E E E pH Q HQ 2.303 / − − 1 = Φ 甘汞 = + − + Φ 2 lg 2 2 2.303 2 Cu / Cu Cu F RT E E E甘汞+ α + = + − + Φ 2 lg 2 2 2.303 Cu / Cu 2 Cu F RT E E E甘汞 α = − + − + Φ 2 lg 2 2 2.303 3 Zn / Zn Zn F RT E E甘汞 E α + = − − + Φ 2 lg 2 2 2.303 Zn / Zn 3 Zn F RT E E甘汞 E α 原电池电动势的测定 页码,4/5 file://E:\whsy\whsy01.htm 2008-4-22

原电池电动势的测定 页码,5/5 6=。-22 2F E路o-Bg=5,+2303RT1g%22 2F dce 式中,E810-E12为丹聂尔电池的标准电动势。 上述各式中: a2.=rC=0.15×0.1=0.015mol/L ac=rC=0.16×0.1-0.016mol1L 所求各物理量的文献值(25℃)为: E8·1o=0.337V E1=-0.763Y E为东=1.100 .05mol/L邻苯二甲酸氢钾pH=4.005 六.思考题 1.补偿法测定电池电动势的装置中,电位差计、工作电源、标准电池和检流计各起什么作用? 如何使用和维护标准电池及检流计? 2.测量过程中,若检流计光点总往一个方向偏转,可能是哪些原因引起的? 3.测定电动势时为何要用盐桥? 参考文献: [1]周伟舫主编,《电化学测量》,上海科学技术出版社(1985)。 [2]B.P.Levitt,Findlay's Practical Physical Chemistry,9th ed.,Longman Group Ltd.,London (1973)。 [3]傅献彩,沈文霞,姚天扬编,《物理化学》,下册,第四版,高等教有出版社(1990)。 [4]杨文治,电化学基础,北京大学出版社(1982)。 file://E:\whsy\whsy01.htm 2008-4-22
得 式中, 为丹聂尔电池的标准电动势。 上述各式中: 所求各物理量的文献值(25℃)为: 0.05mol/L邻苯二甲酸氢钾pH=4.005 六.思考题 1.补偿法测定电池电动势的装置中,电位差计、工作电源、标准电池和检流计各起什么作用? 如何使用和维护标准电池及检流计? 2.测量过程中,若检流计光点总往一个方向偏转,可能是哪些原因引起的? 3.测定电动势时为何要用盐桥? 参考文献: [1]周伟舫主编,《电化学测量》,上海科学技术出版社(1985)。 [2]B.P.Levitt, Findlay’s Practical Physical Chemistry, 9th ed., Longman Group Ltd., London (1973)。 [3]傅献彩,沈文霞,姚天扬编,《物理化学》,下册,第四版,高等教育出版社(1990)。 [4]杨文治,电化学基础,北京大学出版社(1982)。 + + = + − + − Φ Φ 2 2 2 2 lg 2 2.303 4 / / Cu Zn Cu Cu Zn Zn F RT E E E α α + + + − + = + Φ Φ 2 2 2 2 lg 2 2.303 / / 4 Cu Zn Cu Cu Zn Zn F RT E E E α α Φ Φ + − + Cu Cu Zn Zn E E / / 2 2 r C mol L Zn2 = = 0.15× 0.1 = 0.015 / α + ± r C mol L Cu2 = = 0.16 × 0.1 = 0.016 / α + ± E V Cu Cu 0.337 / 2 = Φ + E V Zn Zn 0.763 / 2 = − Φ + E丹聂尔=1.100V Φ 原电池电动势的测定 页码,5/5 file://E:\whsy\whsy01.htm 2008-4-22