
燃烧热的测定 页码,1/4 燃烧热的测定 一.实验目的 1.用氧弹式热量计测定萘的燃烧热: 2.了解量热法的基本原理,掌握用量热法测定燃烧热的实验方法 3.了解氧气钢瓶的操作规程。 二.实验原理 燃烧热是指1am(101.325kPa)和一定温度下1mol可燃烧物质完全燃烧时放出的热量。测定燃 烧热一般使用量热法,其基本原理是样品燃烧所放出的热量Q全部由量热体系(图一中内筒以内的 部分,主要是一定数量的水)所吸收,Q-C△T。式中,△T是体系吸热后的温度升高:C为体系的 热容,由燃烧一定量的标准物质来标定。标准物质(一般采用苯甲酸,下标记为“1”)完全燃烧后 0 放的0,是已知的定△可得C一是,在相月尖验条作下定一定量的特物质 (本实验为萘,计为“2”)完全燃烧后体系温度的升高△工:可算得放出的热量为 =C6工:=O△了因燃烧反应是在氧弹中恒容下进行的(图二)所以测得的热是恒容热 待测物质的量归一成1ml(乘上因子m,,m为待测物质的质量,M为摩尔质量)就是摩尔恒容 热。根据下式换算为摩尔恒压热,就是所求之燃烧热。 AH =(:)2=(:)y +A(PV)=(:)v+RTAn 设反应中的气体为理想气体并忽略周体或液体的体积,△为1mol待测物质完全燃烧后气体组分物 质的量的增量。对于萘的燃烧反应△n=一2。 由上述原理可知,要准确测定样品的燃烧热,必须做到: (1)准确称量样品并防止损失: (2)样品完全燃烧 (3)减少量热体系与环境的热交换 (4)准确测定量热体系的温度变化。 三.仪器与试剂 氧弹式热最计1套:压片机4台(公用):微机智能测温系统1套:氧气锅瓶与充氧机1套(公 用):燃烧铁丝:苯甲酸(二级品):萘(二级品) 四.实验步骤 1.熟悉热量计的构造。 整套仪器如图一所示。内筒以内的部分为量热体系,主要是一定数量的水和燃烧用的氧弹。 内筒外面有一空气绝热层,内筒由绝热垫片4架起,上方有绝热胶板5覆盖,减少传热与水分蒸发 同时,仪器的外套1内可灌入与体系温度相近的水。为使量热体系温度很快达到均匀,装有搅拌器 10,由马达6带动。为防止通过搅拌棒传热,金属搅拌棒上端用绝热良好的塑料与马达传动装置连 接。体系的温度变化是用贝克曼温度计测量的,本实验用微机智能系统代替贝克曼温度计,测温精 度0.01℃能满足一般实验的要求。样品的燃烧点火由微机程序控制。图二是氧弹的构造。氧弹是用 不锈钢制成的,主要部分有厚壁圆筒1,弹盖2和螺帽3紧密相连:在弹盖2上装有用来充入氧气的进 气孔4、排气孔5和电极6,电极直通弹体内部,同时作为燃烧皿7的支架;为了将火焰反射向下而使 i //E:\whsy\whsy06.htm 2008-4-22
燃烧热的测定 一.实验目的 1.用氧弹式热量计测定萘的燃烧热; 2.了解量热法的基本原理,掌握用量热法测定燃烧热的实验方法; 3.了解氧气钢瓶的操作规程。 二.实验原理 燃烧热是指1atm(101.325kPa)和一定温度下1mol可燃烧物质完全燃烧时放出的热量。测定燃 烧热一般使用量热法,其基本原理是样品燃烧所放出的热量Q全部由量热体系(图一中内筒以内的 部分,主要是一定数量的水)所吸收,Q=C△T。式中,△T是体系吸热后的温度升高;C为体系的 热容,由燃烧一定量的标准物质来标定。标准物质(一般采用苯甲酸,下标记为“1”)完全燃烧后 放出的热量Q1是已知的,测定△T1可算得 ,在相同实验条件下测定一定量的待测物质 (本 实 验 为 萘,计 为 “2”)完 全 燃 烧 后 体 系 温 度 的 升 高 △T2,可 算 得 放 出 的 热 量 为 。因燃烧反应是在氧弹中恒容下进行的(图二)所以测得的热是恒容热。将 待测物质的量归一成1mol(乘上因子 ,m2为待测物质的质量,M为摩尔质量)就是摩尔恒容 热。根据下式换算为摩尔恒压热,就是所求之燃烧热。 设反应中的气体为理想气体并忽略固体或液体的体积,△n为1mol待测物质完全燃烧后气体组分物 质的量的增量。对于萘的燃烧反应△n=-2。 由上述原理可知,要准确测定样品的燃烧热,必须做到: (1) 准确称量样品并防止损失; (2) 样品完全燃烧; (3) 减少量热体系与环境的热交换; (4) 准确测定量热体系的温度变化。 三.仪器与试剂 氧弹式热量计1套;压片机4台(公用);微机智能测温系统1套;氧气钢瓶与充氧机1套(公 用);燃烧铁丝;苯甲酸(二级品);萘(二级品)。 四.实验步骤 1. 熟悉热量计的构造。 整套仪器如图一所示。内筒以内的部分为量热体系,主要是一定数量的水和燃烧用的氧弹。 内筒外面有一空气绝热层,内筒由绝热垫片4架起,上方有绝热胶板5覆盖,减少传热与水分蒸发。 同时,仪器的外套1内可灌入与体系温度相近的水。为使量热体系温度很快达到均匀,装有搅拌器 10,由马达6带动。为防止通过搅拌棒传热,金属搅拌棒上端用绝热良好的塑料与马达传动装置连 接。体系的温度变化是用贝克曼温度计测量的,本实验用微机智能系统代替贝克曼温度计,测温精 度0.01℃能满足一般实验的要求。样品的燃烧点火由微机程序控制。图二是氧弹的构造。氧弹是用 不锈钢制成的,主要部分有厚壁圆筒1,弹盖2和螺帽3紧密相连;在弹盖2上装有用来充入氧气的进 气孔4、排气孔5和电极6,电极直通弹体内部,同时作为燃烧皿7的支架;为了将火焰反射向下而使 ∆T1 = Q C 1 2 2 2 1 T T Q C T Q ∆ ∆ = ∆ = m2 M ∆Hm = (Q2 ) P = (Q2 )V + ∆(PV) = (Q2 )V + RT∆n 燃烧热的测定 页码,1/4 file://E:\whsy\whsy06.htm 2008-4-22

燃烧热的侧定 页码,2/4 弹体温度均匀,在另一电极8(同时也是进气管)的上方还装有火焰遮板9。 n nn 图一氧弹式量热计 图二氧弹的构造 2.按图一组装热量计并将搅拌马达电源插头插到控制台的相应插口上,用手转动搅拌器调整到 不与内筒相碰。接通微机智能测温系统。 3.测定量热体系的热容,记录标准样品苯甲酸的燃烧曲线。 (1)压片 粗称约1g的标准样品苯甲酸,用压片机压成片,刷去片上和边缘的浮纷,用分析天平称准至 0.0001 2)装样 旋开氧弹的弹盖放在支架上,将盛有苯甲酸片的坩锅固定在坩锅架上,再将一根长为10©m的燃 烧丝的两端固定在两个电极的螺杆上,其中段放在苯甲酸片上,注意点火线勿接触坩锅。将弹盖与 弹筒旋条, 充以1500至200kPa(15一20atm)的氧气,试漏(将整个氧弹浸没水中看有无气泡逸 出)。将氧弹放入内筒靠近搅拌器的护罩处,倒入比室温1℃的3000ml自来水,盖好胶板5,将微机 智能测温系统的温度传感器插入内筒的水中。注意不要与氧弹和内筒壁接触。 (3)样品设置及实验 打开多功能控制箱和电脑,进入测温系统,进行参数设置。开始实验,计算机自动点火,测温 系统每自动记录一个数据。 实验结束后,从热量计中取出氧弹,用放气帽缓缓压下放气阀,在1分钟左右放尽气体,拧开并 取下氧弹盖,量出未燃完的燃烧丝的长度,计算实际消耗的重量。随后仔细检查氧弹,如弹中有烟 黑或未燃尽的试样微粒,此实验失败。 4待测样品装的燃烧曲线的测定 按步骤3同样的方法测定萘的燃烧曲线 萘粗称0.75g,实验条件应与苯甲酸燃烧曲线尽量一致。 5.燃烧曲线的分析- 一雷诺图的说明 由于热量计中量热体系与环境的热交换无法完全避免,这种情况对温度测量值的影响可从燃烧 曲线进行校正。由于这种校正方法最先由雷诺(Renolds)提出,故燃烧曲线又称雷诺图。 上术苯甲酸和装的质量分别为1g和075g,它们燃烧后放出的执量使3000ml水升温约2℃。实验 前预先调节水温低至室温1℃,实验得到的燃烧曲线如图三。 图中H点表示燃烧开始,热量传入水 file://E:\whsy\whsy06.htm 2008-4-22
弹体温度均匀,在另一电极8(同时也是进气管)的上方还装有火焰遮板9。 2.按图一组装热量计并将搅拌马达电源插头插到控制台的相应插口上,用手转动搅拌器调整到 不与内筒相碰。接通微机智能测温系统。 3.测定量热体系的热容,记录标准样品苯甲酸的燃烧曲线。 (1)压片 粗称约1g的标准样品苯甲酸,用压片机压成片,刷去片上和边缘的浮纷,用分析天平称准至 0.0001g。 (2)装样 旋开氧弹的弹盖放在支架上,将盛有苯甲酸片的坩锅固定在坩锅架上,再将一根长为10cm的燃 烧丝的两端固定在两个电极的螺杆上,其中段放在苯甲酸片上,注意点火线勿接触坩锅。将弹盖与 弹筒旋紧,充以1500至2000kPa(15~20atm)的氧气,试漏(将整个氧弹浸没水中看有无气泡逸 出)。将氧弹放入内筒靠近搅拌器的护罩处,倒入比室温1℃的3000ml自来水,盖好胶板5,将微机 智能测温系统的温度传感器插入内筒的水中。注意不要与氧弹和内筒壁接触。 (3)样品设置及实验 打开多功能控制箱和电脑,进入测温系统,进行参数设置。开始实验,计算机自动点火,测温 系统每自动记录一个数据。 实验结束后,从热量计中取出氧弹,用放气帽缓缓压下放气阀,在1分钟左右放尽气体,拧开并 取下氧弹盖,量出未燃完的燃烧丝的长度,计算实际消耗的重量。随后仔细检查氧弹,如弹中有烟 黑或未燃尽的试样微粒,此实验失败。 4.待测样品萘的燃烧曲线的测定 按步骤3同样的方法测定萘的燃烧曲线。萘粗称0.75g,实验条件应与苯甲酸燃烧曲线尽量一致。 5.燃烧曲线的分析——雷诺图的说明 由于热量计中量热体系与环境的热交换无法完全避免,这种情况对温度测量值的影响可从燃烧 曲线进行校正。由于这种校正方法最先由雷诺(Renolds)提出,故燃烧曲线又称雷诺图。 上述苯甲酸和萘的质量分别为1g和0.75g,它们燃烧后放出的热量使3000ml水升温约2℃。实验 前预先调节水温低至室温1℃,实验得到的燃烧曲线如图三。图中H点表示燃烧开始,热量传入水 图一 氧弹式量热计 图二 氧弹的构造 燃烧热的测定 页码,2/4 file://E:\whsy\whsy06.htm 2008-4-22
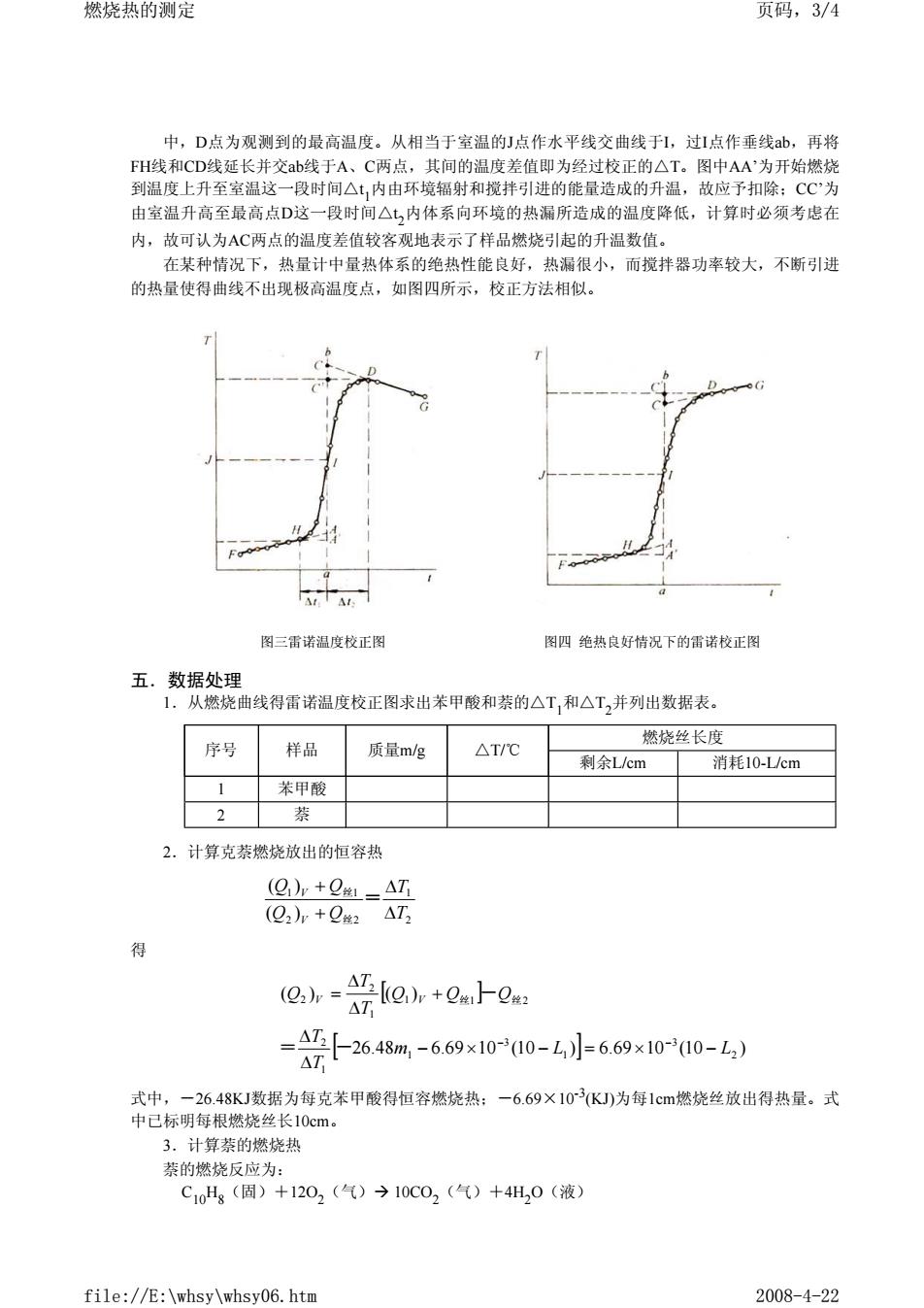
燃烧热的测定 页码,3/4 中,D点为观测到的最高温度。从相当于室温的」点作水平线交曲线于1,过1点作垂线ab,再将 FH线和CD线延长并交ab线于A、C两点,其间的温度差值即为经过校正的△T。图中AA'为开始燃烧 到温度上升至室温这一段时间△1,内由环境辐射和搅拌引进的能量造成的升温,故应予扣除:CC为 由室温升高至最高点D这一段时间△七,内体系向环境的热漏所造成的温度降低,计算时必须考虑在 内,故可认为AC两点的温度差值较客观地表示了样品燃烧引起的升温数值。 在某种情况下,热量计中量热体系的绝热性能良好,热漏很小,而搅拌器功率较大,不断引进 的热量使得曲线不出现极高温度点,如图四所示,校正方法相似。 图三雷诺温度校正图 图四绝热良好情况下的雷诺校正挥 五.数据处理 1.从燃烧曲线得雷诺温度校正图求出苯甲酸和紫的△T,和△T,并列出数据表。 序号 样品 质量m/g △T/C 燃烧丝长度 剩余L/cm 消耗10-Lcm 1 装甲酸 蔡 2.计算克萘燃烧放出的恒容热 ()v +ATi (Q2)+Q △T 得 @h--@h+Qa上e =864-6900-4小6900-4 式中,一26.48KJ数据为每克苯甲酸得恒容燃烧热:一-6.69×103(KJ)为每1cm燃烧丝放出得热量。式 中已标明每根燃烧丝长10cm。 3。计算萘的燃烧热 萘的燃烧反应为: C10H(固)+1202(气)→10C02(气)+4H,0(液) fi】 //E:\whsy\whsy06.htm 2008-4-22
中,D点为观测到的最高温度。从相当于室温的J点作水平线交曲线于I,过I点作垂线ab,再将 FH线和CD线延长并交ab线于A、C两点,其间的温度差值即为经过校正的△T。图中AA’为开始燃烧 到温度上升至室温这一段时间△t 1内由环境辐射和搅拌引进的能量造成的升温,故应予扣除;CC’为 由室温升高至最高点D这一段时间△t 2内体系向环境的热漏所造成的温度降低,计算时必须考虑在 内,故可认为AC两点的温度差值较客观地表示了样品燃烧引起的升温数值。 在某种情况下,热量计中量热体系的绝热性能良好,热漏很小,而搅拌器功率较大,不断引进 的热量使得曲线不出现极高温度点,如图四所示,校正方法相似。 五.数据处理 1.从燃烧曲线得雷诺温度校正图求出苯甲酸和萘的△T1和△T2并列出数据表。 2.计算克萘燃烧放出的恒容热 得 式中,-26.48KJ数据为每克苯甲酸得恒容燃烧热;-6.69×10-3(KJ)为每1cm燃烧丝放出得热量。式 中已标明每根燃烧丝长10cm。 3.计算萘的燃烧热 萘的燃烧反应为: C10H8(固)+12O2(气)Æ 10CO2(气)+4H2O(液) 图三雷诺温度校正图 图四 绝热良好情况下的雷诺校正图 序号 样品 质量m/g △T/℃ 燃烧丝长度 剩余L/cm 消耗10-L/cm 1 苯甲酸 2 萘 2 1 2 2 1 1 ( ) ( ) T T Q Q Q Q V V ∆ ∆ + + = 丝 丝 [ ] [ ] 26.48 6.69 10 (10 ) 6.69 10 (10 ) ( ) ( ) 2 3 1 3 1 1 2 1 1 2 1 2 2 m L L T T Q Q Q T T Q V V − × − = × − ∆ ∆ + ∆ ∆ = = - − − 丝 - 丝 燃烧热的测定 页码,3/4 file://E:\whsy\whsy06.htm 2008-4-22

燃烧热的侧定 页码,4/4 可知n(气)=-2 摩尔恒容热为Or=(Q,)… m,,式中m2为萘的质量,M为萘的摩尔质量128.06gmol。 萘的燃烧热为 AH=On=Qr-2RT 萘的燃烧热的文献值为一5154KJ/mol 六.思考题 1。为什么热量计中内筒的水温应调节到略低于外筒的水温? 2.在标定热容和测定萘燃烧热时,热量计内筒的水量是否可以改变?为什么? 七.参考文献 [1]F.D.Rossini et al.,Selected Values of Chemical Thermodynamic Properties, National Burean of Standards (1952): [2]P.I.American,Selected Values of Properties of Hydrocarbons and Related Compounds,API Research Project (1972); [3]戴维.P.休梅尔等,俞鼎琼、代伟译,物理化学实验(第四版),化工出版社 (1990)。 [4]JonM.怀特,物理化学实验,人民教有出版社(1981)。 file://E:\whsy\whsy06.htm 2008-4-22
可知n(气)=-2 摩尔恒容热为 ,式中m2为萘的质量,M为萘的摩尔质量128.06g/mol。 萘的燃烧热为: 萘的燃烧热的文献值为-5154KJ/mol 六.思考题 1.为什么热量计中内筒的水温应调节到略低于外筒的水温? 2.在标定热容和测定萘燃烧热时,热量计内筒的水量是否可以改变?为什么? 七.参考文献 [1]F.D.Rossini et al., Selected Values of Chemical Thermodynamic Properties, National Burean of Standards (1952); [2]P.I.American, Selected Values of Properties of Hydrocarbons and Related Compounds, API Research Project (1972); [3]戴 维.P.休 梅 尔 等,俞 鼎 琼、廖 代 伟 译,物 理 化 学 实 验(第 四 版),化 工 出 版 社 (1990)。 [4]John M.怀特,物理化学实验,人民教育出版社(1981)。 2 , 2 ( ) m M Qm V Q V = • ∆Hm = Qm,P = Qm,V − 2RT 燃烧热的测定 页码,4/4 file://E:\whsy\whsy06.htm 2008-4-22