
二组分体茶气一液平衡相餐图 页码,1/3 二组分体系气-液平衡相图 一,实验目的 1.根据实验数据绘制恒压下二组分体系的气液相图,理解相图中点、线、面的意义,理解组 分、相和自由度的概念 2.了解和掌握折射仪的原理和使用方法。 二.实验原理 乙醇和环己烷完全互溶,溶液性质与理想溶液相差甚远。相图如图一所示,纵坐标为温度,横 坐标为环己烷的摩尔分数。标准大气压(101.325kPa)下纯乙醇(横坐标为0)和环己烷(横坐标 100%)的沸点分别为78.6和81.5℃。气相线上方为气态,液相线下方为液态 气相线和液相线之间 为气液平衡,二线之交点为最低恒沸点混合物,标准大气压下共沸物的沸点和组成是64.8℃、57% (环己烷摩尔分数)。 35.5 34815 338.15 333. 乙 图一环己烷一乙醉体系的温度一组成相图 二组分气液相图作法如下:用沸点仪(图二)测定乙醇一环己烷各种组成的沸点,用折射仪测 定沸点时气相冷凝液和液相的折射率,根据折射率一组成的标准曲线(图三)用内插法求出气相组 成和液相组成。 file://E:\whsy\whsy05.htm 2008-4-22
二组分体系气-液平衡相图 一.实验目的 1.根据实验数据绘制恒压下二组分体系的气液相图,理解相图中点、线、面的意义,理解组 分、相和自由度的概念; 2.了解和掌握折射仪的原理和使用方法。 二.实验原理 乙醇和环己烷完全互溶,溶液性质与理想溶液相差甚远。相图如图一所示,纵坐标为温度,横 坐标为环己烷的摩尔分数。标准大气压(101.325kPa)下纯乙醇(横坐标为0)和环己烷(横坐标 100%)的沸点分别为78.6和81.5℃。气相线上方为气态,液相线下方为液态,气相线和液相线之间 为气液平衡,二线之交点为最低恒沸点混合物,标准大气压下共沸物的沸点和组成是64.8℃、57% (环己烷摩尔分数)。 图一 环己烷-乙醇体系的温度-组成相图 二组分气液相图作法如下:用沸点仪(图二)测定乙醇-环己烷各种组成的沸点,用折射仪测 定沸点时气相冷凝液和液相的折射率,根据折射率-组成的标准曲线(图三)用内插法求出气相组 成和液相组成。 二组分体系气-液平衡相图 页码,1/3 file://E:\whsy\whsy05.htm 2008-4-22

二组分体系气一液平衡相图 页码,2/3 41 1.39 L.39 1.37 1.3594/ 00.2040.60810 图二沸点仪 图三乙醇一环己烷体系折射率一组成标准曲线图 这样,一个纵坐标(沸点值)对应两个横坐标(气相和液相组成),如图中的X…X,:连接 各点画出气相线和液相线,以纯乙醇、纯环己烷和共沸物为端点连成封闭曲线。 三.仪器与试剂 沸点仪1套:2KVA0~250V自耦调压变压器1台:温度计1支:阿贝折光仪1台:试管与滴管:无 水乙醇(二级):环己烷(二级)。 四。实验步骤 1.测定纯液体(以乙醇为例)的沸点:自沸点仪支管加入20ml无水乙醇。塞紧瓶塞,将加热 丝浸没在液体中,调节温度计水银球一半浸在液体里,一半露于蒸汽中。开启冷凝水,接通电源, 调节变压器电压自零开始缓缓增大(不要超过20V),液体受热升温,加热丝附近气泡逐渐增多 温府计汞柱上升至稳定值,就品沸点,读准至01℃。 2.与此同时另一同学练习折射仪的用法并测定折射仪标尺零点,钠黄光D线(波长589.26m 通过25℃的无水乙醇,折射率应为n°=1.3594(文献值),如果25℃实测值为1.3600,则1.3600 1.3594=0.0006表明标尺零点有正误差,应予校正,校正值△=一0.0006,实验中每次测定应加上 △,此例为减去0.0006。用环己烷(n=1.4326)校正零点也是同样。 3.测定乙醇一环己烷溶液不同组成时的沸点及此时(气液平衡)气、液相的组成。待上述无水 乙醇冷却至近于室温或不烫手时,加1.5m环己烷至无水乙醇中,测定沸点并测沸胯时气、液组成。 再依次加入环己烷2.0、2.0、8.0、10.0、10.0、10.0ml至无水乙醇中,分别测其沸点和气、液相组 成。 4.同法测定环己烷-乙醇不同组成的沸点及其相应的气、液组成。在沸点仪先加入25ml环己 烷,测定沸点,然后依次加入无水乙醇0.5、0.5、0.5、1.0、1.0、2.0、5.0ml,分别测定沸点和气、 液组成。 判断沸点的准则:温度计汞柱上升明显变缓:液体发生大量气泡:蒸汽冷凝得到的液体很快充 满支管。此时一手握住台架,一手扶好台架底座,倾斜沸点仪,将支管中冷凝液倒回液体中(此步 骤简称“回流”),,立即读温度计示值,反复回流数次待温度计示值稳定,就是沸点。 //E:\whsy\whsy05.htm 2008-4-22
这样,一个纵坐标(沸点值)对应两个横坐标(气相和液相组成),如图中的X……X,;连接 各点画出气相线和液相线,以纯乙醇、纯环己烷和共沸物为端点连成封闭曲线。 三.仪器与试剂 沸点仪1套;2KVA0~250V自耦调压变压器1台;温度计1支;阿贝折光仪1台;试管与滴管;无 水乙醇(二级);环己烷(二级)。 四.实验步骤 1.测定纯液体(以乙醇为例)的沸点:自沸点仪支管加入20ml无水乙醇。塞紧瓶塞,将加热 丝浸没在液体中,调节温度计水银球一半浸在液体里,一半露于蒸汽中。开启冷凝水,接通电源, 调节变压器电压自零开始缓缓增大(不要超过20V),液体受热升温,加热丝附近气泡逐渐增多, 温度计汞柱上升至稳定值,就是沸点,读准至0.1℃。 2.与此同时另一同学练习折射仪的用法并测定折射仪标尺零点,钠黄光D线(波长589.26nm) 通过25℃的无水乙醇,折射率应为 =1.3594(文献值),如果25℃实测值为1.3600,则1.3600- 1.3594=0.0006表明标尺零点有正误差,应予校正,校正值△=-0.0006,实验中每次测定应加上 △,此例为减去0.0006。用环己烷( =1.4326)校正零点也是同样。 3.测定乙醇-环己烷溶液不同组成时的沸点及此时(气液平衡)气、液相的组成。待上述无水 乙醇冷却至近于室温或不烫手时,加1.5ml环己烷至无水乙醇中,测定沸点并测沸腾时气、液组成。 再依次加入环己烷2.0、2.0、8.0、10.0、10.0、10.0ml至无水乙醇中,分别测其沸点和气、液相组 成。 4.同法测定环己烷-乙醇不同组成的沸点及其相应的气、液组成。在沸点仪先加入25ml环己 烷,测定沸点,然后依次加入无水乙醇0.5、0.5、0.5、1.0、1.0、2.0、5.0ml,分别测定沸点和气、 液组成。 判断沸点的准则:温度计汞柱上升明显变缓;液体发生大量气泡;蒸汽冷凝得到的液体很快充 满支管。此时一手握住台架,一手扶好台架底座,倾斜沸点仪,将支管中冷凝液倒回液体中(此步 骤简称“回流”),,立即读温度计示值,反复回流数次待温度计示值稳定,就是沸点。 图二 沸点仪 图三 乙醇-环己烷体系折射率-组成标准曲线图 D n D n25 二组分体系气-液平衡相图 页码,2/3 file://E:\whsy\whsy05.htm 2008-4-22
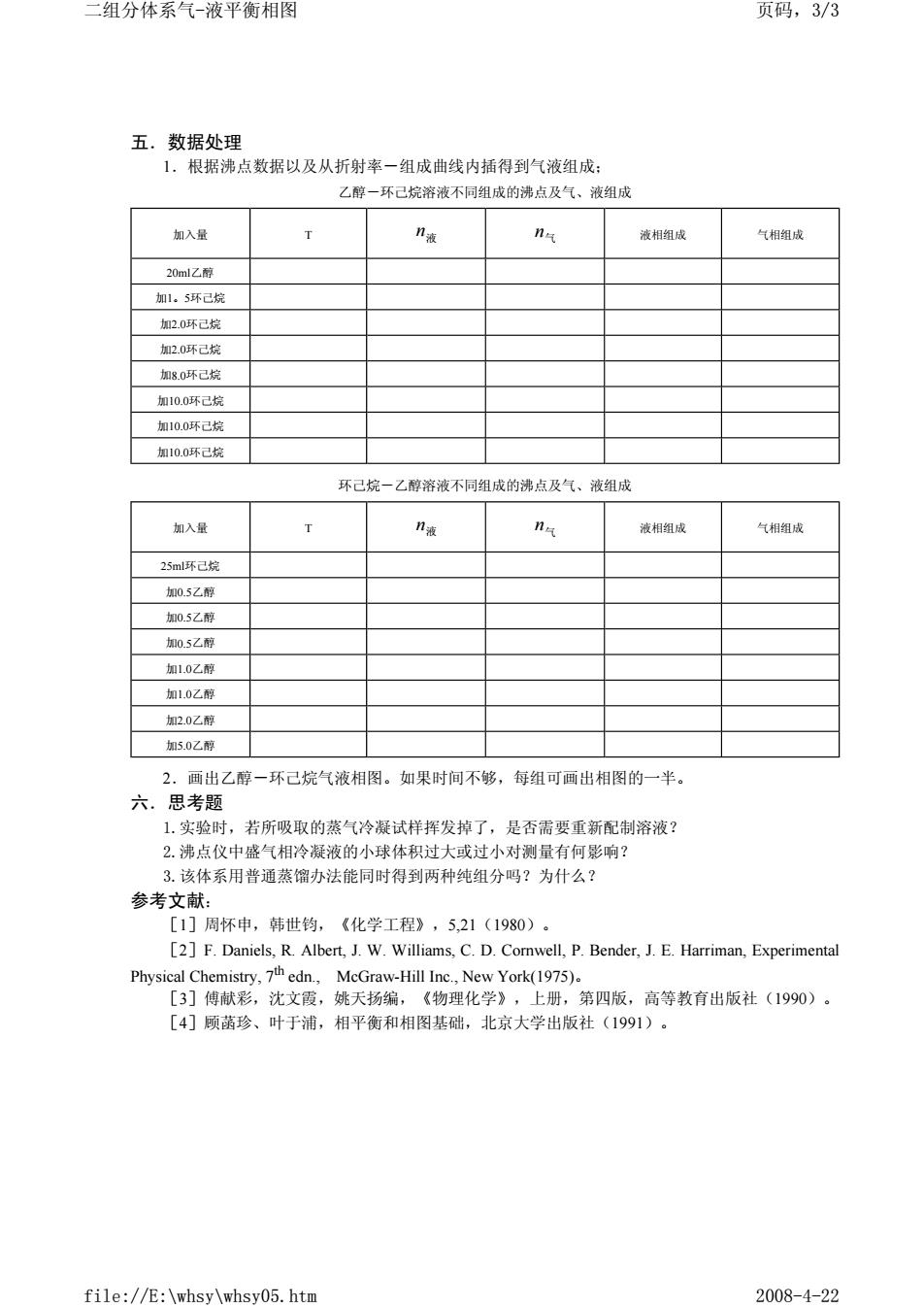
二组分体系气一液平衡相图 页码,3/3 五.数据处理 1.根据沸点数据以及从折射率一组成曲线内插得到气液组成: 乙醇一环己烷溶液不同组成的沸点及气、液组成 如入量 T n n 液相组成 气相组成 20m1Z应 加1,5环己烷 加2.0球己烷 2,0己梳 加8.0坏已烷 加10.0环己烷 加10.0环己烷 加100环已烧 环己烷一乙醇溶液不同组成的沸点及气、波组成 加入量 T n 气相组成 25ml环己烷 加05乙醇 如05乙醇 加05乙醇 加10乙醇 加1.02醇 加2.0乙醇 加5.0乙醉 2.画出乙醇一环己烷气液相图。如果时间不够,每组可画出相图的一半。 六.思考题 1.实验时,若所吸取的蒸气冷凝试样挥发掉了,是否需要重新配制溶液? 2.沸点仪中盛气相冷凝液的小球体积过大或过小对测最有何影响 3.该体系用普通蒸馏办法能同时得到两种纯组分吗?为什么? 参考文献: [1门周怀申,韩世钧,《化学工程》,5.21(1980)。 []F.Daniels,R Albert,J.W.Williams,C.D.Comwell,P.Bender,J.E.Harriman,Experimenta Physical Chemistry,7th edn.,MeGraw-Hill Inc.,New York(1975). [3]傅献彩,沈文霞,姚天扬编,《物理化学》,上册,第四版,高等教有出版社(1990)。 [4]顾菌珍、叶于浦,相平衡和相图基础,北京大学出版社(1991)。 file://E:\whsy\whsy05.htm 2008-4-22
五.数据处理 1.根据沸点数据以及从折射率-组成曲线内插得到气液组成; 乙醇-环己烷溶液不同组成的沸点及气、液组成 环己烷-乙醇溶液不同组成的沸点及气、液组成 2.画出乙醇-环己烷气液相图。如果时间不够,每组可画出相图的一半。 六.思考题 1.实验时,若所吸取的蒸气冷凝试样挥发掉了,是否需要重新配制溶液? 2.沸点仪中盛气相冷凝液的小球体积过大或过小对测量有何影响? 3.该体系用普通蒸馏办法能同时得到两种纯组分吗?为什么? 参考文献: [1]周怀申,韩世钧,《化学工程》,5,21(1980)。 [2]F. Daniels, R. Albert, J. W. Williams, C. D. Cornwell, P. Bender, J. E. Harriman, Experimental Physical Chemistry, 7th edn., McGraw-Hill Inc., New York(1975)。 [3]傅献彩,沈文霞,姚天扬编,《物理化学》,上册,第四版,高等教育出版社(1990)。 [4]顾菡珍、叶于浦,相平衡和相图基础,北京大学出版社(1991)。 加入量 T n液 n气 液相组成 气相组成 20ml乙醇 加1。5环己烷 加2.0环己烷 加2.0环己烷 加8.0环己烷 加10.0环己烷 加10.0环己烷 加10.0环己烷 加入量 T n液 n气 液相组成 气相组成 25ml环己烷 加0.5乙醇 加0.5乙醇 加0.5乙醇 加1.0乙醇 加1.0乙醇 加2.0乙醇 加5.0乙醇 二组分体系气-液平衡相图 页码,3/3 file://E:\whsy\whsy05.htm 2008-4-22