正在加载图片...
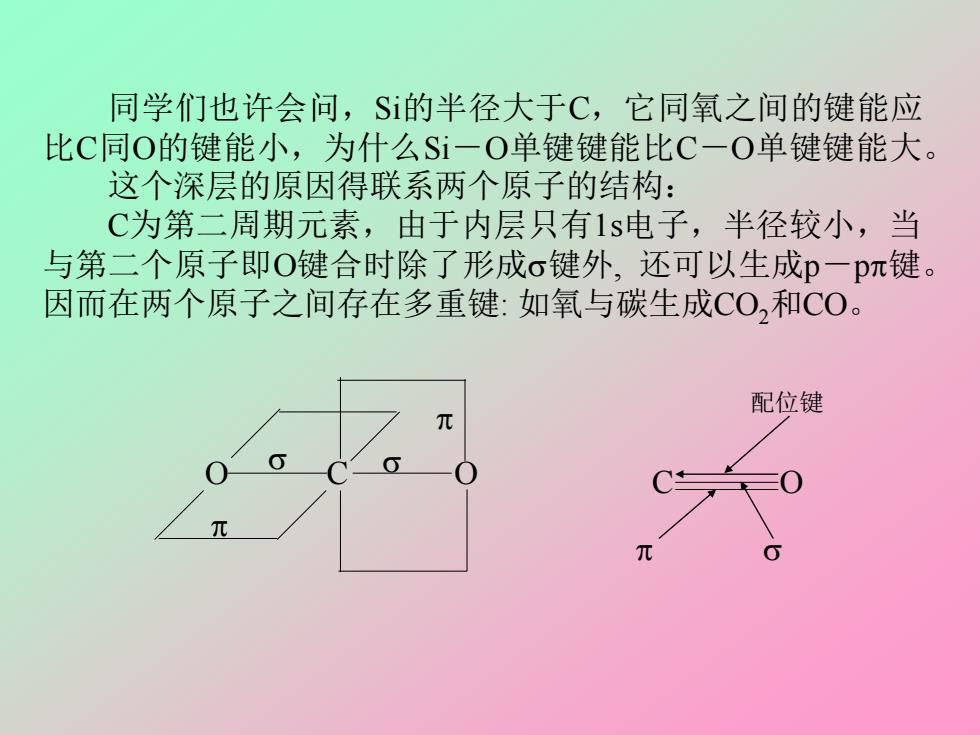
同学们也许会问,S的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si一O单键键能比C一O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成σ键外,还可以生成p一pπ键。 因而在两个原子之间存在多重键:如氧与碳生成CO,和C0。 配位键 同学们也许会问,Si的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si-O单键键能比C-O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成键外, 还可以生成p-p键。 因而在两个原子之间存在多重键: 如氧与碳生成CO2和CO。 O C O C O 配位键