正在加载图片...
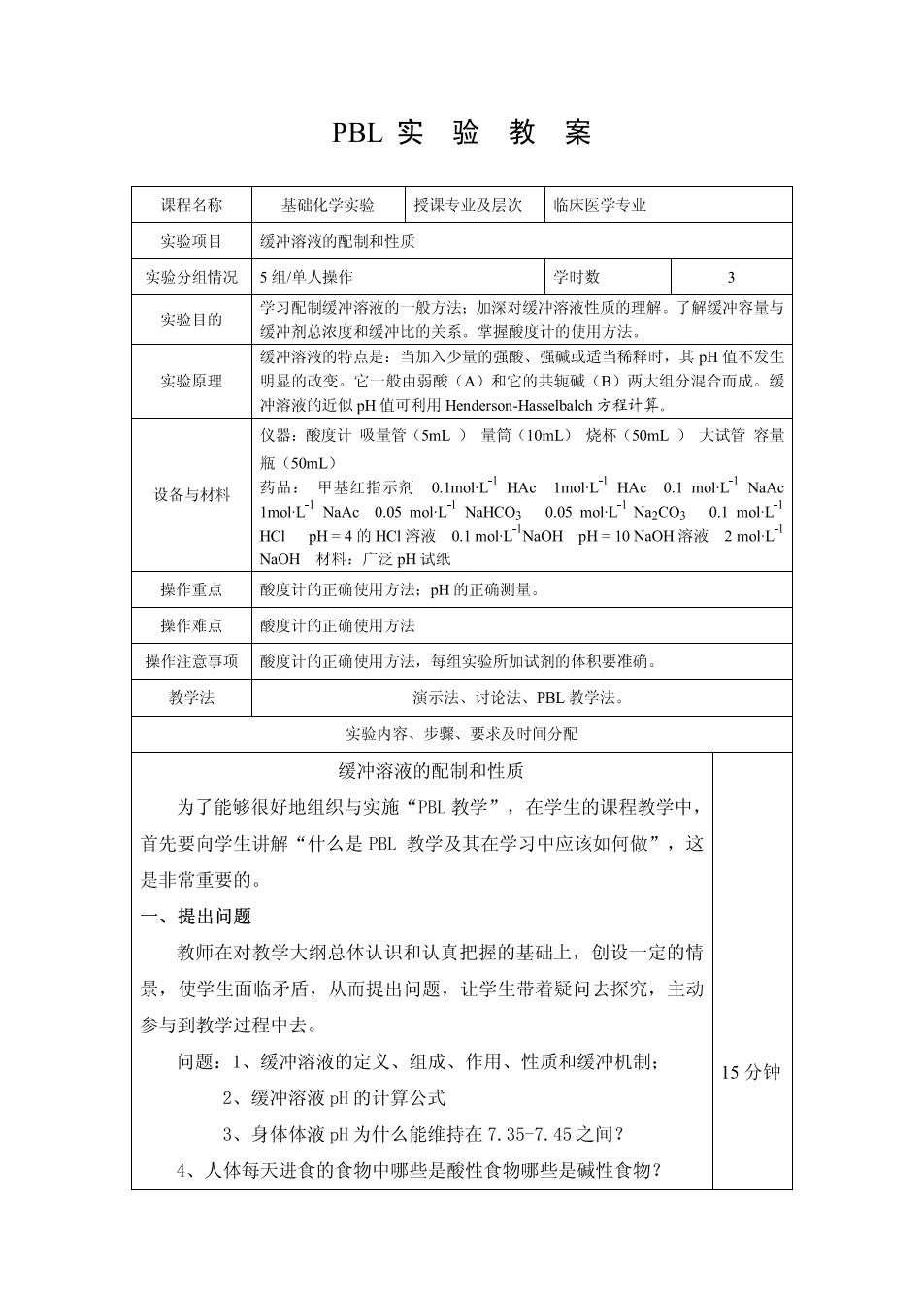
PBL实验教案 课程名称 基础化学实验授课专业及层次临床医学专业 实验项目 缓冲溶液的配制和性质 实验分组情况 5组/单人操作 学时数 3 一般方法 实验目的 学习配制缓冲溶液的 加深对缓冲溶液性质的理解, 了解缓冲容量 爱冲剂总浓度和缓冲比的关系,草握酸度计的使用方法 缓冲溶液的特点是:当加入少量的强酸、强碱或适当稀释时,其pH值不发生 实验原理 明显的改变。它一般由弱酸(A)和它的共轭破(B)两大组分混合而成。缓 冲溶液的近似pH值可利用Henderson-HasseIbalch方程计算. 仪器:酸度计吸量管(5mL)量简(10mL)烧杯(50mL)大试管容量 (50mL 设备与材料 药品:甲基红指示剂0.1 mol-L!HAc Imol-L!HAc0.1 mol-L NaA 1mol-L NaAc 0.05 mol-L NaHCO3 0.05 mol-L Na2CO3 0.1 mol-L HCI pH=4的HCI溶液0.1 mol-LNaOH pH=10NaOH溶液2moL NaOH材料:广泛pH试纸 操作重点 酸度计的正确使用方法:pH的正确测量。 操作难点 酸度计的正确使用方法 操作注意事项 酸度计的正确使用方法,每组实验所加试剂的体积要准确 教学法 演示法、讨论法、PBL教学法。 实验内容、步骤、要求及时间分配 缓冲溶液的配制和性质 为了能够很好地组织与实施“PL教学”,在学生的课程教学中, 首先要向学生讲解“什么是PBL教学及其在学习中应该如何做”,这 是非常重要的。 一、提出问题 教师在对教学大纲总体认识和认真把握的基础上,创设一定的情 景,使学生面临矛盾,从而提出问题,让学生带着疑问去探究,主动 参与到教学过程中去。 问题:1、缓冲溶液的定义、组成、作用、性质和缓冲机制: 15分钊 2、缓冲溶液pH的计算公式 3、身体体液p为什么能维持在7.35-7.45之间? 4、人体每天进食的食物中那些是酸性食物哪些是碱性食物?