正在加载图片...
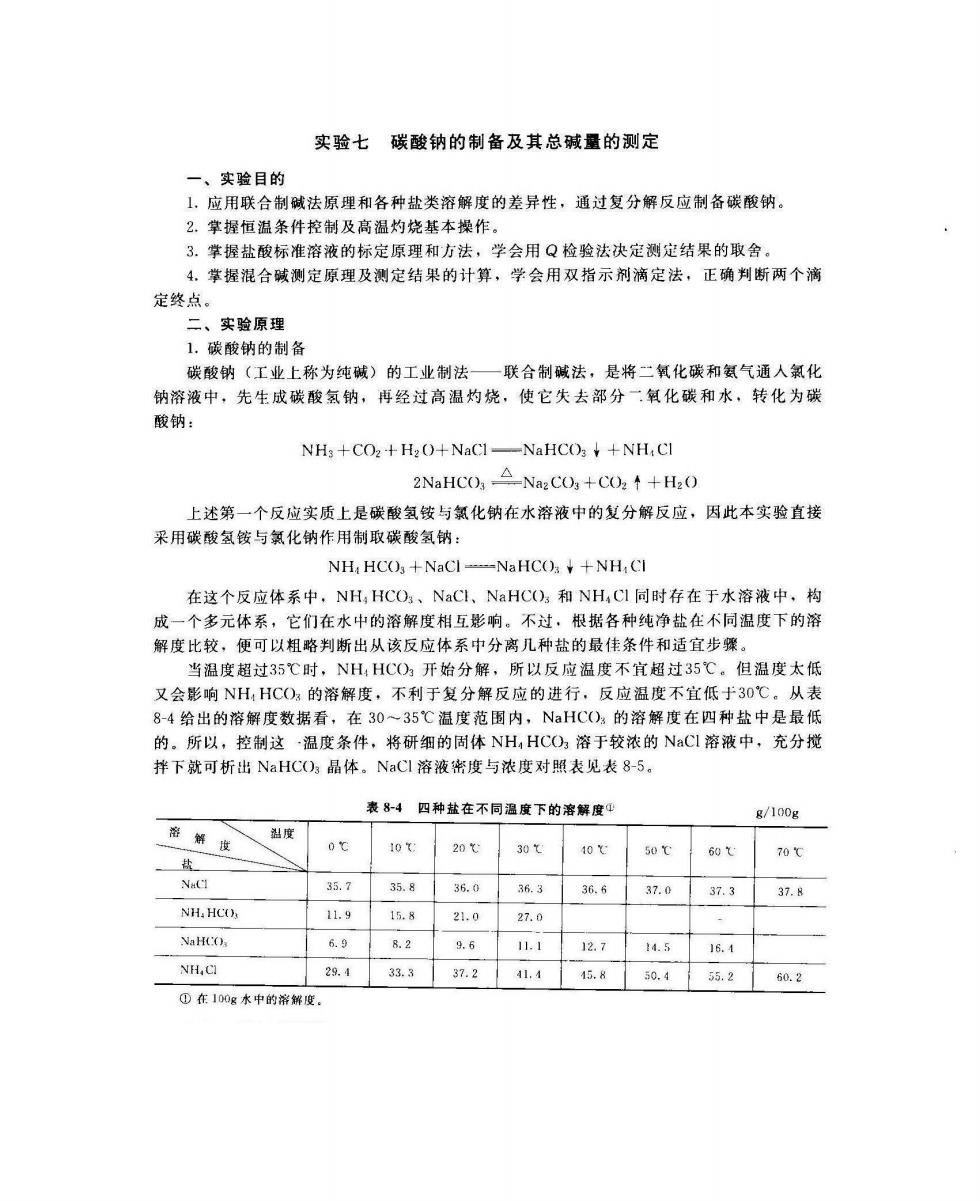
实验七碳酸钠的制备及其总碱量的测定 一、实验目的 【,应用联合制碱法原理和各种盐类溶解度的差异性,通过复分解反应制备碳酸钠 2.掌握恒温条件控制及高温灼烧基本操作。 3。掌握盐酸标准溶液的标定原理和方法,学会用Q检验法决定测定结果的取舍。 4.攀握混合碱测定原理及测定结果的计算,学会用双指示剂滴定法,正确判断两个滴 定终点。 二、实验原理 1.碳酸钠的制备 碳酸钠(工业上称为纯碱)的工业制法—联合制碱法,是将二氧化碳和氨气通人氯化 钠溶液中,先生成碳酸氢钠,再经过高温灼烧,使它失去部分二氧化碳和水,转化为碳 酸钠: NHs+COz+H20+NaCl-NaHCO+NH:CI 2 NaHCO,△Na2C,+CU2↑+H20 上述第一个反应实质上是碳酸氢铵与氯化钠在水溶液中的复分解反应,因此本实验直接 采用碳酸氢铵与氯化钠作用制取碳酸氢钠: NH HCO+NaCl-NaHCO+NH:CI 在这个反应体系中,NH,HCO、NaCL、NaHCO)5和NH,C同时存在于水溶液中,构 成一个多元体系,它们在水中的溶解度相互影响。不过,根据各种纯净盐在不同温度下的溶 解度比较,便可以粗略判断出从该反应体系中分离几种盐的最佳条件和适宜步骤 当温度超过35℃时,NH,HC)方开始分解,所以反应温度不宜超过35℃。但温度太低 又会影响NH:HCO的溶解度,不利于复分解反应的进行,反应温度不宜低于30℃。从表 8-4给出的溶解度数据看,在30~35℃温度范围内,NaHC()3的溶解度在四种盐中是最低 的。所以,控制这~温度条件,将研细的固体NH,HCO)3溶于较浓的NaCI溶液中,充分搅 拌下就可析出NaHC(),晶体。NaCI溶液度与浓度对照表见表8-5, 表84四种盐在不同温度下的溶解度4 g/100g 、度 10t20℃ 30t40℃ 50℃60t 70℃ 35.7 35.836.0 36.336.6 37.037.337.8 NH.HCO. 11,9 15.8 21.0 27.0 NaHCO, 698.2 9.6 1.1127 14.5 16.4 NH.C 2.133.337.241.445.8 50.4 55.250,2 ①在100g水中的希解度