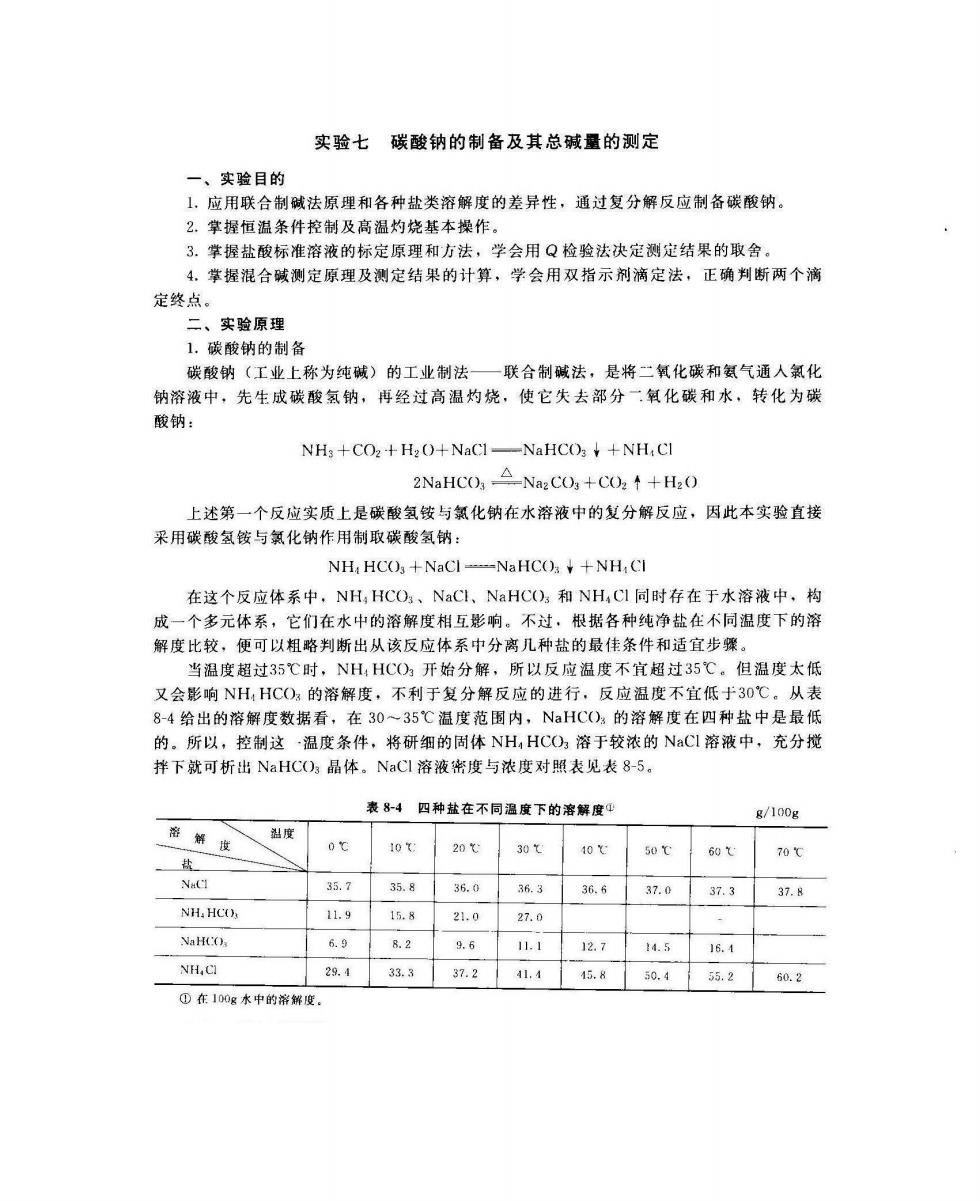
实验七碳酸钠的制备及其总碱量的测定 一、实验目的 【,应用联合制碱法原理和各种盐类溶解度的差异性,通过复分解反应制备碳酸钠 2.掌握恒温条件控制及高温灼烧基本操作。 3。掌握盐酸标准溶液的标定原理和方法,学会用Q检验法决定测定结果的取舍。 4.攀握混合碱测定原理及测定结果的计算,学会用双指示剂滴定法,正确判断两个滴 定终点。 二、实验原理 1.碳酸钠的制备 碳酸钠(工业上称为纯碱)的工业制法—联合制碱法,是将二氧化碳和氨气通人氯化 钠溶液中,先生成碳酸氢钠,再经过高温灼烧,使它失去部分二氧化碳和水,转化为碳 酸钠: NHs+COz+H20+NaCl-NaHCO+NH:CI 2 NaHCO,△Na2C,+CU2↑+H20 上述第一个反应实质上是碳酸氢铵与氯化钠在水溶液中的复分解反应,因此本实验直接 采用碳酸氢铵与氯化钠作用制取碳酸氢钠: NH HCO+NaCl-NaHCO+NH:CI 在这个反应体系中,NH,HCO、NaCL、NaHCO)5和NH,C同时存在于水溶液中,构 成一个多元体系,它们在水中的溶解度相互影响。不过,根据各种纯净盐在不同温度下的溶 解度比较,便可以粗略判断出从该反应体系中分离几种盐的最佳条件和适宜步骤 当温度超过35℃时,NH,HC)方开始分解,所以反应温度不宜超过35℃。但温度太低 又会影响NH:HCO的溶解度,不利于复分解反应的进行,反应温度不宜低于30℃。从表 8-4给出的溶解度数据看,在30~35℃温度范围内,NaHC()3的溶解度在四种盐中是最低 的。所以,控制这~温度条件,将研细的固体NH,HCO)3溶于较浓的NaCI溶液中,充分搅 拌下就可析出NaHC(),晶体。NaCI溶液度与浓度对照表见表8-5, 表84四种盐在不同温度下的溶解度4 g/100g 、度 10t20℃ 30t40℃ 50℃60t 70℃ 35.7 35.836.0 36.336.6 37.037.337.8 NH.HCO. 11,9 15.8 21.0 27.0 NaHCO, 698.2 9.6 1.1127 14.5 16.4 NH.C 2.133.337.241.445.8 50.4 55.250,2 ①在100g水中的希解度

表8-5NaC溶液密度(kg/1)与浓度对服表(25℃) X/% 密度/(kg/1) pl(g/L) c/(mol/L) 20 1.148 229.5 3.927 22 1.164 256.0 4.380 21 1.180 283.2 4.816 26 1.197 311.2 5.325 2.碳酸钠中总碱(混合碱)址的测定 混合碱是指Na2CO3和未分解的NaHC()方的混合物,可用“双指示剂法”测定。 用HC标准溶液做滴定剂,由于HC易挥发,不能配制成准确浓度的标准溶液,通常 配制成0.1~0.5mol/L的标准溶液后用基准物进行标定,得出HC1的准确浓度。 标定HCI标准溶液的基准物有无水Na2CO,和硼砂。无水Na2CO3纯度高,价格便宜。 但摩尔质量小,有强烈的吸湿性,使用前应在270~300℃烘1h后,放置在干燥器中备用。 标定反应为 Na2CO3+2HCI-CO)z+H20+2NaCl 化学计量点时pH为3.89,因此选用甲基橙作为指示剂, 双指示剂法:指以H作为标准溶液,酚酞为第一滴定终点的指示剂,甲基橙为第二 终点的指示剂的滴定方法。当H心滴定至第一终点(即酚酥变色)时,N?C()被中和一 半,而NaHC()未被中和。设所消耗HCI溶液的体积为V: Naz COa+HCI -NaHCO:+NaCl 从完成第一终点到达第二终点时,原有的NaHC()方与新生成的NaHC(3均被中和为CO2和 H2O。设第二步所消耗HCI溶液的体积为V2: NaHCO3+HCI-NaCl+CO2+H2O 由此可见,两个滴定终点消耗HCI溶液的体积V1<V2,而且Na2C(方消耗HCI溶液的 体积为两倍的V1,NaHCO,.消耗HCI溶液体积为(V2一V1)。根据HC1溶液的浓度及所消 耗的体积,便可计算出Na2C()、NaHC()3及总碱量Na2O的质量分数. 三、仪器与试剂 1.NazC()3制备 (1)仪器与材料恒温水浴加热器;烧杯,搅棒;蒸发皿,表面皿:研体;减压过滤装 置:剪刀:滤纸:台秤;称量纸;坩埚钳:铁三脚架:石棉网:比重计。 (2)试剂NaCI(粗食盐水溶液,25%左右,备比重计测其密度):Na(OH(3mol/L.): NaC)(1.5mol/L):HCI(3mol/L):NH,HCO(s):pH试纸;比色卡. 2.NazCO,(制备产品)中总碱量测定 (1)仪器台秤;分析天平:称量纸;移液管(25mL):锥形瓶(每人3个):滴定台 架;酸式滴定管,铁三脚架;石棉网。 (2)试剂HC1;甲基橙;酚酞

四、实验内容和步骤 1.碳酸钠的制备 (1)粗食盐水溶液的精制与调配量取粗食盐水NaC1(25%左右)25ml.放人 一小烧 杯中,用3mol/L NaOH和1.5mol/LNa2C()3组成的等体积混合碱液(学生自己配制,几 毫升即可)调节食盐水溶液的pH值至11左右,溶液中有明显沉淀物(一般为碱式碳酸镁 和碳酸钙)生成,小火煮沸后用诚压过滤法分离弃去沉淀,将滤液倒人洁净的小烧杯中,用 3mol/LHCl调节其pH=7,供下一步反应用。 说明:如果所用的食盐水溶液是由纯净的试剂NCI配制而成,则可以省去以上的精制 与调配步骤,量取25 mL NaCl溶液后直接进行下一步复分解反应即可。 (2)复分解反应制中间产物NaHC()3将盛有精制NaCI溶液的小烧杯放在水浴上加 热,温度控制在30一35℃。称取NH,HC(5固体(可的情加以研磨)细粉未10g,在不断 搅拌下分几次加入到上述溶液中。加料完毕后继续充分搅拌并保持反应要求温度20min左 右。静置几分钟后减压过滤,便得到了NHC(⅓品体。可用少量水(不能多!思考为什 么?)淋洗晶体以除去黏附的铵盐,再尽量抽干母液,将布氏漏斗中洁白、蓬松的NHC() 品体取出,在台秤上称其湿重并记录数据:中间产物WWo,(g)。 (3)灼烧制备NazC0,将上面制得的中间产物NaHC)放到蒸发皿中,放至石棉 网上加热,同时必须用玻璃棒不停地翻搅,使固体均匀受热并防止结块。开始加热灼 烧时可适当采用温火,几分钟后就要改用强火,大约灼烧0.5h左右,即可制得干燥的 白色细粉状NCO产品。冷却到室温后,在台秤上称其质量并记录下最终产品 Naz CO方的质量数据mN,co,(g)。 (4)产品产率的计算根据反应物间的相关性和实验中有关反应物的实际用量,确定产 品产率计算基准,然后计算出理论产量m塑论(g),进而计算出产品产率: 产率(%)-m×100% 理论 如果实验中所用原料NaCl为粗食盐,按其纯度为90%计算NaCl的投料量:如果用精 食盐为原料,则按其纯度为100%计算 2.张酸钠(产品)中总减量的测定 (1)0,1mol/L.HCt标准溶液的配制取1mol/L.HCI(实验室准备)40mL倒入500ml 试剂瓶中,加350mL.去离子水稀释至400ml,盖好玻璃塞充分摇匀备用。 (2)基准物无水Na,CO3的配制在分析天平上准确称取无水Na2C() g于100ml 烧杯中,加去离子水50mL,用玻璃棒轻轻搅拌溶解并转移至250.0ml.容量瓶中。用少量 去离子水洗涤烧杯3一4次,洗涤液也移入容量瓶中,敏后用去离子水稀释至刻线,盖好瓶 塞,摇匀备用 (3)0.1mol/1.HC1的标定用25.00mL移液管移取Na2C()3标准溶液置于锥形瓶中 加1~2滴甲基橙指示剂,用0.1mol/LHC1标准溶液滴定至由黄变为橙色,记下滴定所消 耗的HCI溶液体积,平行滴定三份,极差小于0.05mL。 (4)样品溶液的配制在分析天平上称取自制产品碳酸钠1.2500g,放于250.0mL.容

量瓶巾,用去离子水溶解并稀释至250.0ml.刻度线,摇匀待测 (6)用标准酸滴定确定混合碱含址用移液管吸取上面配好的待测样品溶液25.00ml。 放到洁净的250ml.形瓶中 加10滴酚献指示剂,用标定好的HCI标准溶液(0.1mo/1 左右)滴定至很浅的粉色(可与参比液对照),此时为第·个滴定终点,记录下所消耗HC 溶液的体积V:然后加人2滴甲基橙指示剂(此时溶液呈黄色),继续用标准HC1溶液滴 定至溶液变为橙色,将溶液放到石棉网上加热煮沸1~2m,冷却后溶液又变为黄色,再继 续补漓H1至溶液再变为橙色(30不褪色)为止,此时为第二个滴定终点,记录下所耗 HCl的体积V2。 再以问样的方法重复取样滴定儿次,要求取三个平行数据,消耗H的总体积(V十 V)的极差不大于 0. 05m (6)样品中两碱百分含量的计算 两个终点所消耗的H体积采用连续计量。即到达第终点时所消耗HC1体积为Y,继 续濟定,到达第_终点时所耗IC1的总体积记为V总·则在两步滴定所用HC1的总止中 ,样品 所合NeC消耗HC体积为2W,样品中所合aHC0消耗HC的体积为V。一2 所以,根据V和V的数址大小, 可以计算出样品中两个组分NaC)与NaHC的 质量分数(,进前可以计算出样品中总碱(NazO)。 实验数据归纳 6中 表86混合碱分析数据记录及结果计算 样品号样品/g 标准H心溶 H1州址/ml. 液旅没/(md/,】 w Na:CDa)/% (NaH,)/% Vi V (N)/ 3 五、思素瓶 1.在制备NC),的过程中,粗食盐水溶液精制的日的何在?在精制与调配过程中, 先后两次调节溶液的pH值分别为11和7,各自的日的是什么? ·在产品纯度分析测定中,用标准H溶液滴定到达第二个终点时,为什么要将溶液 加热煮沸?不然将对实验数据带来什么影响? 3。在滴定过程中,两个滴定终点的指示剂为什么要选择不同的两种?各自的特红 是什么? 4.影响产品产量高低的主要因素有哪些?影响产品纯度,即N2C(Oa、NaHC(及其 他杂质含址的主要因素有哪些?