
实验十一混合离子的分离与鉴定 一、实验目的 1.熟悉有关离子及其化合物的性质。 2.了解混合离子分离与检出的方法和操作。 3.分离并检出混合离子溶液中Ba2+、Fe+、Co2+、NP+、C+、A+、Zn2+7种 离 二、实验提要 离子鉴定(检出)就是确定某种元素或其离子是否存在。离子鉴定反应大都是在水溶液 中进行的离子反应。选释那些变化迅速而明显的反应。如颜色的改变,沉淀的生成与溶解, 气体的产生等。还要考虑反应的灵敏性和选择性。 所谓灵敏性,就是待测离子的量很小时就能发生显著的反应,则这种反应就是灵敏反 应。反之若需要检出的离子的量很大,才能发生可觉察的反应,那么就是灵敏性不好的反 应。例如,在一定条件下,用生成AgC沉淀的反应来检出溶液中的Ag+,待检出Ag+的 量很少时,就可以检出。反应 Ag*+C→AgCI+ 就是一个灵敏性很好的反应。若用生成Ag2S(),沉淀的反应来检出溶液中的Ag,待检出 的Ag+的量比较大时,才能有Ag2S(),白色沉淀。那么反应 2Ag+S0g→A0 就是一个灵敏性很差的反应。离子鉴定要选释灵敏性好的反应 所谓反应的选择性是指与一种试剂作用的离子种类而言的。能与加入的试剂起反应的离 子种类越少,此反应的选择性就越高。若只与一种离子起反应,该反应称为此离子的特效反 应,例如,阳离子中只有NH与强碱作用,发生反应

NHOH△NH++H0 根据NH的气味可知NH时的存在。溶液中其他阳离子对NH;的检出并不干扰,这个反 应就是特效反应。 实际上特效反应并不多、共存的离子往往彼此下扰测定,需要将组分··分离或用掩蔽 剂来掩蔽干扰离子。掩敲剂般是指能与十扰离了形成稳定配合物的试剂。例如鉴定(o 时,通常利用KSCN溶液与Co反应生成蓝色[Co(SN),]-配离子. co1+4SCN-当[Co(sCN 但若溶液中含有Fe+,它也与KSN反应生成血红色[Fe(SCN)n-"配离手,结果看不到 蓝色溶液的形成。Fe+下扰了(o·的鉴定。但若先在待测溶液中加人NaF,因生成了稳定 的无色[FeFs]3配离子,Fe3-被掩蔽起来,不再千扰Co2·的鉴定。NaF就是Fe+的掩 蔽剂。 混合离子分离常用的方法是沉淀分离法。此方法上要是根据溶度积规则,利用沉淀反 应,达到分离目的。 用于分离与检出的反应,只有在一定的条件下才能进行。这里的条件主要指溶液的酸 度、反应物的浓度、反应温度、能促进或妨碍此反应的物质是杏存在等。为了使反应朝我 们期望的方向进行,就必须选择近当的反应条件。为此除了熟悉行关离子及其化合物的性质 外,还要会运用离子平衡(酸碱、沉淀、氧化还原、配合等平衡)的规律控制反应条件,所 以了解离子分离条件和检出条件的选择与确定,既有利于熟悉离了及其化合物的性质,义有 利于加深对于各离子平衡的理解 因此在本实验中我们安排了Ba2t、Fe1、Co2·、N2+、A13+、Cr+、Zn247种离子 的分离与检出。 首先利用BaS(),的雄溶性将Ba2+与其他离子分离。 利用A, ,C+、Zn2+氯氧化物的两性加入碱使溶液是强贼性(pH>10),Zn2 Cr+、变为Zn(OH)1]2-、[Cr(OH),门-、[AI(OH)]-进人溶液,同时加人H2(O2,使某 些元素氧化成高氧化态 2Co(OH)2+H()2→2Co()(0H)¥+(OH+H2() 2[Cx(OH)4]·+3HO5→2Cr(-+(OH-+5H(0 H2O+2Fe(H)2+HO2→2Fe(OH)3+(OH (混合离子溶液中有可能存在F2+) 这样做的日的是为了使分离彻底,因为Fc、Co元素高氧化态的氯氧化物比低氧化态的 更难溶。 氧化物 Co(OH): 1,6×105 o))H) 1.6×101 Fe((H) 3.8×10 Fe(()月I)z 8×101R 过量的H(O2要加热至完全分解掉,否划酸化时,H2(2将Cn(号还原为C Cr9()片-+3H()2+8H+-◆2Cr3++3()24+7H2() 将沉淀与溶液离心分离。沉淀中含有Fe(OH)3、Ca(O(OH)、Ni(OH)2·溶液中含有 [A(OH)],Cr(、[Zn(OH):]2-等离子。在沉淀中加入H2S)使沉淀溶解

Fe(OH)s+3H*-Fe++3Hz() 4o()(OH)+8H+→4Co2++(2↑+6H2O Ni(OH)2 +2H--Ni+2H20 然后利用Fe、Co2+、NP+与氨水配位作用的不同,将FC-与Co2-、N+分离并进 行鉴定。 在溶液部分,利[A1(OH),]与NH,(CI作用能生成A1()H)沉淀的特性.将 [A1(OH)1].[Zn(OH):]、Cr(-分离并鉴定。 [Zn(OH):]2-+4NH→[Zn(NH),]2·+4H) [AI(OH),]+NH;→AI(OH)3¥+NH4+H,O 为了证实白色沉淀是A1(OH),将其用HAc溶解.加NH,CI调节酸度,控制pH=4一5. 加人铝试剂并微热之·有鲜红色絮状沉淀生成,证明·的存在, 在除去A1(OH),沉淀的游液中,含有Cr(和[n(NH3):P·。在此清液中加人 aCL,生成EaCrO:黄色沉淀,使Cr(与[Zn(NH)+分离并鉴延。 三、仪器与试剂 1.仪程 离心机:离心试管。 2.试剂 化学式后面括号中的数字是该试剂的浓度,单位为mo/1。 H2S)(2):HN()(2);HAc(6);Na(OH(6):NH3·H,(O(6):BaC(0.1):KSCN (10%);H()2(3%). 混合离f溶液:Fe(C:BaCz:Cr(:Zn(Cl:NiS:CoC;AC;各溶液浓度均 为0.1mol/L,按体积比1:1:2:2:2:2:4混合. 固体试制,NaF:NH,L 其他试剂:铝试剂:丁二肟(1%):内雨:pH试纸。 四、实验步骤 将Ba2+、Fe+,C2+、NP+,Z2+、Cr+、A+试液按体积比1:1:2:2:2:2:4 收出,混合均匀(此混合液由实验室准备)。按以下线路图进行分离与检出。 1.Ba2+与其他离子的分离与检出 在2ml,混合离了溶液中加人H2SO,至Ba2-沉淀完全。然后离心分离,用稀H2S),洗 涤二次沉淀,洗涤液并人离心液中。 在沉淀巾加人HN()a,仍为白色沉淀,表示混合液中有Ba2+。 2.Fc+,Co2+、N-与其他离子的分离和检出 在离心液中加入Na(OH溶液至pH≥10,加入H,(O,加热爷不冒气泡为止。然后离心 分 离心液中含有[Z(OH)1?、[Ai(H),]、Cr子·(留做3用)。沉淀中含有Fe(OH)1 ('o(0()H)、Ni()H)2 将沉淀用水洗两遍,洗涤水放入离心液中。在沉淀中加人H2S),再加入过址的NH,· H(),然后离心分离。 沉淀中加入HzS()、KSCN溶液,有血红色出现.证明有Fe+。 离心液分成两份,-份加入H2S(),NaF(固)、内酮、KSCN溶液,溶液变蓝色,证
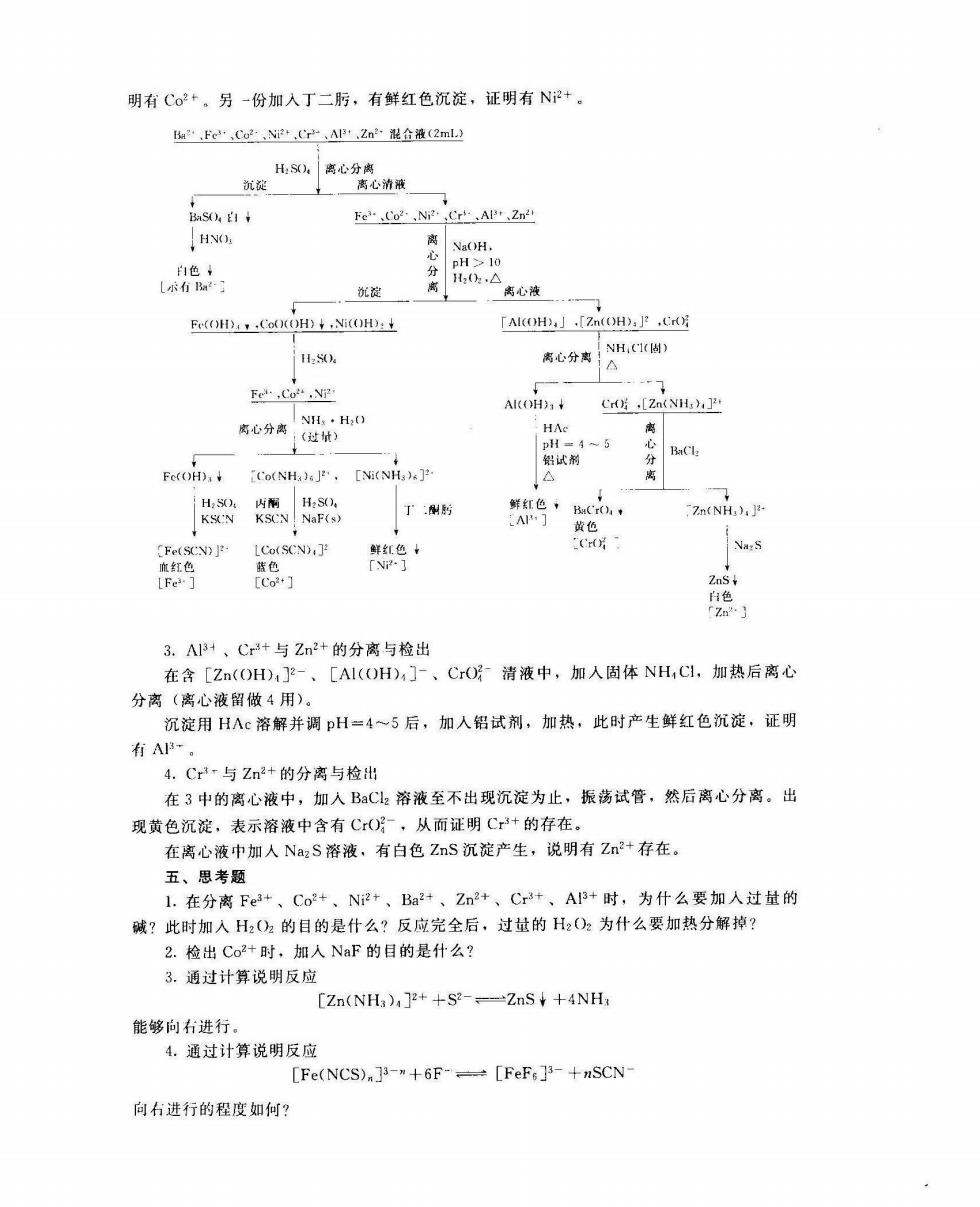
明有Co2+。另一份加入丁二肟,有鳞红色沉淀,证明有N+。 知,FeCo2-N+.C,AP2n混企液(2m 出离心分离 沉淀 离心消减 s自+ Fe“CgN,Cp.Ap2m2 HNO. 沉淀 离心液 Ee(OH.CoO()4.: LAKOH」.[Zn(OH:P,Cg H:50. Fel.CoN AlO)Cr[Z(NH) HA Fc(O),Co(NH).[NONH) 收陆 Zn(NH).- 色 LCo(SCN).] Na:S 3.A13+、C3+与Zn2+的分离与检出 在含[Zn(OH)]-、[AI(OH)4]-、CrO清液中,加入固体NH,C1,加热后离心 分离(离心液留做4用) 沉淀用HAc溶解并调pH=4~5后,加入铝试剂,加热,此时产生鲜红色沉淀,证明 有 4.Cr3r与Zn2+的分离与检出 在3中的离心液中,加入BaC溶液至不出现沉淀为止,振荡试管,然后离心分离。出 现黄色沉淀,表示溶液中含有C(),从而证明C+的存在。 在离心液中加人NazS溶液,有白色ZnS沉淀产生,说明有Zn2+存在。 五、思考题 1.在分离Fe3+、Co2+、N2+、Ba2+、Zn2+、Cr+、A13+时,为什么要加入过量的 碱?此时加入H,)2的目的是什么?反应完全后,过量的H2O2为什么要加热分解掉? 2.检出Co2+时,加人NaF的目的是什么? 3.通过计算说明反应 [Zn(NH3)]2++S2-=ZnS+4NH 能够向右进行 4.通过计算说明反应 [Fe(NCS)+6F-=[FeFs]-+SCN- 向石进行的程度如何?