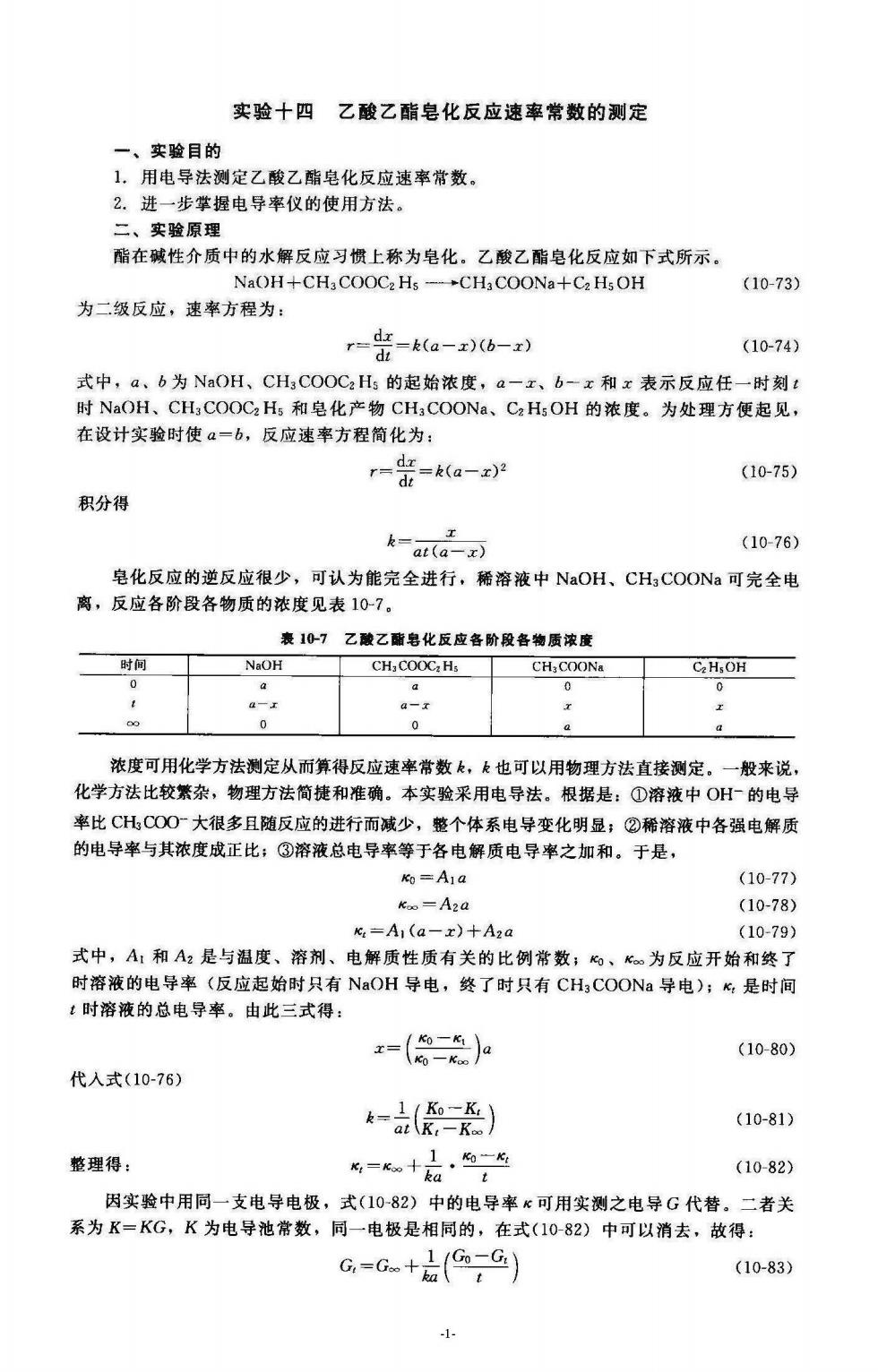
实验十四乙酸乙酯皂化反应速率常数的测定 一、实验目的 1,用电导法测定乙酸乙酯皂化反应速率常数。 2.进一步掌握电导率仪的使用方法。 二、实验原理 酯在碱性介质中的水解反应习惯上称为皂化。乙酸乙酯皂化反应如下式所示. NaOH+CHaCOOC2 Hs (10-73) 为二级反应,速率方程为: r=-(a-x)(b-z) (10-74) 式中,a、b为NaOH、CHCO0CHs的起始浓度,a一x,b-x和x表示反应任一时刻 时NaOH、CH,COOC2Hs和皂化产物CH;COONa、CaH5OH的浓度。为处理方便起见, 在设计实验时使a-b,反应速率方程简化为: r==k(a-x)2 (10-75) 积分得 k-at(a-x) (10-76) 皂化反应的逆反应很少,可认为能完全进行,稀溶液中NaOH、CHgCOONa可完全电 离,反应各阶段各物质的浓度见表10-7。 表10-7乙酸乙酯皂化反应各阶段各物质浓度 时间 NaOH CH-COOC:H:CH:COONA CHOH 0 a 0 0 a- 浓度可用化学方法测定从而算得反应速率常数k,k也可以用物理方法直接测定。 一般来说 化学方法比较繁杂,物理方法简捷和准确。本实验采用电导法。根据是:①溶液中OH的电导 率比CHCO0大很多且随反应的进行而减少,整个体系电导变化明显:②稀溶液中各强电解质 的电导率与其浓度成正比;③溶液总电导率等于各电解质电导率之加和。于是, (10-77) Koo=A2a (10-78) %=A,(a-r)+A,a (10-79) 式中,A1和A2是与温度、溶剂、电解质性质有关的比例常数:、k为反应开始和终了 时溶液的电导率(反应起始时只有NaOH导电,终了时只有CH3 COONa导电);K是时间 :时溶液的总电导率。由此三式得 =(德之加 (10-80) 代入式(10-76) k=是) (10-81) 整理得 名=十,飞 (10-82) 因实验中用同一支电导电极,式(10-82)中的电导率心可用实测之电导G代替。二者关 系为K=KG,K为电导池常数,同一电极是相同的,在式(1082)中可以消去,放得: G,=G+(,G) (10-83) -1

以G,对S0一C作图,图像为直线,从斜率2可算得k 三、仪器与试剂 恒温槽1套;DDS-11A数显电导率仪1台:DJS1型电导电极1支:秒表1块。 250mL容量瓶1个,150mL锥形瓶3个;25mL移液管3支,1mL吸量管1支。 乙酸乙酯(二级):标准NaOH溶液(约0.02mol/L,标定出准确值)。 四、实验步骤 1.配制乙酸乙酯溶液,其浓度要与标准NaOH溶液相同。室温下乙酸乙酯相对密度为 Q9,要配制250mL溶液需纯乙酸乙酯V(mL,V-婴85,:为标准N0H溶液浓度。 88.06为乙酸乙酯摩尔质量。用吸量管吸取V(mL)乙酸乙酯移人已盛有适量水的250ml 容量瓶中稀释至刻度 2.用移液管吸取标准NaOH溶液25mL置于干燥的锥形瓶中并用纯水准确稀释1倍, 放入25C恒温槽恒温5min。开启电导率仪电源预热10min,将电导电极插人溶液浸没铂片, 测定溶液的电导,测三次取平均值。此值即为反应开始时(零时)的电导G 3.用移液管吸取25mL标准NaOH溶液和25mL乙酸乙酯溶液分别置于干燥的锥形瓶 中,两锥形瓶同时放人25C恒温槽内恒温。5min后将一瓶中的溶液倒人另一瓶内混合,再 将混合的溶液倒回前一瓶内,如此往复两三次可认为两溶液已混合均匀。两溶液混合后仍放 回恒温槽恒温。当两溶液刚混合时开启秒表计时,至6min测定溶液电导,以后每隔2min 测一次,12min后每隔4min,40min后每隔6min,至64min测定结束,共测G6、Gg、Go G2、G16、G20、G4、G8、G2、G6、G40、G6、G2、G8、G十五个数据。 五、数据处理 1.列出数据表。 2.作G,G0,G图,求直线斜率,计算反应速率常数。标准NaOH溶液浓度和乙酸乙 酯溶液浓度已知且相等,从斜率求速率常数时式中a=气。 六、启示、思考、讨论 1.由于空气中CO2会溶入标准NaOH溶液中使浓度改变,因此配制时需用煮沸的电 导水;在配好的溶液瓶上安装碱石灰吸收管防止CO2溶入。乙酸乙酯也要新配。 2.乙酸乙酯溶液更精确的配制方法举例如下:设要配制250mL0.02mol/L的乙酸乙酯 溶液,算出所需纯乙酸乙酯的质量为0.4403g。在250mL容景瓶中加人少量电导水(重蒸 馏水),准确称量,然后用小滴瓶的滴管滴人5滴乙酸乙酯,摇匀后称重,估算每滴乙酸乙 酯的质量和所需的滴数。控制滴人乙酸乙酯的滴数直至接近所猫的加人量,摇匀再称量。最 后几滴,为避免超量可采用滴管口刚接触到滴瓶中的乙酸乙酯液面,让它借毛细作用进入滴 管,然后滴人容量瓶。称量乙酸乙酯的量与预先计算的0.4403g相差不得超过1mg。 3.实验步骤3中氢氧化钠溶液与乙酸乙酯溶液混合的方法简便可行,所引起的误差并 不大。更好一些的装置和方法有双管皂化池和夹层皂化管等

金考察式08)发=品(侵之)整理可得之=,或电号率K用电导G代潜会忌 =如,以忌对:作图。直线线性要比本实验处理数据为好,得到的值他更准确。这样狱需 测定反应终了时的电导G,可自行设计实验测定G。有哪几种方法?哪种方法最好? 3