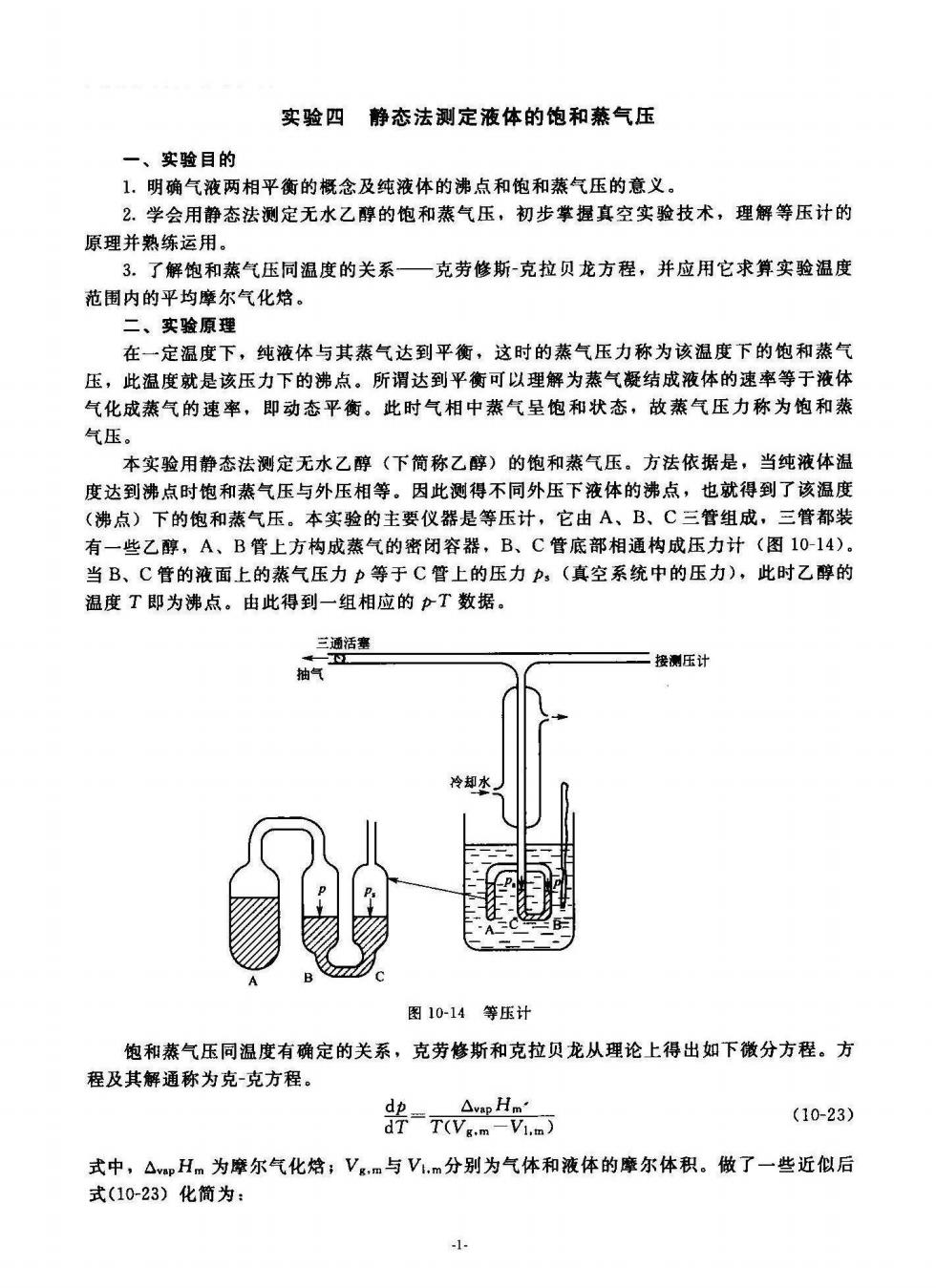
实验四静态法测定液体的饱和蒸气压 一、实验目的 1.明确气液两相平衡的概念及纯液体的沸点和饱和蒸气压的意义 2.学会用静态法测定无水乙醇的饱和蒸气压,初步掌握真空实验技术,理解等压计的 原理并熟练运用 3.了解饱和蒸气压同温度的关系—克劳修斯克拉贝龙方程,并应用它求算实验温度 范围内的平均摩尔气化 二、实验原理 在一定温度下,纯液体与其蒸气达到平衡,这时的蒸气压力称为该温度下的饱和蒸气 压,此温度就是该压力下的沸点。所谓达到平衡可以理解为蒸气凝结成液体的速率等于液体 气化成蒸气的速率,即动态平衡。此时气相中蒸气呈饱和状态,故蒸气压力称为饱和蒸 气压。 本实验用静态法测定无水乙醇(下简称乙醇)的饱和蒸气压。方法依据是,当纯液体温 度达到沸点时饱和蒸气压与外压相等。因此测得不同外压下液体的沸点,也就得到了该温度 (沸点)下的饱和蒸气压。本实验的主要仪器是等压计,它由A、B、C三管组成,三管都装 有一些乙醇,A、B管上方构成蒸气的密闭容器,B、C管底部相通构成压力计(图10-14) 当B、C管的液面上的蒸气压力p等于C管上的压力p,(真空系统中的压力),此时乙醇的 温度T即为沸点。由此得到一组相应的产T数据 ,三通活鑫 二接测压计 抽气 冷水 图10-14等压计 饱和蒸气压同温度有确定的关系,克劳修斯和克拉贝龙从理论上得出如下微分方程。方 程及其解通称为克-克方程。 △vpHm 器v。 (10-23) 式中,△pHm为摩尔气化格:V。m与V.m分别为气体和液体的摩尔体积。做了一些近似后 式(10-23)化简为: 1-

(10-24) 解得 Inp-dga+C (10-25) 本实验测得的一系列沸点和饱和蒸气压数据用作图法求得乙醇的摩尔气化格, 三、仪器与试剂 真空泵1台:真空系统1套;测温测压计1台,等压计1个,烧杯(800mL)1个,无 水乙醇(二级品)。 四、实验步吸 1.熟悉真空系统各个部件的功用 图10-15活塞5右侧部分为真空系统。有控制地抽出其中空气使压力降低。启动步骤如 下:关闭活塞3和三通活塞5,转动三通活塞2使真空泵与大气相通。开动真空泵(实验过 程不停泵),待运转稳定后(1mi左右)调节活塞2使真空泵与瓶4相通,瓶4中空气被抽 出,压力迅速降低。几分钟后将活塞5旋至瓶4与系统相通,瓶4向系统抽气(瓶4故名 “抽气瓶"),抽气量由活塞5控制。这样二级抽气方式可使抽气平缓。 接测压计 令却水 图10-15真空系统 1一干燥塔12,5一三适活察:3一二通活塞:《一抽气瓶:6一缓冲瓶 1一烧杯(竖水作为水浴),8一湿度计,9-一冷凝管; 10提拌器,11-等压计 2.试漏 转动活塞5使抽气瓶与系统相通,系统中空气被抽出,压力降低。抽气至p,<50kPa时 关闭活塞5,观察5min。如果p,固定不变,表明系统不漏气,否则应分段检查漏气原因, 直至不漏气为止。 3.测定室压下乙醇的沸点 转动活塞5使系统与大气相通。在大烧杯内灌注蒸馏水至淹没等压计。开启冷却水流, 加热水浴。A管内液体被加热至沸腾并有气泡从C管逸出,至水浴温度近80℃停止加热。 此时A、B管液面上方的空气及溶于乙醇中的空气被赶尽。搅拌水浴使温度逐渐下降,注意 B、C管的液面变化,当二液面相平时记下温度值,就是室压下乙醇的沸点。此时抽气,活 塞5转向使系统与抽气瓶相通,开启活塞时动作要迅速,但活塞孔开得要小,避免抽气量太

大使等压计里的液体向上冲出。在操作活塞5时应时刻注视测压计,切不要旷者活塞5而忽 略测压计户,值的变化。如果空气从C管返人AB管上方的蒸气中,实验失败需重做。抽气 量由活塞5控制。第一次抽气使测压计显示约降低10kPa,准确记录p,值。此时乙醇剧烈 气化,蒸气在冷凝管中遇冷液化流回C管。随若水浴温度降低,B、C管液面又趋于相平 相平时读水浴温度,此时体系的压力就是此湿度乙醇的饱和蒸气压。 4.同法继续测定不同温度下乙醇的饱和蒸气压。每次压力降低约10kPa,准确记录p, 共测5~6个数据,至水浴温度降至60℃左右(此时测压计示值p,约50kPa)。在测定过程 中要明确“先确定外压,再测定沸点”这个原则。 五、数据处理 1.列出实验数据记录表,正确记录全套原始数据并填入演算结果。 2.作P图,由直线斜率算出乙醇在实验温度范围内的平均摩尔气化焙,与标准值 42.11kJ/mol比较,求相对误差。 六、启示、思考、讨论 1.测定液体饱和蒸气压的方法主要有两种,动态法和静态法。 (1)动态法,其中常用的有饱和气流法。在一定的温度和外压下,将干燥的情性气体通 过被测液体,让惰性气体被液体的蒸气饱和,然后用某种物质吸收气流中的蒸气,知道了一 定体积的气流中蒸气的质量便可计算蒸气的分压,也就是该温度下被测液体的饱和蒸气压, 动态法适用于蒸气压较小的液体。 (2)静态法,在某一温度下直接测量饱和蒸气压或在不同外压下测定液体的沸点。静态 法适用于蒸气压较大的液体。本实验采用静态法,使用等压计测量乙醇饱和蒸气压,其优点 是仪器和操作都比较简便,溶于液体的空气在实验过程中被除去,所得结果较准确。 2.克克方程是从理论上导出的,对式(1023)做了一些近似后简化成式(10-24),然后 积分得式(10-25)。这些近似是:①因液体的摩尔体积远小于气体摩尔体积,Vm《Vm, V可忽略不计②视装气为理想气体,利用理想气体状态方程V。T③假设△H。 不随温度而变化,求解徽分方程得到式(10-25)。第一个近似对算得的△pHm影响很小, 第二和第三个近似使算得之△pHm明显偏大。请思考其中的道理。 3.讨论上述第三个近似。温度对摩尔气化焙是有影响的,温度高时AHm小,温度低 时△nHm大。在积分式(10-24)时做了△vpHm不随温度变化的假设显然会给结果带来误 差。由式(10-25)作图求得之△Hm应比正常沸点时大,比最低实验温度时小(正常沸 点,是指1atm下的沸点)。习惯上称所得的△apHm为“平均摩尔气化焙”。确切地说是实 验温度范围内某个温度的摩尔气化格,但这个温度的具体数值从式(1025)和图中是无法知 道的.如果直接从式(10-20)出发,可以求得实验温度范围内各个温度时的△pHm。详细 讨论见下段。 4根据式(10-24)-心可求算实骏温度范围内某个度的△H。具体方法 是,作伞T图,得单调上升并且凸向上的曲线。过曲线上相应于某个温度的点作切线,并 求出这条切线的斜率产,再乘以RT,即得该温度的△wH。可知△wH。随温度增高 而减小,过曲线上相应于正常沸点78.4℃的点(或曲线外推到这一点)作曲线求△pHm 与文献值40.48kJ/mol比较, 3

5.明确真空系统各部件(见图10-15,这些部件有真空泵、干燥塔、抽气瓶、缓冲瓶、 各种活塞)的功用。在实验步骤中已讨论过抽气瓶,现在考察一下缓冲瓶的情况。瓶6与等 压计并联,抽气时气体分流,抽气量由二者分担且与本身的容积成正比。因瓶6容积(约 3.5L)比等压计C管上方管道的容积(约40mL)大80多倍,抽气时气体主要从瓶6抽出, 而等压计C管上方抽出气体很少,这样就便于实验操作。瓶6起着缓和抽气冲击的作用, 故名缓冲瓶