
氨基甲酸铵分解反应平衡常数的测定 一,实验目的 1.用静态法测定一定温度下氨基甲酸铵的分解压力,求算该反应的平衡常数: 2。了解温度对反应平衡常数的影响,由不同温度下平衡常数的数据,计算反应格变: 3。进一步草握真空实验技术和恒温槽的调节使用。 二.实验原理 氨基甲酸铵的分解反应为: NH,C00NH,周)一2NH3(气)+CO2(气) 纯固态物质的活度为1,在压力不太大是气体的逸度系数近似为1,故反应平衡常数K,为: Kp-PPco: 式中,P八H、Po:分别为平衡时NH3和CO2的分压,又因固体氨基甲酸铵的蒸气压可忽略不计, 故体系的总压即总为: P总-pH,+pcO 称为反应的分解压力,从反应的计量关系知 pNH:=2 pco: 1 则有 p=3P色和pco:=3P总 2 1 4 K,(3Pe2.(3pg)-27p2 可见当体系达平衡后。出得平衡总压后就可求算实验湿度的平衡常数 平衡常数K称为经验平衡常数。为将平衡常数与热力学函数联系起来,我们]再 定义标准平衡常数。化学热力学规定温度为T、压力为100,的理想气体为标准态,100即,称为标准 态压力。P公:、pco:或p除以100kp,就得标准平衡常数 2p。 1p4卫 4 K(3(3)(-27x10P 温度对标淮平衡常数的影响可用下式表示: dT =RT2 式中,△H为等压下反应的摩尔变即摩尔热效应,在温度范围不大时△H可视为常数,由积分 得:

仙好行用世为有新s R,由此算得△H。=一RS。氨基甲酸铵分解反成是吸热 反应,25C时△H=159.32kJo1,温度对平衡常数影响较大,实验时必须控制好温悟得温度使 灵敏度在土0.1℃之内。 三,仪器和试剂 真空泵(一台):真空系统(一套):测温测压计(一台):饪温槽(一套):氢基甲酸铵 (实验致自制) 四.实验步骤 相(联救八 团餐装置祭困 1.等压计A管中装入氨基甲酸铵(约占A管一半),将等压计接入真空系统。见图一。 2.试调 3.确认不新 下继续拍气并调节恒温温度为(30士0.1)℃.20mm后AB管上 方空与氨甲酸铵休 已被排尽。将三通活塞的 嘉监非室的瑞新全安 接通 地 复多次才修使BC管液面最终持平,反应达到平衡。判断反应平衡需BC液面持平保持2n以上。记 即,值,30℃时应为17士0.5kP,如果超出误差范用,偏大表明空气未排尽,偏小表明未达平衡。切 实作好这一步,后续步骤才能准确, 4.恒温槽逐渐升温,调出33℃或34℃(为练习调节恒温槽,我们规定调到整数摄氏温度)·在 升湿过程中边升温边缓缓放入空气使等压计BC二液面随时接近齐平,不让分解气体从C管逸出,更 不能放进空气过多过快使空气进入B管(否则要重新抽气)·待调到所需温度后,BC液面特平2mn 以上,反应再次达到平衡,记即,值,计算P 5.同法再测定2一3个温度的分解压总温度隔3一4℃ 五。数据处理
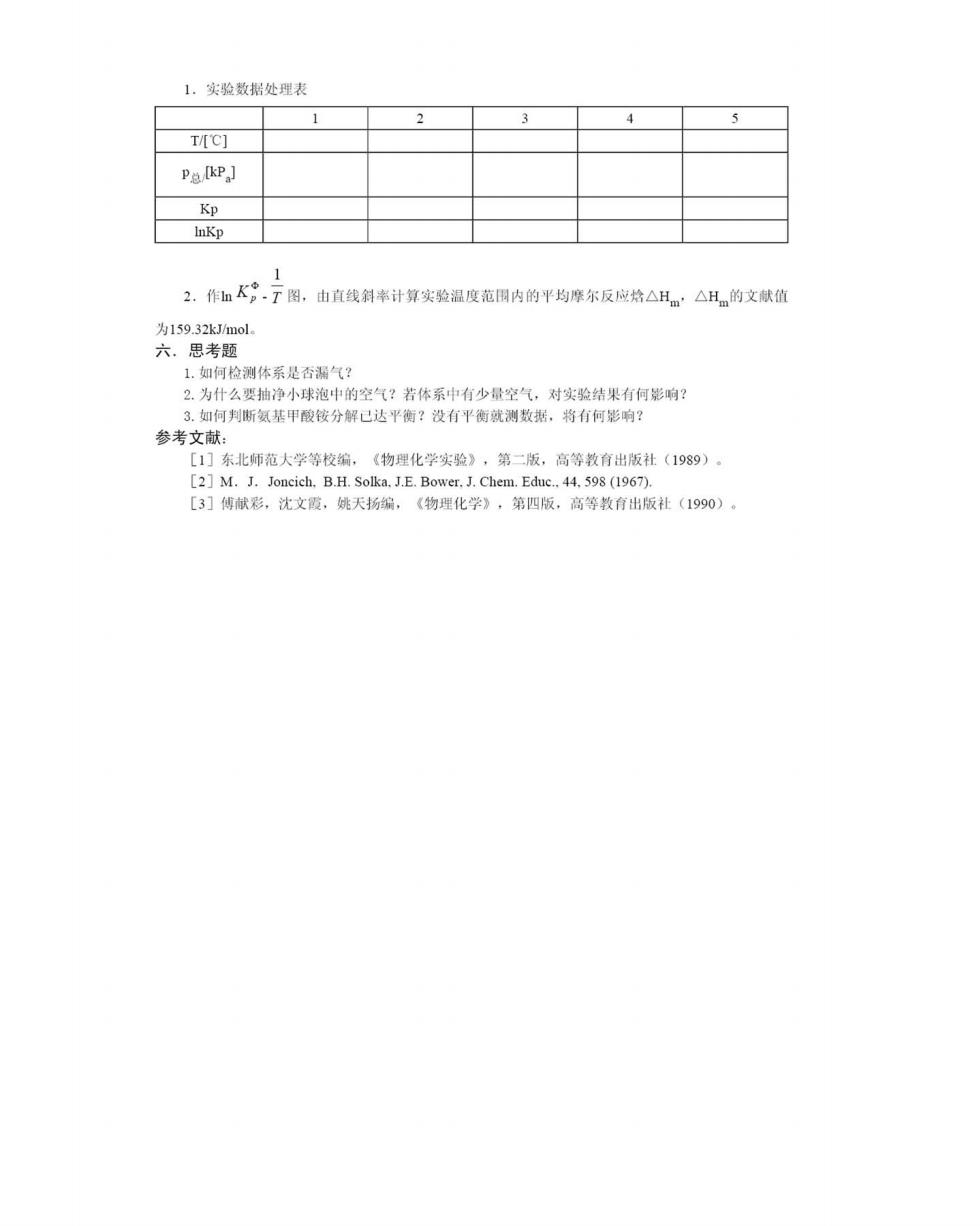
1.实验数据处理表 3 4 T/C] P总kP,] Kp InKp 2.作mK9.T图。由直线斜率计算实验温度范围内的平均摩尔反应烙△Hm:△H的文献值 为159.32 kJ/mol. 六,思考题 1.如何检测体系是否漏气? 2.为什么要抽净小球泡中的空气?若体系中有少量空气,对实验结果有何影响? 3.如何判断氨基甲酸铵分解己达平衡?没有平衡就测数据,将有何影响? 参考文献: [1]东北师范大学等校编,《物理化学实验》,第二版,高等教育出版社(1989)。 [2]M.J.Joncich.B.H.Solka.J.E.Bower.J.Chem.Educ..44.598(1967). [3]傅献彩,沈文霞,姚天扬编,《物理化学》,第四版,高等教有出版社(1990)