
实验三燃烧热的测定 一、实验目的 1,用氧弹式热量计测定蔡的燃烧热。 2了解量热法的基本原理,掌握用量热法测定燃烧热的实验方法 3.了解氧气钢瓶的操作规程。 二、实验原理 燃烧热是指在1atm(101.325kPa)和一定温度下1mol可燃烧物质完全燃烧时放出的热 量。测定燃烧热一般使用量热法,其基本原理是样品燃烧所放出的热量Q全部由量热体系 (图10-9中内简以内的部分,主要是一定数量的水)所吸收,Q=C△T,式中,△T是体系 吸热后的温度升高;C为体系的热容,由燃烧一定量的标准物质来标定。标准物质(一般采 用苯甲酸,下标记为“1”)完全燃烧后放出的热量Q是已知的,测定△T可算得C 品,在相同实袋条件下测定一定量的待测物度(体实验为素,记为“2完企指烧后体系 温度的升高△T:可算得放出的热量为C=C△=Q,公二。因然烧反应是在氧米中恒容 下进行的(图10-10),所以测得的热是恒容热。将待测物质的量归一成1mol(乘上因子 兰为测物质的质盐,M为率尔质量)复是摩尔容热,提帮下式为尔恒医 热,就是所求之燃烧热。 △Hm=(Q2)p=(Q2),十△(p=(Q2),+RT△n 设反应中的气体为理想气体并忽略固体或液体的体积,△n为1mol待测物质完全燃烧后气体 组分物质的量的增量。对于萘的燃烧反应△n=一2. 由上述原理可知,要准确测定样品的燃烧热,必须做到: ①准确称量样品并防止损失: ②样品完全燃烧 ③减少量热体系与环境的热交换, ④准确测定量热体系的温度变化, 三、仪器和试剂 WHR-15智能型氧弹式热量计1套:压片机4台(公用)氧气钢瓶与充氧机1套(公 用):燃烧丝;苯甲酸(二级品):茶(二级品)。 四、实验步骤 1.熟悉热量计的构造 整套仪器如图10-9所示。内筒以内的部分为量热体系,主要是一定数量的水和燃烧 用的氧弹。内篇外面有一空气绝热层,内筒由绝热垫片4架起,上方有绝热胶板5覆盖, 减少传热与水分蒸发。同时,仪器的外套1内可灌入与体系温度相近的水 为使量热体 系温度很快达到均匀,装有搅拌杆10,由发动机6带动。为防止通过搅拌棒传热,金属 搅拌棒上端用绝热良好的塑料与发动机传动装置连接。体系的温度变化是用贝克曼温度 计测量的,本实验用微机智能测温系统代替贝克曼温度计,测温精度0.01℃能满足一般 实验的要求。样品的燃烧点火由控制台的电点火装置施行。图10-10是氧弹的构造。氧弹 是用不锈锅制成的,主要部分有厚壁圆筒1,弹盖2和螺帽3紧密相连:在弹盖2上装有 用来充入氧气的进气孔4、排气孔5和电极6,电极直通弹体内部,同时作为燃烧皿7的 支架;为了将火焰反射向下而使弹体温度均匀,在另一电极8(同时也是进气管)的上方 还装有火焰遮板9 2.按顺序正确启动在线监控程序和多功能控制箱。 3.测定量热体系的热容

图10-9氧弹式量热计 图10-10氧弹的构造 】一世热计外套(套内中空可以盛水):2,子一搅拌器隔套, 1一厚璧图简:2一弹莹:3二螺 气进气孔 电机支方 排气丑 电 曼温度计(或其他温度传感器),12一读数放大镜, 8一另一个电极《同时作为进气管)9一火焰 记录标准样品苯甲酸的燃烧曲线 (1)压片粗称约1g的标准样品苯甲酸,在压模中慢慢倒入样品粉末用力压成圆片。 刷去片上和边缘的浮粉,用分析天平准称至0.0001g。 (2)装样旋开氧弹的弹盖放在支架上,把燃烧丝一端穿入电极6的小孔内绚紧,另 端缠在电极8的小螺杆上。样品悬于燃烧皿的上方,燃烧丝不要绷紧以免电极8和6接触形 成短路(见图10-10)。用万用表检查两电极是否通路,如不通路或接触不良需调整至通路 为止。将弹盖与弹筒旋紧,充以1500~2000kPa(15~20atm)的氧气,试漏(将整个氧弹 浸没水中看有无气泡逸出)。将氧弹放人内简,倒人比室温低1℃的3000mL自来水,确认在 线监控程序和多功能控制箱已经正确启动后,将点火插头插人电极,盖好胶板5(图10-9), 将控温探头插人内桶的水中。注意测温探头和搅拌器均不得接触氧弹和内简。 (3)标准样品的燃烧开动搅拌电机,测定水祖,此后每隔1min记录次温度,可见 温度缓慢上升。5min后启动点火开关通电点火(点火后数秒钟关掉点火开关),正常情况下 燃烧丝通电受热引燃棉线并使样品燃烧,在控制台上可见指示灯一亮即灭,过一两分钟后水 温迅速上升,表示样品已燃烧。若灯亮后不灭,表示燃烧丝没有烧断,未引燃棉线和样品 可加大电流引发燃烧。如果无效或指示灯一开始就不亮,则应打开氧弹检查。可能是电极 短路、燃烧丝与电极接触不良或燃烧丝断开等原因,应根据具体情况排除故,继续实验, 自点火后,温度改为每隔0.5min记录一次,直至两次读数差值小于0.02℃,然后读数间隔 恢复lmin,继续l0min左右,实验终止.。 (4)关闭控制台总电源开关,拆卸仪器,打开氧弹,观察样品是否燃烧完全,测量燃烧 丝剩余长度。 .2
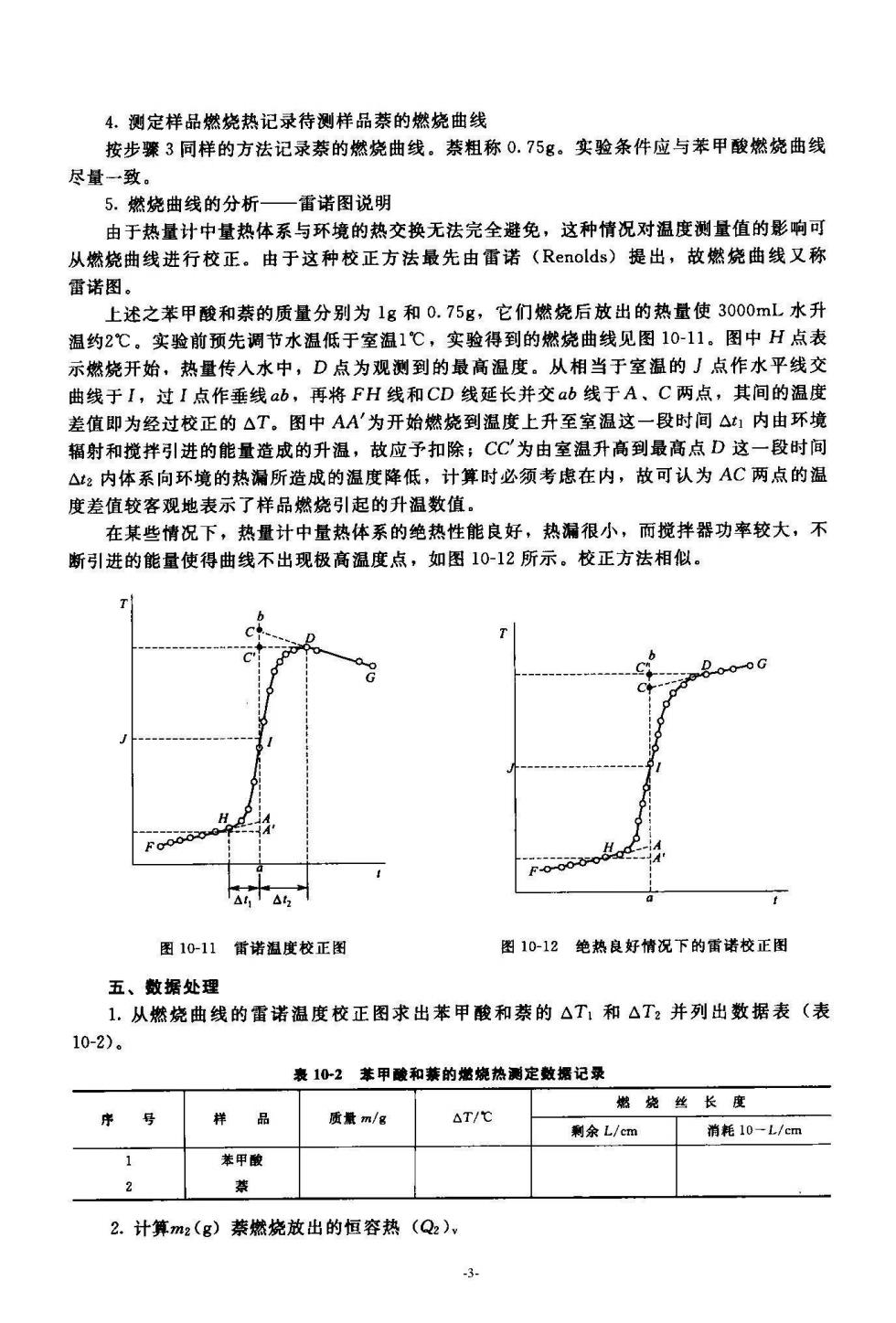
4.测定样品燃烧热记录待测样品萘的燃烧曲线 按步骤3同样的方法记录萘的燃烧曲线。萘粗称0.75g。实验条件应与苯甲酸燃烧曲线 尽量一致。 5.燃烧曲线的分析—雷诺图说明 由于热量计中量热体系与环境的热交换无法完全避免,这种情况对温度测量值的影响可 从燃烧曲线进行校正。由于这种校正方法最先由雷诺(Renolds)提出,故燃烧曲线又称 雷诺图。 上述之苯甲酸和萘的质量分别为1g和0.75g,它们燃烧后放出的热量使3000mL水升 温约2℃。实验前预先调节水温低于室温1℃,实验得到的燃烧曲线见图10-11,图中H点表 示燃烧开始,热量传人水中,D点为观测到的最高温度。从相当于室温的J点作水平线交 曲线于I,过I点作垂线ab,再将FH线和CD线延长并交ab线于A、C两点,其间的温度 差值即为经过校正的△T。图中AA为开始燃烧到温度上升至室温这一段时间△]内由环境 辐射和搅拌引进的能量造成的升温,故应予扣除;CC为由室温升高到最高点D这一段时间 △2内体系向环境的热漏所造成的温度降低,计算时必须考虑在内,故可认为AC两点的温 度差值较客观地表示了样品燃烧引起的升温数值。 在某些情况下,热量计中量热体系的绝热性能良好,热漏很小,而搅拌器功率较大,不 断引进的能量使得曲线不出现极高温度点,如图10-12所示。校正方法相似。 o-o0o0 图10-11诺温度校正图 图10-12绝热良好情况下的雷诺校正图 五、数据处理 1.从燃烧曲线的面诺温度校正图求出苯甲酸和萘的△T1和△T2并列出数据表(表 10-2). 表1心-2苯甲酸和养的烧热测定数据记录 嫩烧丝长度 序号 样 △T/ 剩余L/cm 消耗10-L/cm 装甲酸 2.计算m2(g)萘燃烧放出的恒容热(Q2)

8:+8:-8器 (as.-87@.+Qa]-Qa: =8-[-26.48m-6.69×10-3(10-L1]+6.69×10-(10-L2) 式中,数据一26.48(kJ)为每克苯甲酸的恒容燃烧热:一6.69X10-3(k)为每1cm燃烧 丝放出的热量。 3.计算萘的燃烧热 蔡的燃烧反应为: C10H(固)+1202(气)→10C02(气)+4H20(液) 可知△n(气)=一2 尔恒容热为Q,=(@.一兰、式中侧为蔡的质量,M为蔡的廓尔质量12306 8/mol 萘的燃烧热为 △.Hm=Qmp=Qm.w-2RT 萘燃烧热文献值为一5154kJ/mol. 六、启示、思考、讨论 1,氧弹式热量计是一种精密的量热仪器,广泛用于测定可燃物质的热值。一般的量热 测定都是用苯甲酸来标定仪器的热容。中国计量科学院规定它是我国的二等量热标准物质。 本装置可测定绝大部分固态可燃物质,对一般的训练操作最好采用萘、葱、蔗糖、葡萄 糖、淀粉等。液态可燃物也可用热量计测定热值。沸点高的油类可直接置于燃烧皿中用引燃 物(如棉线)引燃测定沸点低的有机物 可用药用胶囊作为样品管,再用内径比胶 囊外径大0.5一1.0mm的薄壁玻璃管套 住,如图10-13胶囊的平均燃烧热值应预 先标定,处理数据时扣除。 2.在精密量热测定中需对氧弹中所含 的氮气的燃烧热值做校正。为此可预先在 胶囊 氧弹中加入5mL蒸馏水,燃烧后将生成的 稀HNO,溶液全部转移到150mL锥形瓶 图1013胶囊套玻璃管装样示意图 中煮沸片刻,用0.1mol/L的NaOH标准 溶液标定,每1 mLNaOH标准溶液相当 1抛铁丝:5-一胶囊内6一胶外 于5.98J的热值。这部分热值应从总的燃烧热中扣除。 3.测量温度上升最精德的仪器是贝克曼温度计。贝克曼温度计刻度间隔为0.01℃,用 放大镜可估读至0.002℃。本实验用徽机智能测温系统,测量精度0.01℃。也可用镍铬镍铝 或铜-康铜热电偶代替贝克曼温度计。用15对热电偶串联,温差1一2℃时热电势可达0.5~ 0.8mV,参考点置于装有水的保温瓶中,水的温度与量热体系水的初温相近,热电偶另 接点放入体系水中,用1mV自动平衡记录仪自动记录温度及其变化情况。 4.有一种绝热式热量计,在相当于图10-9内外简之间的空气层装有适当浓度的电解质 溶液(例如KC1溶液)并安置板橘电极,根据体系与溶液的温差自动控制加热电流使溶液 温度随时逼近体系温度。以此达到绝热,效果较好