正在加载图片...
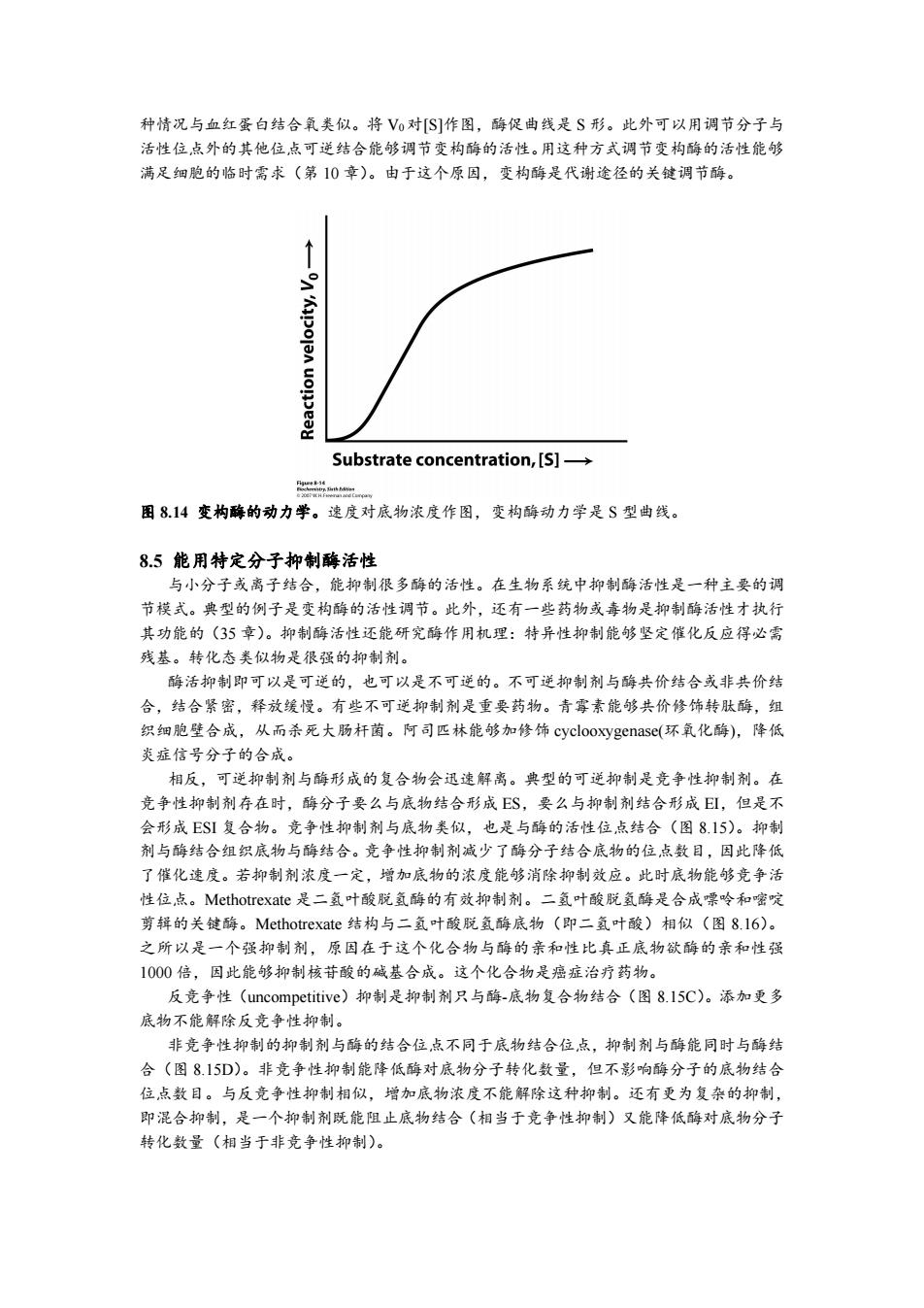
种情况与血红蛋白结合氧类似。将V0对[S]作图,酶促曲线是S形。此外可以用调节分子与 活性位点外的其他位点可逆结合能够调节变构酶的活性。用这种方式调节变构酶的活性能够 满足细胞的临时需求(第10章)。由于这个原因,变构酶是代谢途径的关键调节酶。 号 Substrate concentration,[S]-> 二 图814变构酶的动力学。速度对底物浓度作图,变构酶动力学是S型曲线。 8.5能用特定分子抑制酶活性 与小分子或离子结合,能抑制很多酶的活性。在生物系统中抑制酶活性是一种主要的调 节模式。典型的例子是变构酶的活性调节。此外,还有一些药物或毒物是抑制酶活性才执行 其功能的(35章)。抑制酶活性还能研究酶作用机理:特异性抑制能够坚定催化反应得必需 残基。转化态类似物是很强的抑制剂。 酶活抑制即可以是可逆的,也可以是不可逆的。不可逆抑制剂与酶共价结合或非共价结 合,结合紧密,释放缓慢。有些不可逆抑制剂是重要药物。青霉素能够共价修饰转肽酶,组 织细胞壁合成,从而杀死大肠杆菌。阿司匹林能够加修饰cyclooxygenase(环氧化酶),降低 炎症信号分子的合成。 相反,可逆抑制剂与酶形成的复合物会迅速解离。典型的可逆抑制是竞争性抑制剂。在 竞争性抑制剂存在时,酶分子要么与底物结合形成ES,要么与抑制剂结合形成EI,但是不 会形成ESI复合物。竞争性抑制剂与底物类似,也是与酶的活性位点结合(图8.15)。抑制 剂与酶结合组织底物与酶结合。竞争性抑制剂减少了酶分子结合底物的位点数目,因此降低 了催化速度。若抑制剂浓度一定,增加底物的浓度能够消除抑制效应。此时底物能够竞争活 性位,点。Methotrexate是二氢叶酸脱氢酶的有效抑制剂。二氢叶酸脱氢酶是合成嘌呤和嘧啶 剪辑的关镀酶。Methotrexate结构与二氢叶酸脱氢酶底物(即二氢叶酸)相似(图8.l6)。 之所以是一个强抑制剂,原因在于这个化合物与酶的亲和性比真正底物欲酶的亲和性强 1000倍,因此能够抑制核苷酸的碱基合成。这个化合物是癌症治疗药物。 反竞争性(uncompetitive)抑制是抑制剂只与酶-底物复合物结合(图8.l5C)。添加更多 底物不能解除反竞争性抑制。 非竞争性抑制的抑制剂与酶的结合位点不同于底物结合位点,抑制剂与酶能同时与酶结 合(图8.15D)。非竞争性抑制能降低酶对底物分子转化数量,但不影响酶分子的底物结合 位点数目。与反竞争性抑制相似,增加底物浓度不能解除这种抑制。还有更为复杂的抑制, 即混合抑制,是一个抑制剂既能阻止底物结合(相当于竞争性抑制)又能降低酶对底物分子 转化数量(相当于非竞争性抑制)。种情况与血红蛋白结合氧类似。将 V0对[S]作图,酶促曲线是 S 形。此外可以用调节分子与 活性位点外的其他位点可逆结合能够调节变构酶的活性。用这种方式调节变构酶的活性能够 满足细胞的临时需求(第 10 章)。由于这个原因,变构酶是代谢途径的关键调节酶。 图 8.14 变构酶的动力学。速度对底物浓度作图,变构酶动力学是 S 型曲线。 8.5 能用特定分子抑制酶活性 与小分子或离子结合,能抑制很多酶的活性。在生物系统中抑制酶活性是一种主要的调 节模式。典型的例子是变构酶的活性调节。此外,还有一些药物或毒物是抑制酶活性才执行 其功能的(35 章)。抑制酶活性还能研究酶作用机理:特异性抑制能够坚定催化反应得必需 残基。转化态类似物是很强的抑制剂。 酶活抑制即可以是可逆的,也可以是不可逆的。不可逆抑制剂与酶共价结合或非共价结 合,结合紧密,释放缓慢。有些不可逆抑制剂是重要药物。青霉素能够共价修饰转肽酶,组 织细胞壁合成,从而杀死大肠杆菌。阿司匹林能够加修饰 cyclooxygenase(环氧化酶),降低 炎症信号分子的合成。 相反,可逆抑制剂与酶形成的复合物会迅速解离。典型的可逆抑制是竞争性抑制剂。在 竞争性抑制剂存在时,酶分子要么与底物结合形成 ES,要么与抑制剂结合形成 EI,但是不 会形成 ESI 复合物。竞争性抑制剂与底物类似,也是与酶的活性位点结合(图 8.15)。抑制 剂与酶结合组织底物与酶结合。竞争性抑制剂减少了酶分子结合底物的位点数目,因此降低 了催化速度。若抑制剂浓度一定,增加底物的浓度能够消除抑制效应。此时底物能够竞争活 性位点。Methotrexate 是二氢叶酸脱氢酶的有效抑制剂。二氢叶酸脱氢酶是合成嘌呤和嘧啶 剪辑的关键酶。Methotrexate 结构与二氢叶酸脱氢酶底物(即二氢叶酸)相似(图 8.16)。 之所以是一个强抑制剂,原因在于这个化合物与酶的亲和性比真正底物欲酶的亲和性强 1000 倍,因此能够抑制核苷酸的碱基合成。这个化合物是癌症治疗药物。 反竞争性(uncompetitive)抑制是抑制剂只与酶-底物复合物结合(图 8.15C)。添加更多 底物不能解除反竞争性抑制。 非竞争性抑制的抑制剂与酶的结合位点不同于底物结合位点,抑制剂与酶能同时与酶结 合(图 8.15D)。非竞争性抑制能降低酶对底物分子转化数量,但不影响酶分子的底物结合 位点数目。与反竞争性抑制相似,增加底物浓度不能解除这种抑制。还有更为复杂的抑制, 即混合抑制,是一个抑制剂既能阻止底物结合(相当于竞争性抑制)又能降低酶对底物分子 转化数量(相当于非竞争性抑制)