正在加载图片...
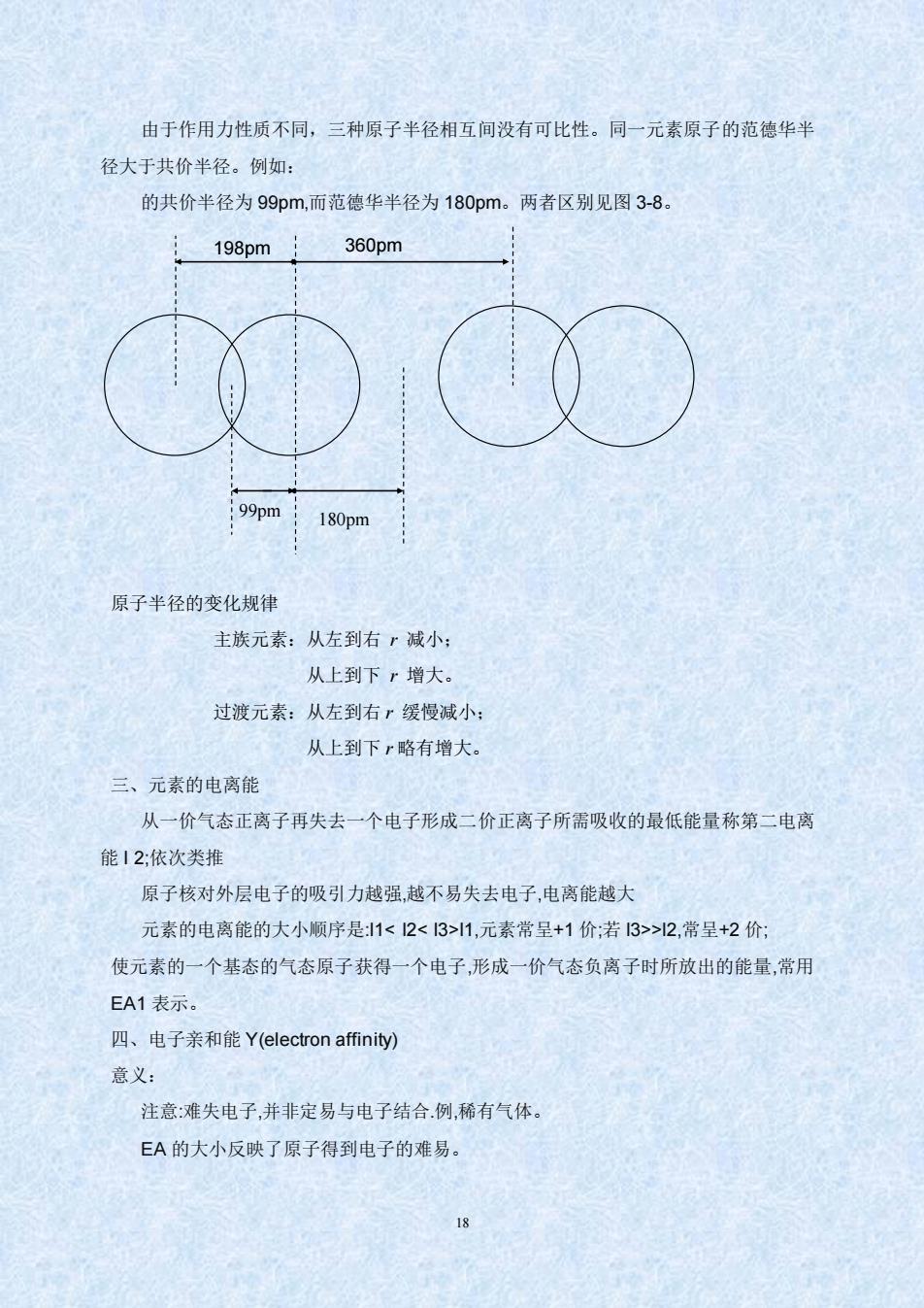
由于作用力性质不同,三种原子半径相互间没有可比性。同一元素原子的范德华半 径大于共价半径。例如: 的共价半径为99pm,而范德华半径为180pm。两者区别见图3-8。 198pm 360pm 99pm 180pm 原子半径的变化规律 主族元素:从左到右r减小: 从上到下r增大。 过渡元素:从左到右r缓慢减小: 从上到下r略有增大。 三、元素的电离能 从一价气态正离子再失去一个电子形成二价正离子所需吸收的最低能量称第二电离 能12:依次类推 原子核对外层电子的吸引力越强,越不易失去电子,电离能越大 元素的电离能的大小顺序是1<2<13>1,元素常呈+1价:若3>2,常呈+2价: 使元素的一个基态的气态原子获得一个电子,形成一价气态负离子时所放出的能量,常用 EA1表示。 四、电子亲和能Y(electron affinity) 意义: 注意:难失电子,并非定易与电子结合例,稀有气体。 EA的大小反映了原子得到电子的难易。 18 由于作用力性质不同,三种原子半径相互间没有可比性。同一元素原子的范德华半 径大于共价半径。例如: 的共价半径为 99pm,而范德华半径为 180pm。两者区别见图 3-8。 原子半径的变化规律 主族元素:从左到右 r 减小; 从上到下 r 增大。 过渡元素:从左到右 r 缓慢减小; 从上到下 r 略有增大。 三、元素的电离能 从一价气态正离子再失去一个电子形成二价正离子所需吸收的最低能量称第二电离 能 I 2;依次类推 原子核对外层电子的吸引力越强,越不易失去电子,电离能越大 元素的电离能的大小顺序是:I1< I2< I3>I1,元素常呈+1 价;若 I3>>I2,常呈+2 价; 使元素的一个基态的气态原子获得一个电子,形成一价气态负离子时所放出的能量,常用 EA1 表示。 四、电子亲和能 Y(electron affinity) 意义: 注意:难失电子,并非定易与电子结合.例,稀有气体。 EA 的大小反映了原子得到电子的难易。 99pm 180pm 198pm 360pm